Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Oximercuración Desmercuración Memo
Cargado por
Memo Ramirez Mendoza0 calificaciones0% encontró este documento útil (0 votos)
686 vistas5 páginasdescripción de el proceso de oximercuración y desmercuración
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentodescripción de el proceso de oximercuración y desmercuración
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
686 vistas5 páginasOximercuración Desmercuración Memo
Cargado por
Memo Ramirez Mendozadescripción de el proceso de oximercuración y desmercuración
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 5
OXIMERCURACIÓN-DESMERCURACIÓN
Alumno: José Guillermo Ramírez Mendoza
Carrera: IPQ
Grupo: 7°B
Lugar y Fecha: Salamanca, Gto, 24 de septiembre 2018
ÍNDICE DE FIGURAS
Figura 1. Oximercuración-Desmercuración ...................................................... 21
Figura 2. Adición de agua al doble enlace carbono-carbono .......................... 21
Figura 3. Ion mercurinio ................................................................................... 22
Figura 4. Reacción de 3,3-Dimetil-1-buteno. .................................................. 22
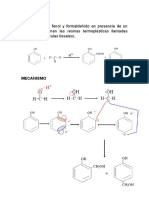
La oximercuración es un proceso químico que permite partiendo de un
alqueno obtener un alcohol con regioquímica Markovnikov. En presencia de
agua, los alquenos reaccionan con acetato mercúrico para dar compuestos
hidroximercúricos, que dan alcoholes por reducción.
Figura 1. Oximercuración-Desmercuración
Fuente: Química orgánica 5ta Edición, 1998.
La primera etapa, la oximercuración, implica la adición de OH y HgOAc al
doble enlace carbono-carbono. Luego, en la desmercuración, se reemplaza
HgOAc por H. La secuencia de la reacción se reduce a la hidratación del
alqueno, pero es de aplicación mucho más amplia que la hidratación directa.
El proceso en dos etapas de la oximercuración-desmercuración es rápido y
cómodo, se realiza en condiciones moderadas y da excelentes rendimientos, a
menudo superiores al 90%. El alqueno a temperatura ambiente se añade a una
solución acuosa de acetato mercúrico diluida con el disolvente tetrahidrofurano.
La reacción se completa, por lo general, en pocos minutos. No se aísla el
compuesto organomercúrico, sino que se reduce in situ con borohidruro de sodio,
NaBH4. (Se recupera el mercurio como una bola de mercurio elemental.)
La oximercuración-desmercuración es altamente regioselectiva y da
alcoholes que corresponden a la adición de Markovnikov de agua al doble enlace
carbono-carbono. Por ejemplo;
Figura 2. Adición de agua al doble enlace carbono-carbono.
Fuente: Química orgánica 5ta Edición, 1998.
La oximercuración comprende la adición electrofílica al doble enlace carbono-
carbono, actuando como electrófilo el ion mercúrico. La ausencia de
transposiciones y el alto grado de estereoselectividad (típicamente anti) en el
paso de la oximercuración es un argumento en contra de la formación de un
carbocatión abierto como intermediario. En cambio, se ha propuesto la formación
de un ion mercurinio cíclico, análogo a los iones bromonio y cloronio, implicado
en la adición de halógenos, ver figura 3.
Figura 3. Ion mercurinio.
Fuente: Química orgánica 5ta Edición, 1998.
El ion mercurinio es atacado por el disolvente nucleofílico agua, en este caso
para dar el producto de adición.
Aunque no se comprende realmente la reacción de desmercuración, se han
propuesto radicales libres como intermediarios. Cualqueira que sea el
mecanismo, generalmente la desmercuración es no estereoselectiva, por lo que
en ciertos casos especiales puede ir acompañada de transposiciones.
A pesar de la estereoselectividad de la primera etapa, por tanto, el proceso total
no es estereoselectivo en general. Puede haber transposiciones, pero no son
comunes. La reacción del 3,3-dimetil-1-buteno ilustra la ausencia de las
transposiciones típicas de los carbocationes intermediarios.
Figura 3. Reacción de 3,3-Dimetil-1-buteno.
Fuente: Química orgánica 5ta Edición, 1998.
Puede efectuarse la mercuración en diferentes disolventes para obtener
productos distintos de alcoholes. Este empleo de la solvomercuración como
herramienta de síntesis general se debe en gran parte a H. C. Brown.
BIBLIOGRAFÍA
Morrison, R., & Boyd, R. (1998). Química orgánica, versión en español. Estado
de México: Pearson.
También podría gustarte
- Carbocationes (Tarea Opcional) PDFDocumento12 páginasCarbocationes (Tarea Opcional) PDFVictor AristizabalAún no hay calificaciones
- Catálisis Homogénea Por Compuestos de CoordinaciónDocumento32 páginasCatálisis Homogénea Por Compuestos de CoordinaciónJohan Delgado100% (1)
- Baquelita Medio ÁcidoDocumento2 páginasBaquelita Medio ÁcidoAntonia RojoAún no hay calificaciones
- Cuestionario 1 FQIIDocumento4 páginasCuestionario 1 FQIIBryan BautistaAún no hay calificaciones
- BicicloalcanosDocumento3 páginasBicicloalcanosGrecia NicolleAún no hay calificaciones
- Obtención de ciclohexeno a partir de ciclohexanolDocumento5 páginasObtención de ciclohexeno a partir de ciclohexanolJAVIER GutierrezAún no hay calificaciones
- AzoderivadoDocumento3 páginasAzoderivadomb4000Aún no hay calificaciones
- Reducción de Ácidos CarboxílicosDocumento17 páginasReducción de Ácidos CarboxílicosJorge Mario Fernandez PeñaAún no hay calificaciones
- Ejercicios Debye HuckelDocumento2 páginasEjercicios Debye HuckelMichael RosoAún no hay calificaciones
- Electrocoagulación-Electrofloculación para Remoción de ColorantesDocumento23 páginasElectrocoagulación-Electrofloculación para Remoción de ColorantesFélix ArévaloAún no hay calificaciones
- Procedimiento Obtencion 2-Metil-2-Buteno y CiclohexenoDocumento8 páginasProcedimiento Obtencion 2-Metil-2-Buteno y CiclohexenoPaola Hernandez ValdezAún no hay calificaciones
- Práctica 3 Laboratorio de Equilibrio y CineticaDocumento4 páginasPráctica 3 Laboratorio de Equilibrio y CineticaDany PandaAún no hay calificaciones
- Diferencia Entre Los Tipos de Detectores en El IRDocumento2 páginasDiferencia Entre Los Tipos de Detectores en El IRKATHERINE LUCIA REVOLLAR CASASAún no hay calificaciones
- Practica N 2-ANALISIS QUIMICO CUANTITATIVODocumento8 páginasPractica N 2-ANALISIS QUIMICO CUANTITATIVOValentina LunaAún no hay calificaciones
- Práctica 5 - Método MohrDocumento10 páginasPráctica 5 - Método MohrJorgeLuisFR7Aún no hay calificaciones
- CINESCOPIODocumento2 páginasCINESCOPIONahomi C.80% (5)
- Antecedentes Practica 8Documento9 páginasAntecedentes Practica 8Tania MorenoAún no hay calificaciones
- Reactivo de Lucas, Reactivo de Brady, Disolucion de Almido 0.1% y Cloruro de AcetiloDocumento9 páginasReactivo de Lucas, Reactivo de Brady, Disolucion de Almido 0.1% y Cloruro de AcetiloAlexis Macias SaavedraAún no hay calificaciones
- Cuestionario de Práctica 4Documento4 páginasCuestionario de Práctica 4Athenas A.PAún no hay calificaciones
- Hidroxiquinolina PDFDocumento308 páginasHidroxiquinolina PDFFREILEN BRAYAN HUANCA CUSIAún no hay calificaciones
- AcetofenonaDocumento6 páginasAcetofenonafranklinmeraAún no hay calificaciones
- Practica 8 Obtencion de Alcohol Bencilico y Acido BenzoicoDocumento8 páginasPractica 8 Obtencion de Alcohol Bencilico y Acido BenzoicoBranco CastroAún no hay calificaciones
- Cuestionario de DestilaciónDocumento14 páginasCuestionario de DestilaciónLizeth MuñozAún no hay calificaciones
- Prac 3 Diels AlderDocumento11 páginasPrac 3 Diels AlderJosue Daniel Morales100% (1)
- Reducción selectiva m-dinitrobenceno m-nitroanilinaDocumento2 páginasReducción selectiva m-dinitrobenceno m-nitroanilinaAlfonso ARAún no hay calificaciones
- Pruebas Generales de AlcoholesDocumento8 páginasPruebas Generales de Alcoholesdario villamizarAún no hay calificaciones
- Colorantes AzoicosDocumento4 páginasColorantes AzoicosSEBASTIÁN VÁSQUEZ MOLINAAún no hay calificaciones
- Informe de Formacion de Alquenos Reacciones de EliminaciónDocumento2 páginasInforme de Formacion de Alquenos Reacciones de EliminaciónJefferson CárdenasAún no hay calificaciones
- Tarea CalculoDocumento12 páginasTarea CalculoAlexa Verónica AEAún no hay calificaciones
- CSTR reacción saponificaciónDocumento2 páginasCSTR reacción saponificaciónEddie ArciniegaAún no hay calificaciones
- Informe 0, Bioquímica.Documento6 páginasInforme 0, Bioquímica.Fernanda RodriguezAún no hay calificaciones
- Práctica 5Documento8 páginasPráctica 5Ana ChaparroAún no hay calificaciones
- Información previa del experimento no. 1Documento2 páginasInformación previa del experimento no. 1Iván RamosAún no hay calificaciones
- Síntesis Ciclohexanona Grupo ADocumento6 páginasSíntesis Ciclohexanona Grupo AmartinAún no hay calificaciones
- Semana 7 - Cálculos en El Análisis GravimétricoDocumento17 páginasSemana 7 - Cálculos en El Análisis GravimétricoPedro Luis Vargas AguilarAún no hay calificaciones
- Resumen Mecanismo de ReacciónDocumento3 páginasResumen Mecanismo de ReacciónMarcos HernándezAún no hay calificaciones
- Benzo Cain ADocumento11 páginasBenzo Cain ALaura Vera SarriaAún no hay calificaciones
- 8Documento5 páginas8Raul TeránAún no hay calificaciones
- Dureza de AguasDocumento10 páginasDureza de AguasJosue Cabrera Lopez0% (1)
- P4 - Reacción de ÓxidoReducción (Síntesis de Yodoformo) - Martinez - GR1ADocumento5 páginasP4 - Reacción de ÓxidoReducción (Síntesis de Yodoformo) - Martinez - GR1AKarla ArceAún no hay calificaciones
- Obtención de Acetileno y Propiedades de Alquinos y AlcanosDocumento7 páginasObtención de Acetileno y Propiedades de Alquinos y AlcanosJHONATAN MORALESAún no hay calificaciones
- Métodos Mohr, Volhard y Volhard ModificadoDocumento11 páginasMétodos Mohr, Volhard y Volhard ModificadoÁvila Velázquez Denisse IvetteAún no hay calificaciones
- Fisicoquímica II: Guía de evaluación ordinariaDocumento3 páginasFisicoquímica II: Guía de evaluación ordinariaAlejandro SanchezAún no hay calificaciones
- Determinacion Gravimetrica de Cloro en Un Cloruro SolubleDocumento6 páginasDeterminacion Gravimetrica de Cloro en Un Cloruro SolubleJuan GranadosAún no hay calificaciones
- Análisis de Las Propiedades Químicas de Los Aldehídos y CetonasDocumento9 páginasAnálisis de Las Propiedades Químicas de Los Aldehídos y CetonasJUAN DAVID LÓPEZ LÓPEZAún no hay calificaciones
- Informe EQUILIBRIO LÍQUIDODocumento6 páginasInforme EQUILIBRIO LÍQUIDOJhon Alexander HurtadoAún no hay calificaciones
- EjerciciosDocumento1 páginaEjerciciosArturo ValdelamarAún no hay calificaciones
- Laboratorio Semana 7 - 8990Documento4 páginasLaboratorio Semana 7 - 8990Ela NuñuveroAún no hay calificaciones
- Informe 6 Organica 2 Practica 6 de Laboratorio Aminoacidos y ProteinasDocumento21 páginasInforme 6 Organica 2 Practica 6 de Laboratorio Aminoacidos y ProteinasJairo Huaman EccoñaAún no hay calificaciones
- Ejercicios de ElectroDocumento3 páginasEjercicios de ElectroMicael FazzAún no hay calificaciones
- Síntesis de colorantes azoicosDocumento16 páginasSíntesis de colorantes azoicosJeffersonPalaciosAún no hay calificaciones
- Laboratorio Fisicoquímica Pract 10Documento11 páginasLaboratorio Fisicoquímica Pract 10Axel Moreno ModestoAún no hay calificaciones
- Asesorías PAC Oct 2022Documento27 páginasAsesorías PAC Oct 2022Carol Mayte Betanzos RuizAún no hay calificaciones
- Síntesis de P-AminoacetanilidaDocumento3 páginasSíntesis de P-AminoacetanilidaaaAún no hay calificaciones
- Práctica 1 Química Orgánica 2semestreDocumento5 páginasPráctica 1 Química Orgánica 2semestreDiana Katherine0% (1)
- Resumen Mecanismo ClemmensenDocumento2 páginasResumen Mecanismo ClemmensenFer RuelasAún no hay calificaciones
- Practica2obtencionden BromobutiloDocumento5 páginasPractica2obtencionden BromobutiloJonatan Estevez JacomeAún no hay calificaciones
- Laboratorio FQ II Guevara Bernardo ArianeDocumento13 páginasLaboratorio FQ II Guevara Bernardo ArianeAndy AlegreAún no hay calificaciones
- Preguntas Informe Org2Documento10 páginasPreguntas Informe Org2Ela PachecoAún no hay calificaciones
- Sintesis de Cloruro de TerbutiloDocumento8 páginasSintesis de Cloruro de TerbutiloclaudiaAún no hay calificaciones
- INSTRUMENTACION-Y-CONTROL-PRACTICA-2 FinalDocumento6 páginasINSTRUMENTACION-Y-CONTROL-PRACTICA-2 FinalMemo Ramirez MendozaAún no hay calificaciones
- Ecuacion de Estado Benedict Webb RubinDocumento12 páginasEcuacion de Estado Benedict Webb RubinMemo Ramirez MendozaAún no hay calificaciones
- Simulación y optimización de procesos con la ecuación BWRDocumento8 páginasSimulación y optimización de procesos con la ecuación BWRMemo Ramirez MendozaAún no hay calificaciones
- Proceso de Biorremediación Del Suelo Contaminado Por HidrocarburosDocumento16 páginasProceso de Biorremediación Del Suelo Contaminado Por HidrocarburosMemo Ramirez MendozaAún no hay calificaciones
- Presentación Blitz CrudexDocumento9 páginasPresentación Blitz CrudexMemo Ramirez MendozaAún no hay calificaciones
- Benedict Webb Rubin OPTIMIZACIONDocumento12 páginasBenedict Webb Rubin OPTIMIZACIONMemo Ramirez MendozaAún no hay calificaciones
- Cap 2 Tecnicas de OptimizacionDocumento15 páginasCap 2 Tecnicas de OptimizacionMemo Ramirez MendozaAún no hay calificaciones
- Presentación Blitz CrudexDocumento9 páginasPresentación Blitz CrudexMemo Ramirez MendozaAún no hay calificaciones
- EXTRACCIÓNDocumento10 páginasEXTRACCIÓNMemo Ramirez MendozaAún no hay calificaciones
- BacteriasDocumento7 páginasBacteriasMemo Ramirez MendozaAún no hay calificaciones
- Presentación Blitz CrudexDocumento9 páginasPresentación Blitz CrudexMemo Ramirez MendozaAún no hay calificaciones
- Informe de Ocurrencia (Ejemplo) PDFDocumento1 páginaInforme de Ocurrencia (Ejemplo) PDFMemo Ramirez MendozaAún no hay calificaciones
- INSTRUMENTACION-Y-CONTROL-PRACTICA-2 Final PDFDocumento6 páginasINSTRUMENTACION-Y-CONTROL-PRACTICA-2 Final PDFMemo Ramirez MendozaAún no hay calificaciones
- Ensayos de bioremediación de suelos contaminadosDocumento1 páginaEnsayos de bioremediación de suelos contaminadosMemo Ramirez MendozaAún no hay calificaciones
- CSS BOOKS: PROPIEDADES DE LAS SUSTANCIAS PURASDocumento2 páginasCSS BOOKS: PROPIEDADES DE LAS SUSTANCIAS PURASMemo Ramirez Mendoza50% (2)
- Benedict Webb Rubin OPTIMIZACIONDocumento12 páginasBenedict Webb Rubin OPTIMIZACIONMemo Ramirez Mendoza100% (1)
- Seguridad Industrial PDFDocumento2 páginasSeguridad Industrial PDFMemo Ramirez MendozaAún no hay calificaciones
- Criterios para la selección de tuberías basada en prestaciones equivalentesDocumento82 páginasCriterios para la selección de tuberías basada en prestaciones equivalentesAlejandro Alvarez100% (1)
- Simulación y optimización de procesos con la ecuación BWRDocumento8 páginasSimulación y optimización de procesos con la ecuación BWRMemo Ramirez MendozaAún no hay calificaciones
- Institutos Criterio Seleccion TuberiasDocumento17 páginasInstitutos Criterio Seleccion TuberiasMemo Ramirez MendozaAún no hay calificaciones
- Proceso de Elaboración Del YogurtDocumento64 páginasProceso de Elaboración Del YogurtMemo Ramirez MendozaAún no hay calificaciones
- La química del carbono y los hidrocarburosDocumento20 páginasLa química del carbono y los hidrocarburosJose A CordovaAún no hay calificaciones
- Reactividad de Hidrocarburos. PaulaDocumento11 páginasReactividad de Hidrocarburos. PaulaPaula ArdilaAún no hay calificaciones
- Gasolinas y polímeros a partir del petróleoDocumento18 páginasGasolinas y polímeros a partir del petróleoAlbertoAún no hay calificaciones
- Craqueo TermicoDocumento9 páginasCraqueo TermicoMarii Cl To50% (2)
- Química orgánica alquinosDocumento26 páginasQuímica orgánica alquinosJasmin Yanina Solis SantiagoAún no hay calificaciones
- Guia N - 3 Nomenclatura de Hidrocarburos ALIFATICOS Y CICLICOSDocumento8 páginasGuia N - 3 Nomenclatura de Hidrocarburos ALIFATICOS Y CICLICOSCarlos Colorado Garzon100% (1)
- Propiedades Físicas de Los Compuestos Orgánicos J.DazaDocumento6 páginasPropiedades Físicas de Los Compuestos Orgánicos J.DazaJesus Daza ArevaloAún no hay calificaciones
- ResonanciaDocumento111 páginasResonanciaErikaBedoyaAún no hay calificaciones
- Trabajo de Química Zaray 2Documento7 páginasTrabajo de Química Zaray 2gianny mendezAún no hay calificaciones
- Propiedades y métodos de obtención de compuestos nitrogenados y haluros orgánicosDocumento11 páginasPropiedades y métodos de obtención de compuestos nitrogenados y haluros orgánicosAngelica SorianoAún no hay calificaciones
- Libro de Química OrgánicaDocumento307 páginasLibro de Química OrgánicaOscar Sierra PugaAún no hay calificaciones
- 6 - Nomenclatura de Los Compuestos OrganicosDocumento14 páginas6 - Nomenclatura de Los Compuestos OrganicosjonasgalAún no hay calificaciones
- Compuestos Organicos-2Documento26 páginasCompuestos Organicos-2Matias ReynosoAún no hay calificaciones
- Reporte 3 Sintesis de Un Alqueno OrgaDocumento17 páginasReporte 3 Sintesis de Un Alqueno OrgaSTEPHANY JANETH GARCIA CORDONEROAún no hay calificaciones
- Libro1 2Documento136 páginasLibro1 2MelanyValenciaAún no hay calificaciones
- Sílabo 2022-IDocumento3 páginasSílabo 2022-IKARINA ANDREA CASTILLO CALLEAún no hay calificaciones
- Repaso de Química Orgánica 1er SemestreDocumento7 páginasRepaso de Química Orgánica 1er SemestreJanice Vargas HinojosaAún no hay calificaciones
- Copilación Tarea Uno HidrocarburosDocumento36 páginasCopilación Tarea Uno HidrocarburosMarĭa Camĭla MontoyaAún no hay calificaciones
- Organica HidrocarburoasDocumento13 páginasOrganica HidrocarburoasLuchito Bipolxr Bg MejiaAún no hay calificaciones
- Informacion Del Tema 3Documento7 páginasInformacion Del Tema 3Hecyulit CastroAún no hay calificaciones
- Momentos Dipolares MolecularesDocumento18 páginasMomentos Dipolares MolecularesJhon Alex ConchacallaAún no hay calificaciones
- Nomenclatura QoDocumento26 páginasNomenclatura QoSelena Estefania Guaman ParedesAún no hay calificaciones
- Co MP QUIMICA Unidad IIIDocumento53 páginasCo MP QUIMICA Unidad IIIDaniela RamírezAún no hay calificaciones
- Química orgánica cicloalquinos y cicloalcanosDocumento4 páginasQuímica orgánica cicloalquinos y cicloalcanosSirly MartinezAún no hay calificaciones
- Proyecto 1. ItscoDocumento70 páginasProyecto 1. ItscoAndry P. LeonAún no hay calificaciones
- AlquenosDocumento49 páginasAlquenosMaría Armijo Delgado0% (1)
- Resumen Final OrganicaDocumento69 páginasResumen Final OrganicaKatia Agustina ZambranoAún no hay calificaciones
- Situación ProblemaDocumento9 páginasSituación ProblemaWilder Velasco CordobaAún no hay calificaciones
- ALQUENOS y AlquinosDocumento5 páginasALQUENOS y AlquinosjofeguviAún no hay calificaciones
- Capitulo 1.2 - Isomeros Cis-Trans PDFDocumento9 páginasCapitulo 1.2 - Isomeros Cis-Trans PDFMau RodriguezAún no hay calificaciones