Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Termodinámica: Conceptos clave de entalpía, calor y reacciones químicas
Cargado por
Tatiana RoblesDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Termodinámica: Conceptos clave de entalpía, calor y reacciones químicas
Cargado por
Tatiana RoblesCopyright:
Formatos disponibles
2.
TEORÍA
2.1 Entalpia de reacción
Requena, A., Zuñiga, J. y Bastida, A. (2007) indican que se llama entalpía de reacción al
incremento entálpico de una reacción en la cual, tanto reactivos como productos están en
condiciones estándar (1 atm y 298 K) (concentración de sustancias disueltas = 1 M).
2.2. Calor de formación
Requena, A., Zuñiga, J. y Bastida, A. (2007) definen como calor de formación a la energía
involucrada en la formación de un mol de compuesto a partir de sus elementos en su estado
estándar. Si este calor es medido en condiciones standard de presión y temperatura (1 atm,
25ºC), se conoce como "calor estándar de formación
2.3. Calor de combustión
Emswiler, J. (1947) afirma que el calor de combustión puede expresarse como el calor
liberado cuando se quema una sustancia. Es el cambio térmico que sufren los reactivos
(combustible y comburente) al estar a temperatura y presión ideales para la combustión
transformándose en productos
2.4. Calor de absorción
Requena, A., Zuñiga, J. y Bastida, A. (2007) señalan que la absorción de calor se produce
cuando un cuerpo cede su calor a otro cuerpo que lo absorbe. Esto puede comprobarse al
mezclar agua caliente con agua fría. El agua fría absorbe el calor y se convierte en agua
tibia.
2.5. Calor de solución
Brown, T., LeMay, H., Brusten, B. y Brudge, J. (2004) sustentan que es la variación de
entalpia relacionada con la adición de una cantidad determinada de soluto a una cantidad
determinada de solvente a temperatura y presión constantes.
2.6. Calor de neutralización
Brown, T., LeMay, H., Brusten, B. y Brudge, J. (2004) señalan que el calor de
neutralización es definido como el calor producido cuando un equivalente gramo de ácido
es neutralizado por una base. El calor de neutralización tiene un valor aproximadamente
constante, en la neutralización de un ácido fuerte con una base fuerte.
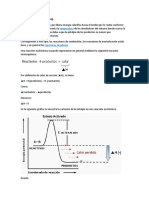
2.7. Concepto de reacción endotérmica y exotérmica.
Serway, R. y Faughn, J. (2001) informan que una reacción endotérmica es aquella que tiene
un incremento de entalpía o ΔH positivo. Es decir, la energía que poseen los productos es
mayor a la de los reactivos. En cambio una reacción exotérmica: reacción química que
desprenda energía, ya sea como luz o calor o lo que es lo mismo: con una variación
negativa de la entalpía; es decir: -ΔH
2.8. Concepto de Ácidos y bases fuertes.
Harris, D. (2006). Sustenta que un ácido fuerte es un ácido que se disocia casi por
completo en solución acuosa para ganar electrones. En cambio una base fuerte son
electrones fuertes que se ionizan completamente en soluciones acuosas, en condiciones de
presión y temperatura constantes. Además fundamentalmente son capaces de aceptar
protones H+.
2.9. Ley de Hess.
Gutiérrez, E. (1984) sustenta que la ley de hess es la variación de Entalpía en una reacción
química va ser la misma si esta se produce en una sola etapa o en varias etapas.
10. BIBLIOGRAFÍA
10.1. Requena, A., Zuñiga, J. y Bastida, A. (2007). “Introducción a la fisicoquímica:
Termodinámica”. Mexico: Editorial Pearson Educacion.
10.2. Emswiler, J. (1947). “Termodinámica”. Estados Unidos: Editorial Espasa-Calpe.
10.3. Brown, T., LeMay, H., Brusten, B. y Brudge, J. (2004). “Quimica”. 9na edición.
México Pearson Educación
10.4. Serway, R. y Faughn, J. (2001). “Fisica”. 5ta edición. México: Editorial Pearson
Educacion.
10.5. Harris, D. (2006). “Análisis químico cuantitativo”. España: Editorial Reverte.
10.6. Gutiérrez, E. (1984). “Quimica”. España: Editorial Reverte.
También podría gustarte
- BioenergéticaDocumento11 páginasBioenergéticaJEISON STEVEN MINAAún no hay calificaciones
- ENDOTERMICODocumento3 páginasENDOTERMICOKatheryn CobosAún no hay calificaciones
- Instituto Tecnológico de México: Campus ColimaDocumento7 páginasInstituto Tecnológico de México: Campus ColimaMartin Gomez MnedozaAún no hay calificaciones
- Determinacuion Practica N 4 (Recuperado Automáticamente)Documento3 páginasDeterminacuion Practica N 4 (Recuperado Automáticamente)Karen Aracelys Malpica GamezAún no hay calificaciones
- Reacción ExotérmicaDocumento12 páginasReacción ExotérmicaRYUMASUAún no hay calificaciones
- Cuestionario Calor de CombustiónDocumento1 páginaCuestionario Calor de CombustiónGbas_20100% (1)
- TERMOQUIMICADocumento13 páginasTERMOQUIMICAkarla catzinAún no hay calificaciones
- Bases Teórica de TermoquímicaDocumento4 páginasBases Teórica de TermoquímicaRODOLFO QUISPE SALAZARAún no hay calificaciones
- Termoquímica: reacciones exotérmicas y endotérmicasDocumento29 páginasTermoquímica: reacciones exotérmicas y endotérmicasmelaAún no hay calificaciones
- Articulo Calor de NeutralizacionDocumento15 páginasArticulo Calor de NeutralizacionGisellaPuentesAún no hay calificaciones
- II Unidad Termoquímica DiapositivasDocumento36 páginasII Unidad Termoquímica DiapositivasGianny SR100% (1)
- Termodinamica Calor de FormaciónDocumento11 páginasTermodinamica Calor de FormaciónṂarco BurbanoAún no hay calificaciones
- Definición de TermoquímicaDocumento11 páginasDefinición de Termoquímicacuat_007Aún no hay calificaciones
- Quimica II Tercera UnidadDocumento95 páginasQuimica II Tercera UnidadLeslie OrtizAún no hay calificaciones
- LEY DE HESS Y ENTALPIADocumento4 páginasLEY DE HESS Y ENTALPIABrenda Nickol Cueva FloresAún no hay calificaciones
- Termodinámica QuímicaDocumento7 páginasTermodinámica Químicacristian maycol aramburuAún no hay calificaciones
- Resumen Termoquímica (Brown) PDFDocumento2 páginasResumen Termoquímica (Brown) PDFDanyelQuispeAún no hay calificaciones
- PDF 20230422 193421 0000Documento9 páginasPDF 20230422 193421 0000Gilberto ChanAún no hay calificaciones
- Práctica 5 Del Lab Fisícoquímica 1.4Documento13 páginasPráctica 5 Del Lab Fisícoquímica 1.4eylen OviedoAún no hay calificaciones
- Termoquímica y EspontaneidadDocumento13 páginasTermoquímica y EspontaneidadKarla Lizeth Bogarin RaygozaAún no hay calificaciones
- Cambio de Fases, Reacciones Quimicas y Energia CaloricaDocumento24 páginasCambio de Fases, Reacciones Quimicas y Energia CaloricaAnggy Vargas Villalobos0% (1)
- Termoqu Mica 2017Documento45 páginasTermoqu Mica 2017Sarita Reina MartínezAún no hay calificaciones
- TermoquímicaDocumento4 páginasTermoquímicacamila alvaradoAún no hay calificaciones
- FISICO-QUIMICA-Calor-de-neutralizacion (Ahora Si)Documento24 páginasFISICO-QUIMICA-Calor-de-neutralizacion (Ahora Si)Hernán HuaynatesAún no hay calificaciones
- Actividades PreviasDocumento11 páginasActividades Previasfrida rojas garciaAún no hay calificaciones
- Entalpia FisicaDocumento5 páginasEntalpia FisicaKevin LopezAún no hay calificaciones
- Introduccion A La Termodinamica (Termoquimica)Documento5 páginasIntroduccion A La Termodinamica (Termoquimica)chorch_correa100% (1)
- DocumentoDocumento15 páginasDocumentobackyardigansjpcAún no hay calificaciones
- Tarea 6Documento3 páginasTarea 6arfaxad ulateAún no hay calificaciones
- Práctica 5 TermoquímicaDocumento8 páginasPráctica 5 TermoquímicaYetzein Mariana MonteroAún no hay calificaciones
- Wuolah-Free-Tema 2. Termoquímica PDFDocumento5 páginasWuolah-Free-Tema 2. Termoquímica PDFPaola FdezAún no hay calificaciones
- Calor de NeutralizaciónDocumento5 páginasCalor de NeutralizaciónQuirod JavierAún no hay calificaciones
- TERMOQUÍMICADocumento18 páginasTERMOQUÍMICAluis vidal maldonado tafurAún no hay calificaciones
- Resumen 22222Documento2 páginasResumen 22222BRITHANY RIVERAAún no hay calificaciones
- Termoquímica y Reacciones de CombustiónDocumento3 páginasTermoquímica y Reacciones de CombustiónJuan García100% (1)
- Termoquímica: Determinación experimental de la entalpía de neutralización entre NaOH y HClDocumento6 páginasTermoquímica: Determinación experimental de la entalpía de neutralización entre NaOH y HClDaniela Argandoña SanchezAún no hay calificaciones
- TERMOQUIMICADocumento42 páginasTERMOQUIMICAAseic Upes100% (1)
- Trabajo de Laboratorio P-7 Y P-8Documento8 páginasTrabajo de Laboratorio P-7 Y P-8Guadalupe CallisayaAún no hay calificaciones
- Tema 2 Termodinamica y TermoquimicaDocumento36 páginasTema 2 Termodinamica y TermoquimicaRommel LòpezAún no hay calificaciones
- Termoquimica IDocumento8 páginasTermoquimica IWil FERAún no hay calificaciones
- Documento 1Documento5 páginasDocumento 1Cami DiazAún no hay calificaciones
- Guia de Problemas de Quimica General Unpsjb CR 2Documento11 páginasGuia de Problemas de Quimica General Unpsjb CR 2Nahuel YurquinaAún no hay calificaciones
- Entalpia AporteDocumento3 páginasEntalpia Aportejeimy macedoAún no hay calificaciones
- TermoquímicaDocumento8 páginasTermoquímicaArletteAún no hay calificaciones
- Practica 3 TeoriaDocumento2 páginasPractica 3 TeoriaAle Maldonado SantosAún no hay calificaciones
- Entalpia y Ley de HessDocumento20 páginasEntalpia y Ley de HessAndrés HidalgoAún no hay calificaciones
- OBJETIVOSDocumento3 páginasOBJETIVOSWilliam Enrique Jimenez CasarrubiasAún no hay calificaciones
- Taller de Termodinamica - FisicoquimicaDocumento34 páginasTaller de Termodinamica - Fisicoquimicamaribel herrera ramirezAún no hay calificaciones
- Informe de TermoquimicaDocumento12 páginasInforme de TermoquimicaAntony Angel Vicente DueñasAún no hay calificaciones
- ENTALPIADocumento18 páginasENTALPIAYulexy Del Cisne Romero QuevedoAún no hay calificaciones
- 5) 6.2 TermoquimicaDocumento9 páginas5) 6.2 TermoquimicamarianomcasellaAún no hay calificaciones
- Calorimetria Informe 5Documento23 páginasCalorimetria Informe 5Gabriel Monzòn LunaAún no hay calificaciones
- 0 Q1.Termoquímica Calorimetría 1 OKDocumento40 páginas0 Q1.Termoquímica Calorimetría 1 OKNicolas ArboledaAún no hay calificaciones
- Reporte 1 Grupo 1 Q4Documento30 páginasReporte 1 Grupo 1 Q4Maria MadrigalAún no hay calificaciones
- Problemas de Química Inorgánica CompletaDocumento10 páginasProblemas de Química Inorgánica CompletaROCIO MADRIGAL HAún no hay calificaciones
- Conferencia 17, Temperatura, Presión, Calor, UnidadesDocumento18 páginasConferencia 17, Temperatura, Presión, Calor, UnidadesOctavio LizanoAún no hay calificaciones
- Problemas de Química Inorgánica CompletaDocumento10 páginasProblemas de Química Inorgánica CompletaROCIO MADRIGAL HAún no hay calificaciones
- Informe Calor Especifico de Un MetalDocumento19 páginasInforme Calor Especifico de Un MetalSebastian PereaAún no hay calificaciones
- Fisica3 2010 011Documento12 páginasFisica3 2010 011AnaAún no hay calificaciones
- Clase Práctica 3.1 Quimica General IDocumento13 páginasClase Práctica 3.1 Quimica General IJanice RomeroAún no hay calificaciones
- Medio Ambiente Trabajo CompletoDocumento9 páginasMedio Ambiente Trabajo CompletoMaxiTV&ALGOmásAún no hay calificaciones
- Paracetamol 250mg SupDocumento4 páginasParacetamol 250mg SupRONALDAún no hay calificaciones
- AdhesivosDocumento21 páginasAdhesivosLuz ValdezAún no hay calificaciones
- Estudio cualitativo de la reactividad de metalesDocumento12 páginasEstudio cualitativo de la reactividad de metalesYussef Kashkoush50% (2)
- Trabajo Practico n4Documento3 páginasTrabajo Practico n4Flavia Mariel AldereteAún no hay calificaciones
- Evolución del equilibrio ácido-baseDocumento94 páginasEvolución del equilibrio ácido-baseMartínz A. DiegoAún no hay calificaciones
- Marmolde TrasadoDocumento5 páginasMarmolde TrasadoLuis Miguel Angel Carire AndradeAún no hay calificaciones
- Impactos Ambientales Creados Por La Empresa Dow Chemical CompanyDocumento1 páginaImpactos Ambientales Creados Por La Empresa Dow Chemical CompanySergio TeranAún no hay calificaciones
- Tema 6 Presentacion (Complejometría)Documento32 páginasTema 6 Presentacion (Complejometría)elbetoavilaAún no hay calificaciones
- Analisis Caso Clinico BioquimicaDocumento16 páginasAnalisis Caso Clinico BioquimicaJose Carlos Wild DoriaAún no hay calificaciones
- Memoria de Matriz de CorteDocumento58 páginasMemoria de Matriz de CorteRuben Lazo OlivaresAún no hay calificaciones
- Ejercicos de Torres ConvencionalesDocumento5 páginasEjercicos de Torres ConvencionalesDanielAún no hay calificaciones
- For-Cas-01 Check List de Arnés de SeguridadDocumento2 páginasFor-Cas-01 Check List de Arnés de SeguridadAlejandro Arturo Prieto SchampkeAún no hay calificaciones
- Evidencia 2 Materiales de ConstrucciónDocumento3 páginasEvidencia 2 Materiales de ConstrucciónEsly MonsivaisAún no hay calificaciones
- Colorantes y ColoracionesDocumento7 páginasColorantes y ColoracionesJohn Baltazar HonorioAún no hay calificaciones
- Guía de ejercicios de concentración de mineralesDocumento12 páginasGuía de ejercicios de concentración de mineralesjvchique100% (2)
- Obras de captación y potabilización de agua en OaxacaDocumento4 páginasObras de captación y potabilización de agua en OaxacaDiana SalazarAún no hay calificaciones
- Perfilaje de Registros Eléctricos.Documento224 páginasPerfilaje de Registros Eléctricos.Henry Gustavo Chaves GutiérrezAún no hay calificaciones
- Practica No. 1Documento12 páginasPractica No. 1Verónica GaitánAún no hay calificaciones
- Material de Lectura Ciencias Naturales QuimicaDocumento73 páginasMaterial de Lectura Ciencias Naturales QuimicaBANCO DE SANGRE SARAVENAAún no hay calificaciones
- Composición Del SueloDocumento9 páginasComposición Del SueloBryan LemaAún no hay calificaciones
- Instalaciones de Gas 1Documento60 páginasInstalaciones de Gas 1Daniel L. AlvarezAún no hay calificaciones
- GMAWDocumento179 páginasGMAWcesar100% (1)
- Proyecto Empacar S.A Oficial.1Documento32 páginasProyecto Empacar S.A Oficial.1JEAN CARLA CANEDO ZAMBRANA100% (2)
- Practica 07Documento8 páginasPractica 07lleyns cuja reateguiAún no hay calificaciones
- Reanimación Con Líquidos en TraumaDocumento7 páginasReanimación Con Líquidos en TraumaEdison LucioAún no hay calificaciones
- Tipos de dieléctricos sólidos, gaseosos y líquidosDocumento2 páginasTipos de dieléctricos sólidos, gaseosos y líquidosPtgl Rmn AntnioAún no hay calificaciones
- Concentración de Menas AuríferasDocumento4 páginasConcentración de Menas AuríferasG77Aún no hay calificaciones
- Diez Recursos EducativosDocumento46 páginasDiez Recursos EducativosAngelJesusLavadenzPeñaAún no hay calificaciones