Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Recopilatorio Selectividad PDF
Recopilatorio Selectividad PDF
Cargado por
KEYSOLTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Recopilatorio Selectividad PDF
Recopilatorio Selectividad PDF
Cargado por
KEYSOLCopyright:
Formatos disponibles
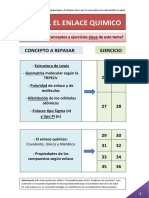
RECOPILATORIO EJERCICIOS DE SELECTIVIDAD ENLACE
COVALENTE
CUESTIÓN 1.-
Responde razonadamente a las siguientes cuestiones:
a) ¿Qué tipo de enlace presentan las siguientes sustancias: Cl 2, HCl, Cs y
CsCl? ¿Alguna de ellas conducirá la corriente eléctrica?
b) ¿En cuál de las siguientes moléculas podemos explicar su enlace mediante
el empleo de orbitales híbridos sp en BH3 o en CH4?
2
CUESTIÓN 2.-
Responde razonadamente a las siguientes cuestiones:
a)¿Qué geometría presentan las moléculas H2O, CO2y OF2 de acuerdo con el
modelo de repulsión de pares electrónicos? ¿Por qué H 2O tiene el punto de
ebullición más alto y es la más polar de las tres?
b)¿Qué tipo de hidrocarburos son los reactivos y productos de las siguientes
ecuaciones? y ¿cuál es el cambio de hibridación en los átomos de carbono al
producirse las reacciones? CH3 – C ≡C – CH3+ H2→CH3 – CH = CH – CH3.
CH3– CH = CH2+ Cl2→CH3 – CHCl – CH2Cl.
CUESTIÓN 3.-
Para las siguientes moléculas: NH3, H2O y CH4.
a)Escribe las estructuras de Lewis e indica su geometría de acuerdo con el
modelo de repulsión de pares electrónicos.
b)¿Son moléculas polares?
c)¿Por qué NH3y H2O tienen puntos de ebullición mayores que CH4?
CUESTIÓN 4.-
Para los siguientes compuestos: CaCl2, BCl3y CCl4:
a)¿Qué tipo de enlace tienen? ¿Alguno de ellos conducirá la corriente eléctrica
en estado líquido?
b)¿Cómo describiría el enlace de BCl 3 y CCl4 según la teoría de enlace de
valencia?
CUESTIÓN 5.-
Explica cuál o cuáles de las siguientes afirmaciones respecto al trifluoruro de
boro son ciertas:
a)El boro presenta una hibridación sp2 en dicho compuesto.
b)Se trata de una molécula polar ya que tiene enlaces polares.
c)Se trata de un compuesto que conduce la corriente eléctrica cuando se
encuentra en estado líquido.
También podría gustarte
- Ejercicios Resueltos Fracciones AlgebraicasDocumento3 páginasEjercicios Resueltos Fracciones AlgebraicasKEYSOLAún no hay calificaciones
- Estructura y EnlaceDocumento16 páginasEstructura y EnlaceKEYSOLAún no hay calificaciones
- Formato Inspección de Equipo EmergenciasDocumento3 páginasFormato Inspección de Equipo EmergenciasKEYSOL50% (2)
- 8 Minuetos Mozart PDFDocumento10 páginas8 Minuetos Mozart PDFKEYSOLAún no hay calificaciones
- Guia Del Usuario Toshiba E-Studio 2007Documento170 páginasGuia Del Usuario Toshiba E-Studio 2007KEYSOLAún no hay calificaciones
- Tema 4. Enlace Químico Libro EjerciciosDocumento15 páginasTema 4. Enlace Químico Libro EjerciciosKEYSOLAún no hay calificaciones
- El Diario de Noa-Aaron-Zigman PDFDocumento2 páginasEl Diario de Noa-Aaron-Zigman PDFKEYSOLAún no hay calificaciones
- Algebra Lineal-Seymour Lipschutz - Schaum-2 Edicion (Alta Calidad) 4.0Documento562 páginasAlgebra Lineal-Seymour Lipschutz - Schaum-2 Edicion (Alta Calidad) 4.0Lider Peñate100% (4)
- Mihura y SastreDocumento2 páginasMihura y SastreKEYSOL100% (1)
- Ejercicios TermoquímicaDocumento4 páginasEjercicios TermoquímicaKEYSOLAún no hay calificaciones
- Ejercicios Resueltos Logaritmos PDFDocumento4 páginasEjercicios Resueltos Logaritmos PDFrigoxmufiAún no hay calificaciones
- Hoja 1 Ejercicios Unidad 0 RepasoDocumento4 páginasHoja 1 Ejercicios Unidad 0 RepasoKEYSOLAún no hay calificaciones
- Literatura RenacimientoDocumento22 páginasLiteratura RenacimientoKEYSOLAún no hay calificaciones