Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Química 3ra Olimpiada 2da Etapa Todos
Cargado por
Wuen Q. SalinasDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Química 3ra Olimpiada 2da Etapa Todos
Cargado por
Wuen Q. SalinasCopyright:
Formatos disponibles
3ra OLIMPIADA CIENTIFICA ESTUDIANTIL PLURINACIONAL BOLIVIANA
19va OLIMPIADA BOLIVIANA DE QUIMICA SE PERMITE
2da Etapa (Examen Simultneo) EL USO DE
3ro de Secundaria TABLA
1. Los nmeros correspondientes de la columna A se debe completar en B en funcin a cada definicin:
A B
1 Elemento 3 Compuesto de estructura cristalina, maleable, buen conductor de la electricidad
10 Ptos
2 Destilacin 5 Partcula con carga positiva
3 Metal 4 Mezcla homognea de dos o mas sustancias
4 Solucin 1 Sustancia pura, con todos sus tomos iguales
5 Catin 2 Tcnica de separacin de lquidos en funcin a sus temperaturas de ebullicin
2. Describe en cada caso marcando con una X en la casilla correspondiente, si la materia de la que se habla es
una mezcla heterognea, mezcla homognea, compuesto o elemento:
Muestra Mezcla Heterognea Mezcla Homognea Compuesto Elemento
Oro X
10 Ptos Aire X
Cloruro de Sodio X
Vino X
Mineral de litio en el salar de Uyuni X
3. Tarija es el Departamento de Bolivia ms rico en hidrocarburos; el gas natural que tiene en mayor
proporcin metano, es transportado por gasoductos a los diferentes Departamentos. Completa en la columna
B de la siguiente tabla, la simbologa correspondiente a la columna A, de acuerdo al siguiente detalle:
A B
CF = Cambio Fsico Combustin del gas para producir energa CQ
CQ = Cambio Qumico
Fusin del asfalto CF
PI = Propiedad Intensiva
10 Ptos PE = Propiedad Extensiva Destilacin del petrleo CF
Combustin de la gasolina en los automviles CQ
4. Completa las siguientes ecuaciones qumicas y escribe el nombre de los productos marcados con *
a)2 H2O + Sb2O5 * H4Sb2O7 a) Acido Piro antimnico
b) 2 H2CO3 + Ca(OH)2 * Ca(HCO3)2 + 2 H2O b) Bicarbonato de Calcio Carbonato cido de Calcio
20 Ptos
c) H2Cr2O7 + 2 KOH * K2Cr2O7 + 2 H2O c) Dicromato de Potasio
d) SiO2 + H2O * H2SiO3 d) Acido meta silcico
5. Escribe las frmulas de los siguientes compuestos:
Nombre Frmula Nombre Frmula
1 Carbonato acido de Sodio NaHCO3 6 Cromato de Potasio K2CrO4
2 Superxido de Rubidio RbO2 7 Acido tetra brico H2B4O7
10 Ptos
3 Arsenamina AsH3 8 Oxido Ferroso Frrico Fe3O4
4 Sulfuro de Hidrgeno H2S 9 Acido piro silcico H6Si2O7
5 Hidrxido de Bario Ba (OH)2 10 Tiosulfato de Sodio Na2S2O3
6. Arqumedes deba determinar que la corona del rey Hiern era de oro, para ello peso la corona y la
introdujo en un recipiente lleno de agua; el peso de la corona fue de 482,5 g y el peso del agua demarrada
29.1 g. En base a estos datos subraya la respuesta correcta. d agua = 1 g/cm3, d oro = 19.3 g/cm3.
20 Ptos
a) No era de oro puro b) Era de oro puro c) Ninguno
7. Se cuenta con cinco materiales, cuyos pesos y volmenes se indican en la tabla siguiente:
Material A B C D E
Masa (g) 27.0 109.2 78.0 25.0 99.9
10 Ptos
Volumen (cm3) 10.0 14.0 10.0 2.2 37.0
Cuntas sustancias diferentes existen? Subraya la respuesta correcta
a) Una b) Dos c) Tres d) Cuatro e) Cinco
8. Seala la valencia del azufre en cada uno de los siguientes compuestos:
Compuesto Valencia
Acido sulfuroso +4
Acido Sulfrico +6
10 Ptos Dixido de Azufre +4
Acido sulfhdrico -2
Sulfato cprico +6
Ver lista de clasificados de esta etapa en: http://olimpiadas.educabolivia.bo
3ra OLIMPIADA CIENTIFICA ESTUDIANTIL PLURINACIONAL BOLIVIANA
19va OLIMPIADA BOLIVIANA DE QUIMICA
SE PERMITE
2da Etapa (Examen Simultneo) EL USO DE
TABLA
4to de Secundaria
1. Tarija es el Departamento de Bolivia ms rico en hidrocarburos; el gas natural que tiene en mayor
proporcin metano, es transportado por gasoductos a los diferentes Departamentos. Completa en la columna
B de la siguiente tabla, la simbologa correspondiente a la columna A, de acuerdo al siguiente detalle:
A B
CF = Cambio Fsico Combustin del gas para producir energa CQ
CQ = Cambio Qumico
Fusin del asfalto CF
PI = Propiedad Intensiva
10 Ptos PE = Propiedad Extensiva Destilacin del petrleo CF
Combustin de la gasolina en los automviles CQ
2. El siguiente cuadro muestra elementos representativos del Sistema Peridico:
GRUPO 1 2 13 14 15 16 17 18
A B C D E F G I
J K L
Marcando con F (Falso) V (Verdadero), indique como espera que varen sus propiedades.
a) G es mas electronegativo que F [ V ]
b) La afinidad electrnica de A es mayor que la de D [ F ]
10 Ptos c) El potencial de ionizacin de J es menor que el de K [ F ]
d) El potencial de reduccin de L es mayor que el de J [ V ]
e) El radio inico de K es mayor que el radio inico de G [ V ]
3. Complete la siguiente tabla, especificando los nmeros cunticos para el ultimo electrn de cada elemento:
10 Ptos Elemento Configuracin Electrnica n l m s
Cloro 1s2. 2s2. 2p6. 3s2. 3p5 3 1 +1 0 -1 + +
Nitrgeno 1s2. 2s2. 2p3 2 1 +1 0 -1 + +
Potasio 1s2. 2s2. 2p6. 3s2. 3p6. 4s1 4 0 0 + +
4. Analice las siguientes expresiones y marque con F (Falso) V ( Verdadero), segn corresponda
a) Los electrones prefieren ocupar niveles de energia mas elevada [ F ]
b) Los compuestos no polares son solubles en sustancias no polares como el Benceno. [ V ]
10 Ptos
c) Las propiedades extensivas de la materia no dependen de la cantidad de material examinado [ F ]
d) Los compuestos con enlaces covalentes son generalmente lquidos y gases. [ V ]
e) El conjunto de orbitales p puede contener un mximo de dos electrones [ F ]
5. Subraye el nombre que recibe el mtodo de separacin de mezclas que requiere de la realizacin de dos
10 Ptos cambios fsicos de la materia: primero una evaporacin seguida de una condensacin.
a) Filtracin b) Destilacin c) Sublimacin d) Decantacin e) Ninguna
6. De las siguientes sustancias, subraye la molcula no polar.
15 Ptos a) HCl b) H2O c) BF3 d) CHCl3 e) Ninguna
7. Escribe la frmula o el nombre para los siguientes compuestos:
N Frmula Nombre N Nombre Frmula
1 NaClO2 Clorito de Sodio 6 Acido ntrico HNO3
2 AlPO4 Fosfato de Aluminio 7 Acido tetra brico H2B4O7
20 Ptos
3 Ca2C Carburo de Calcio 8 Oxido doble de Uranio U3O8
4 H3AsO4 Acido orto Arsnico 9 Acido orto silcico H4SiO4
5 H2SO4 Acido sulfrico 10 Tiosulfato de Sodio Na2S2O3
8. En funcin a las electronegatividades sealadas en la tabla, determina el tipo de enlace que forman las
parejas de elementos indicados por inciso, representando con : I = Enlace inico, C = Enlace covalente no
polar, P = Enlace covalente polar.
15 Ptos Elemento 1 2 3 4 5
Electronegatividad 0.9 4.0 3.5 3.0 2.5
a) 1 con 2 b) 2 con 3 c) 3 con 3 d) 1 con 5 e) 4 con 5
I P C I P
Ver lista de clasificados de esta etapa en: http://olimpiadas.educabolivia.bo
3ra OLIMPIADA CIENTIFICA ESTUDIANTIL PLURINACIONAL BOLIVIANA
19va OLIMPIADA BOLIVIANA DE QUIMICA
SE PERMITE
2da Etapa (Examen Simultneo) EL USO DE
TABLA
5to de Secundaria
1. El siguiente cuadro muestra elementos representativos del Sistema Peridico:
GRUPO 1 2 13 14 15 16 17 18
A B C D E F G I
J K L
Marcando con F (Falso) V (Verdadero), indique como espera que varen sus propiedades.
a) E es mas electronegativo que A [ V ]
b) La afinidad electrnica de A es mayor que la de B [ F ]
10 Ptos c) El potencial de ionizacin de J es menor que el de L [ F ]
d) El potencial de reduccin de K es mayor que el de J [ V ]
e) El radio inico de K es mayor que el radio inico de I [ V ]
2. Ajustar por el mtodo del in electrn la siguiente ecuacin e indicar el coeficiente estequiomtrico del
10 Ptos
agente reductor: K2Cr2O7 + 6 H I + 8 H Cl O4 2 Cr (ClO4)3 + 2 K ClO4 + 3 I2 + 7 H2 O
Subraya la respuesta correcta: a) 8 b) 2 c) 1 d) 6 e) Ninguno
3. En funcin a las electronegatividades sealadas en la tabla. a) Determina el tipo de enlace que forman las
parejas de elementos indicados por inciso, representando con : I = Enlace inico, C = Enlace covalente
no polar, P = Enlace covalente polar.
Elemento 1 2 3 4 5
20 Ptos Electronegatividad 0.9 4.0 3.5 3.0 2.5
a) 1con 2 b) 2 con 3 c) 3 con 3 d) 4 con 4 e) 4 con 5
I P C C P
b) Escribe la estructura y el nombre del compuesto que es un solido cristalino:
NombreFLUORURO DE SODIOFrmulaNa F.
4. Escribe las frmulas o el nombre de los siguientes compuestos:
N Frmula Nombre N Nombre Frmula
1 BaCl2 Cloruro de Bario 6 Acido tetra brico H2B4O7
2 CuSO4 . 5 H2O Sulfato Cprico penta hidratado 7 Acido dicrmico H2Cr2O7
20 Ptos
3 CH4 Metano Hidruro de Carbono 8 Oxido doble de Hierro Fe3O4
4 H4As2O7 Acido Piro arsnico 9 Acido piro Silcico H6Si2O7
5 H3PO4 Acido orto fosfrico fosfrico 10 Tiosulfato de Sodio Na2S2O3
5. La glucosa C6H12O6 es una fuente natural de energa para el organismo, cuando se fermenta produce etanol
C2H5OH y dixido de carbono. a) Cuntos gramos de etanol se producen cuando se fermentan 2 moles de
glucosa? . Subraya la respuesta correcta
46.0 g 18.4 g 184.0 g 92.0 g Ninguno
10 Ptos
b) Cuntos moles de glucosa se necesitan para producir 880 g de dixido de carbono?
10.0 mol 1.0 mol 5.0 mol 20.0 mol Ninguno
6. Completa la siguiente tabla utilizando los datos que se proporcionan para cada elemento
Elemento Smbolo Z A P+ n e- Configuracin electrnica
Fosforo P 15 31 15 16 15 1s2. 2s2. 2p6. 3s2. 3p3
10 Ptos Potasio K 19 39 19 20 19 1s2. 2s2. 2p6. 3s2. 3p6. 4s1
7. La sacarosa comnmente se llama azcar y se encuentra extensamente distribuida por todo el reino vegetal
10 Ptos
en frutas, semillas, flores, y races. Cuando 6.84 g de sacarosa se oxidan se obtienen 10.56 g de dixido de
carbono y 4.00 g de agua. Cul es la frmula qumica de la sacarosa?.
Dato: Peso Molecular sacarosa = 180 g/mol Resp. C6H12O6
8. El agua se puede descomponer en hidrgeno, y oxgeno. Si tratamos 288 g de agua en una cuba electroltica.
a)Qu volumen de hidrgeno, medido en condiciones normales, se obtendr? Subraya la respuesta correcta
89.6 L 35.8 L 179.2 L 358.4 L Ninguno
10 Ptos
c) Cul es la composicin centesimal del agua? Resp. H = 11.11% O = 88.89 %
Ver lista de clasificados de esta etapa en: http://olimpiadas.educabolivia.bo
3ra OLIMPIADA CIENTIFICA ESTUDIANTIL PLURINACIONAL BOLIVIANA
19va OLIMPIADA BOLIVIANA DE QUIMICA SE PERMITE
2da Etapa (Examen Simultneo) EL USO DE
TABLA
6 to de Secundaria
1. La hexametilendiamina es un compuesto que se usa en la fabricacin del Nylon66, cuando se queman
0.3082 g de este compuesto se produce 0.7003 g de dixido de carbono y 0.3821 g de agua. En un anlisis
separado para determinar la cantidad de nitrgeno se uso 1.270 g del compuesto y se obtuvieron 0.3723 g de
20 Ptos amonaco. La densidad de vapor hallada para esta sustancia en C.N. fue de 5.19 g/L. Determinar la frmula
molecular de la hexametilendiamina. Marca con una X en la respuesta correcta.
a) C6H16N2[ X ] b) C3H8 N[ ] c) C4H10N2[ ] d)C2H8N [ ] e) Ninguno [ ]
2. Las soluciones fisiolgicas salinas que se usan en inyecciones intravenosas tienen una concentracin del 0.9 %
p/v de cloruro de sodio. a) Cuntos gramos de cloruro de sodio se necesitan para preparar 500 mL de la
10 Ptos solucin fisiolgica? Marca con una X en la respuesta correcta.
90.0 g [ ] 4.5 g [ X ] 45.0 g [ ] 9.0 g [ ] Ninguno [ ]
b) Cul es la molaridad de la solucin resultante? (suponer densidad de la solucin = 1 g/ml)
0.009 M [ ] 0.100 M [ ] 0.153 M [ X ] 0.900 M[ ] Ninguno [ ]
3. Cablebol necesita cobre puro para producir cables elctricos, pero el cobre de Bolivia est presente en la
naturaleza como Cu2S, obtenindose cobre metlico a partir de la ecuacin siguiente:
Cu2S (s) + O2 (g) Cu (s) + S O2 (g)
10 Ptos Si se cuenta con 600 g de Cu2S con una pureza del 80 % y se tiene 55 litros de oxgeno medidos a 35 C y 700
mm Hg. Cuntos Kg de Cu se puede obtener?. Marca con una X en la respuesta correcta.
0.254 Kg [ X ] 2.540 Kg [ ] 0.508 Kg [ ] 50.800 Kg [ ] Ninguno [ ]
4. A partir de la reaccin: 5 FeCl2 + KMnO4 + 8 HCl 5 FeCl3 + MnCl2 + KCl + 4 H2O
Hallar el valor de x con respecto a los coeficientes ( reactivos ) de la reaccin igualada. Subraya la
sustancia oxidada - sustancia reducida respuesta correcta
x
agente reductor
20 Ptos a) 3/8 b) 4/5 c) 5/4 d) 1/3 e) Ninguno
5. En funcin a las electronegatividades sealadas en la tabla. A) Determina el tipo de enlace que forman las
parejas de elementos indicados por inciso, representando con : I = Enlace inico, C = Enlace covalente no
polar, P = Enlace covalente polar.
10 Ptos Elemento 1 2 3 4 5
Electronegatividad 0.9 4.0 3.5 3.0 2.5
a) 1con 2 b) 2 con 3 c) 3 con 3 d) 4 con 4 e) 4 con 5
I P C C P
B) Escribe la estructura y el nombre del compuesto que es un solido cristalino:
NombreFLUORURO DE SODIOFrmulaNa F.
6. Cuntos gramos de CO tienen que mezclarse con 50 g de metano (CH4 ) para obtener una mezcla en la cual la
10 Ptos presin parcial del CO sea igual a la del metano?. Marca con una X en la respuesta correcta.
8.7 g [ ] 4.5 g [ ] 87.5 g [ X ] 875.0 g [ ] Ninguno [ ]
7. El acido clorhdrico es un precursor para la elaboracin de la cocana, siendo esta la razn por la cual no es
libre su comercializacin. Se decomiso un bidn de este compuesto, cuya concentracin es del 36 % p/p
10 Ptos teniendo una densidad de 1.38 g/cm3. Si se necesita preparar 1500 mL una solucin 0.5 N, Qu volumen
del acido del bidn tendramos que usar?. Marca con una X en la respuesta correcta.
110.2 mL [ ] 11.2 mL [ ] 55.1 mL [ X ] 551.0 mL [ ] Ninguno [ ]
8. Completa la siguiente tabla:
Compuesto Formula Estructura de Lewis N de enlaces Polaridad de la molcula
Molecular covalentes polares P = Polar X = No polar
Trifluoruro de BF3 F B F
10 Ptos boro 3 X
F
Agua H2O H O H
2 P
Cloro molecular Cl2 Cl Cl
0 X
Ver lista de clasificados de esta etapa en: http://olimpiadas.educabolivia.bo
También podría gustarte
- Problemas resueltos de Química Analítica CuantitativaDe EverandProblemas resueltos de Química Analítica CuantitativaCalificación: 5 de 5 estrellas5/5 (3)
- Química 3ra Olimpiada 3ra Etapa TodosDocumento5 páginasQuímica 3ra Olimpiada 3ra Etapa TodosRolando Mamani PayeAún no hay calificaciones
- Química 5ta Olimpiada 2da Etapa TodosDocumento4 páginasQuímica 5ta Olimpiada 2da Etapa TodosSalvador Yamil Limachi Limachi100% (1)
- 5OCQ2E5Documento2 páginas5OCQ2E5Lopez PedroAún no hay calificaciones
- 5ta Olimpiada Científica Estudiantil Plurinacional BolivianaDocumento4 páginas5ta Olimpiada Científica Estudiantil Plurinacional BolivianacaranaviluisAún no hay calificaciones
- Examenes Con Respuesta de La Tercera Etapa QuimicaDocumento12 páginasExamenes Con Respuesta de La Tercera Etapa Quimicasimplequimiquita100% (1)
- DisolucionesDocumento39 páginasDisolucionesRoger Fernández50% (2)
- 4ta Olimpiada Científica Estudiantil Plurinacional BolivianaDocumento4 páginas4ta Olimpiada Científica Estudiantil Plurinacional BolivianaSalvador Yamil Limachi LimachiAún no hay calificaciones
- Examen de Química de Secundaria con 10 PreguntasDocumento2 páginasExamen de Química de Secundaria con 10 Preguntasrolalvgut100% (2)
- Cap 07 - CapacitanciaDocumento4 páginasCap 07 - CapacitanciaWilder Montenegro0% (1)
- Presentación de Bailes Típicos de BoliviaDocumento4 páginasPresentación de Bailes Típicos de BoliviaPía VivancoAún no hay calificaciones
- PRIMER EXAMEN PARCIAL ÁREA QUÍMICA FECHA 18-09-2009 N PDFDocumento4 páginasPRIMER EXAMEN PARCIAL ÁREA QUÍMICA FECHA 18-09-2009 N PDFJohns ContrerasAún no hay calificaciones
- 4 t a OLIMPIADA CIENTÍFICA ESTUDI ANTIL PLURI NACIONAL BOLIVIANADocumento3 páginas4 t a OLIMPIADA CIENTÍFICA ESTUDI ANTIL PLURI NACIONAL BOLIVIANAKaterin Franco0% (2)
- Química 5ta Olimpiada 2da Etapa TodosDocumento4 páginasQuímica 5ta Olimpiada 2da Etapa TodosJose Edwin Estepa100% (1)
- Compositores de BoliviaDocumento1 páginaCompositores de BoliviaBryan Chambi100% (1)
- Texto de 4º QMCDocumento56 páginasTexto de 4º QMCVICTOR QUISPE FLORES67% (3)
- Solucionario Temas Trigonometría 4ºmatb BruñoDocumento40 páginasSolucionario Temas Trigonometría 4ºmatb Bruñoyssmateribera7435100% (1)
- 6to - Fisica QuimicaDocumento138 páginas6to - Fisica Quimicarecaprueba100% (1)
- Taller Compuestos Inorganicos y Organicos CompletoDocumento8 páginasTaller Compuestos Inorganicos y Organicos CompletoKarol PardoAún no hay calificaciones
- Ex Fila A QuimicaDocumento7 páginasEx Fila A QuimicaFernando Jair HuancaAún no hay calificaciones
- Ejercicios ResueltosDocumento14 páginasEjercicios ResueltosMR. ROBOTAún no hay calificaciones
- Olimpiada Cientifica 2021Documento4 páginasOlimpiada Cientifica 2021Franz BrianAún no hay calificaciones
- Anhídridos TemaDocumento6 páginasAnhídridos TemaMonzerrat Arroyo VelásquezAún no hay calificaciones
- Olimpiada Científica Estudiantil Plurinacional Boliviana 2018Documento11 páginasOlimpiada Científica Estudiantil Plurinacional Boliviana 2018VICTOR OÑA DONAIREAún no hay calificaciones
- Electrostatica 2 - Semana 3Documento6 páginasElectrostatica 2 - Semana 3Angie ChavezAún no hay calificaciones
- Alcanos: propiedades y obtención de los hidrocarburos saturadosDocumento22 páginasAlcanos: propiedades y obtención de los hidrocarburos saturadosRicardo PazAún no hay calificaciones
- Convocatoria 10maOCEPBDocumento6 páginasConvocatoria 10maOCEPBGimena CHURA HUAYPIAún no hay calificaciones
- Geografía 8va Olimpiada 2da Etapa TodosDocumento5 páginasGeografía 8va Olimpiada 2da Etapa Todoscarlos carlos100% (1)
- 6to de Secundaria FisicaDocumento4 páginas6to de Secundaria FisicaGonzalo VelasquezAún no hay calificaciones
- MRU 4th AmerinstDocumento5 páginasMRU 4th AmerinstKárèn CárláAún no hay calificaciones
- Laboratorio Informe Fermentacion de Jugos (Correccion)Documento7 páginasLaboratorio Informe Fermentacion de Jugos (Correccion)Nipcela TamayoAún no hay calificaciones
- GUIA PRIMER PARCIAL QUIMICA 2023 INGENIERIA OriginalDocumento75 páginasGUIA PRIMER PARCIAL QUIMICA 2023 INGENIERIA OriginalJuan Carlos Valencia Mamani100% (1)
- Ejercicios sobre peróxidos y superóxidosDocumento1 páginaEjercicios sobre peróxidos y superóxidosSofia González MüllerAún no hay calificaciones
- Fisica 3Documento8 páginasFisica 3ivcscribdAún no hay calificaciones
- Problemas de física con soluciones de dinámica y cinemáticaDocumento1 páginaProblemas de física con soluciones de dinámica y cinemáticagiulianaAún no hay calificaciones
- Un Avión Vuela de La Ciudad A A La Ciudad BDocumento2 páginasUn Avión Vuela de La Ciudad A A La Ciudad Besgom8190% (2)
- Qmc. 3ro. (2014)Documento63 páginasQmc. 3ro. (2014)Edwin GutierrezAún no hay calificaciones
- Crucigrama - CelulaDocumento2 páginasCrucigrama - CelulaGloria SanmartinAún no hay calificaciones
- 03 Semana de Fisica ElectrostaticaDocumento8 páginas03 Semana de Fisica ElectrostaticaRut EsterAún no hay calificaciones
- Las Misiones JesuíticasDocumento3 páginasLas Misiones JesuíticasVICTORAún no hay calificaciones
- I 2010DDocumento4 páginasI 2010DLuis Angel Chino Calderon100% (1)
- Movimiento CompuestoDocumento2 páginasMovimiento CompuestoAldo GeldresAún no hay calificaciones
- Propiedades y reacciones de los alquinosDocumento28 páginasPropiedades y reacciones de los alquinosirvelandiaro33% (3)
- Desafío FísicaDocumento3 páginasDesafío FísicaFlorencia ArenaAún no hay calificaciones
- Prueba de Competencias 07 JulioDocumento9 páginasPrueba de Competencias 07 JulioRamiro VelozaAún no hay calificaciones
- Leyes PonderalesDocumento36 páginasLeyes PonderalesAlejandra Murillo100% (1)
- Organizador 5Documento1 páginaOrganizador 5Katherine Tavara VeraAún no hay calificaciones
- 4 Olimpiada Científica Estudiantil Plurinacional Boliviana 19 Olimpiada Boliviana de Física 3 Etapa (Examen Simultáneo) 4to. SecundariaDocumento3 páginas4 Olimpiada Científica Estudiantil Plurinacional Boliviana 19 Olimpiada Boliviana de Física 3 Etapa (Examen Simultáneo) 4to. SecundariaKaterin FrancoAún no hay calificaciones
- Taller de HidrostaticaDocumento4 páginasTaller de HidrostaticaKarenAún no hay calificaciones
- Examen UMSS 2018Documento2 páginasExamen UMSS 2018Claudia Negretti100% (1)
- Educación Sexual IntegralDocumento1 páginaEducación Sexual IntegralRoverthos Vs100% (1)
- FISICDocumento3 páginasFISICLuis Alejandro Chuquipoma MarínAún no hay calificaciones
- ConvDocumento3 páginasConvAlejandra Huanca Valda100% (1)
- Megatarea 03Documento14 páginasMegatarea 03allan130Aún no hay calificaciones
- Examen Parcial 5toDocumento1 páginaExamen Parcial 5toTeo DonairesAún no hay calificaciones
- Ejercítate 4 Compuestos Inorgánicos y Ecuaciones QuímicasDocumento10 páginasEjercítate 4 Compuestos Inorgánicos y Ecuaciones QuímicasMaria del Pilar Castro SoriaAún no hay calificaciones
- Patrón CuartoDocumento1 páginaPatrón CuartoLr FrAún no hay calificaciones
- Patrón QuintoDocumento2 páginasPatrón QuintoLr FrAún no hay calificaciones
- TAREA 4 - VESPERTINO M. VeraDocumento10 páginasTAREA 4 - VESPERTINO M. VeraTomas Andres CantosAún no hay calificaciones
- Habilidades para Hacer Mi ProyectoDocumento3 páginasHabilidades para Hacer Mi ProyectoWuen Q. SalinasAún no hay calificaciones
- Datos Estadisticos PDFDocumento151 páginasDatos Estadisticos PDFELTONAún no hay calificaciones
- Practica Nro 1 Segundo Trimestre Sic JacDocumento1 páginaPractica Nro 1 Segundo Trimestre Sic JacWuen Q. SalinasAún no hay calificaciones
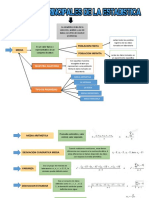
- Mapa ConceptualDocumento2 páginasMapa ConceptualWuen Q. SalinasAún no hay calificaciones
- PresentacionEducaInnova WUENDDYDocumento15 páginasPresentacionEducaInnova WUENDDYWuen Q. SalinasAún no hay calificaciones
- Cuestionario Tema LocalizacionDocumento2 páginasCuestionario Tema LocalizacionWuen Q. SalinasAún no hay calificaciones
- Nuevo Documento de Microsoft WordDocumento16 páginasNuevo Documento de Microsoft WordWuen Q. SalinasAún no hay calificaciones
- Sistematizacion de Experiencia InnovadoraDocumento7 páginasSistematizacion de Experiencia InnovadoraWuen Q. SalinasAún no hay calificaciones
- 5to BiologiaDocumento1 página5to BiologiaWuen Q. SalinasAún no hay calificaciones
- Guia de ContabilidadDocumento42 páginasGuia de ContabilidadWuen Q. SalinasAún no hay calificaciones
- Metodologiapyme Bolsa BVDocumento7 páginasMetodologiapyme Bolsa BVRAULFREDDYAún no hay calificaciones
- FodaDocumento0 páginasFodaCesar TorresAún no hay calificaciones
- LaboratorioDocumento11 páginasLaboratorioWuen Q. SalinasAún no hay calificaciones
- Contaminación ambiental por fabricación de ladrillosDocumento29 páginasContaminación ambiental por fabricación de ladrillosWuen Q. Salinas75% (4)
- Alcohol en GelDocumento18 páginasAlcohol en GelWuen Q. SalinasAún no hay calificaciones
- Celda ElectroliticaDocumento3 páginasCelda ElectroliticaWuen Q. SalinasAún no hay calificaciones
- Grupo 4Documento6 páginasGrupo 4Wuen Q. SalinasAún no hay calificaciones
- VECTORESDocumento4 páginasVECTORESWuen Q. SalinasAún no hay calificaciones
- BIBLIOGRAFIADocumento1 páginaBIBLIOGRAFIAWuen Q. SalinasAún no hay calificaciones
- Aprendizaje Basado en ProblemasDocumento2 páginasAprendizaje Basado en ProblemasWuen Q. SalinasAún no hay calificaciones
- Diferencias Entre El Modelo Del Aula Invertida y El Modelo Tradicional de AprendizajeDocumento2 páginasDiferencias Entre El Modelo Del Aula Invertida y El Modelo Tradicional de AprendizajeWuen Q. SalinasAún no hay calificaciones
- Unidad Tematica 4Documento9 páginasUnidad Tematica 4Wuen Q. SalinasAún no hay calificaciones
- Presentación 1Documento14 páginasPresentación 1Wuen Q. SalinasAún no hay calificaciones
- Ministerio de EducacionDocumento2 páginasMinisterio de EducacionWuen Q. SalinasAún no hay calificaciones
- Impacto de Internet en Nuevos Lectores y EscritoresDocumento5 páginasImpacto de Internet en Nuevos Lectores y EscritoresWuen Q. SalinasAún no hay calificaciones
- Trabajo Grupal 1Documento18 páginasTrabajo Grupal 1Wuen Q. SalinasAún no hay calificaciones
- Cuadro de Indagación DocumentalDocumento2 páginasCuadro de Indagación DocumentalWuen Q. SalinasAún no hay calificaciones
- Pensar La OrtografiaDocumento1 páginaPensar La OrtografiaWuen Q. SalinasAún no hay calificaciones
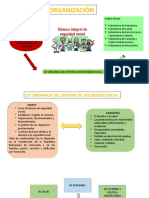
- 2 Seguro Social de SaludDocumento22 páginas2 Seguro Social de SaludWuen Q. SalinasAún no hay calificaciones
- 10 Mandamientos para Un Buen Lector y EscritorDocumento1 página10 Mandamientos para Un Buen Lector y EscritorWuen Q. SalinasAún no hay calificaciones
- Recursos naturales Amazonía PerúDocumento43 páginasRecursos naturales Amazonía Perújuan manuel lopez zumaetaAún no hay calificaciones
- Foro Tematico PDFDocumento12 páginasForo Tematico PDFDiego Herrera RafaelAún no hay calificaciones
- Catalogo Precios Mayo 2023 TaberneroDocumento52 páginasCatalogo Precios Mayo 2023 Tabernerosuperconmarketing100Aún no hay calificaciones
- Linear Traits Spanish PDFDocumento4 páginasLinear Traits Spanish PDFRoxana CllAún no hay calificaciones
- Seguridad Social y Sistema EconomicoDocumento8 páginasSeguridad Social y Sistema EconomicoyusmaryAún no hay calificaciones
- PDF Mapa Conceptual Origen y Evolucion de La Psicologia - Compress PDFDocumento1 páginaPDF Mapa Conceptual Origen y Evolucion de La Psicologia - Compress PDFZayra Isabella Campos OrduzAún no hay calificaciones
- ENERGIA TERMICA EnsayoDocumento2 páginasENERGIA TERMICA EnsayoLIZAún no hay calificaciones
- Guia Rs SecundariaDocumento48 páginasGuia Rs SecundariaArgelia Álvarez RochaAún no hay calificaciones
- Art 08Documento8 páginasArt 08Irene SantosAún no hay calificaciones
- Eco Doppler DXDocumento3 páginasEco Doppler DXMilenka GrgicevicAún no hay calificaciones
- Estudio de prefactibilidad emoliente naturalDocumento115 páginasEstudio de prefactibilidad emoliente naturalJUAN SURITA ALBERCAAún no hay calificaciones
- 2 Bases-Acetatos Balanceo Raciones-Dr TrujilloDocumento126 páginas2 Bases-Acetatos Balanceo Raciones-Dr TrujilloWendy Machado100% (1)
- Tunel CarpianoDocumento17 páginasTunel CarpianoGary MeraAún no hay calificaciones
- MBR - Rc-Isu-12 A Rc-Isu-13 - Unidad A.4 CostaDocumento2 páginasMBR - Rc-Isu-12 A Rc-Isu-13 - Unidad A.4 CostaJADER MARTINAún no hay calificaciones
- Configuración del sistema MSCONFIG para optimizar el arranque de WindowsDocumento11 páginasConfiguración del sistema MSCONFIG para optimizar el arranque de WindowsFabiola VelozAún no hay calificaciones
- Cálculo carga térmica instalaciones frigoríficasDocumento22 páginasCálculo carga térmica instalaciones frigoríficasRicardo QuillahuamanAún no hay calificaciones
- de LodebarDocumento4 páginasde LodebarTECSCOM EIRLAún no hay calificaciones
- Contrato de Asistente AdministrativoDocumento5 páginasContrato de Asistente AdministrativoSara CarvajalAún no hay calificaciones
- Campo TacoboDocumento5 páginasCampo TacoboJavier AquinoAún no hay calificaciones
- Marco Teorico AnemiaDocumento4 páginasMarco Teorico AnemiaPrecieuxRainbow100% (1)
- Función Materna en LacanDocumento7 páginasFunción Materna en LacanMailin CoresAún no hay calificaciones
- Modulo 2 SociologiaDocumento6 páginasModulo 2 SociologiaferkohlerAún no hay calificaciones
- Procedimiento de Instalacion de Artefactos SanitariosDocumento23 páginasProcedimiento de Instalacion de Artefactos Sanitariosandresmorales.ingeapAún no hay calificaciones
- Epidemias y Caida Del IncanatoDocumento14 páginasEpidemias y Caida Del IncanatoORLIS GARCIAAún no hay calificaciones
- Determinar El Peso Equivalente de Un Metal Problema Mediante El Método de Los Óxidos Por Oxidación Indirecta Con Ácido NítricoDocumento4 páginasDeterminar El Peso Equivalente de Un Metal Problema Mediante El Método de Los Óxidos Por Oxidación Indirecta Con Ácido NítricoMarianTerán100% (1)
- Derecho Ii K Dsi I TumbesDocumento18 páginasDerecho Ii K Dsi I TumbesAbel Neira MelendresAún no hay calificaciones
- 02 SP 0010 Liber Porta Lucis PDFDocumento41 páginas02 SP 0010 Liber Porta Lucis PDFDiego Leon TobonAún no hay calificaciones
- Ventajas y riesgos de la energía nuclearDocumento5 páginasVentajas y riesgos de la energía nuclearnico perezAún no hay calificaciones
- Revista GEPU3Documento284 páginasRevista GEPU3Mairin AngelAún no hay calificaciones
- N° 03 - Actividad N°07 - Psicologia PDFDocumento11 páginasN° 03 - Actividad N°07 - Psicologia PDFFernando CcoAún no hay calificaciones