Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Los Solventes
Cargado por
BrennosDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Los Solventes
Cargado por
BrennosCopyright:
Formatos disponibles
INSTITUT ROYA L DU PATRIMOINE ARTISTIQUE
KONINKLIJK INSTITUUT VOOR HET KUNSTPATRIMONIUM
LES SOLVANTS
L.MASSCHELEIN-KLEINER
COURS DE CONSERVATION
- CONSERVATIECURSUSSEN 2
BRUXELLES-BRUSSEL 1994
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
TAB L E D E S MATI E R E S
INTRODUCTION 7
CHAPITRE I PROPRIETES PHYSIQUES ET CHIMIQUES 8
Corps poreux : fissures, fractures, pores 8
I. MIGRATION DES SOLVANTS 9
1) Pesanteur, hydrostatique, hydrodynamique 9
a) Vases communicants 10
b) Siphons 10
2) Viscosit 11
3) Ecoulements laminaires et turbulents 13
4) Interaction aux surfaces 14
a) Tension superficielle 14
b) Mouillement 16
c) Structure de l'interface - substances tensioactives 16
d) Pression l'intrieur d'une goutte - capillarit 18
e) Adsorption des gaz et des vapeurs, des liquides, par les
solides, progression dans les corps poreux 22
5) Diffusion 23
a) Principe 23
b) Dialyse 24
c) Osmose 25
II. EVAPORATION 25
1) Pression ou tension de vapeur saturante 25
2) Ebullition 26
3) Chaleur latente d'vaporation 28
4) Conductibilit 30
5) Description de l'vaporation 31
6) Mesure de l'vaporation et de la rtention des solvants dans
les peintures 35
III. DISSOLUTION 39
1) Introduction et dfinitions, solutions, dispersions colloidales,
gel, coacervats, sols 39
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
2) Donnes thermodynamiques 40
a) Premier principe : conservation de l'nergie 40
b) Deuxime principe : entropie 41
c) Paramtre de solubilit 43
d) Triangle de solubilit 43
3) Interactions spcifiques 49
a) Attractions ou rpulsions lectriques entre ions 49
b) Attractions et rpulsions entre molcules dipolaires 51
c) Actions entre molcules polaires et non polaires 54
d) Actions entre molcules non polaires 56
e) Liens d'hydrogne 56
f) Echanges d'lectrons 57
CHAPITRE II DESCRIPTION DES PRINCIPAUX SOLVANTS UTILISES EN
CONSERVATION 59
I . HYDROCARBURES SATURES 59
1) Nomenclature et exemples 59
2) Migration - vaporation - dissolution 60
3) Toxicit 61
4) Utilisation 62
II. HYDROCARBURES NON SATURES ETHYLENIQUES 62
1) Nomenclature et exemples 62
2) Migration - vaporation - dissolution 63
3) Toxicit 63
III. HYDROCARBURES AROMATIQUES 64
1) Nomenclature et exemples 64
2) Migration - vaporation - dissolution 64
3) Toxicit 65
4) Utilisation 65
IV. HYDROCARBURES HALOGENES 66
1) Nomenclature et exemples 66
2) Migration - vaporation - dissolution 67
3) Toxicit 68
4) Utilisation 68
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
Pages
V. ALCOOLS 68
1) Nomenclature et exemples 68
2) Migration - vaporation - dissolution 70
3) Toxicit 72
4) Utilisation 72
Vbis. GLYCOLS - POLYOLS 73
1) Nomenclature et exemples 73
2) Migration - vaporation - dissolution 74
3) Toxicit 75
4) Utilisation 75
VI. ETHERS - OXYDES 76
1) Nomenclature et exemples 76
2) Migration - vaporation - dissolution 77
3) Toxicit 78
4) Utilisation 78
VII. CETONES 79
1) Nomenclature et exemples 79
2) Migration - vaporation - dissolution 80
3) Toxicit 81
4) Utilisation 81
VIII. ESTERS 82
1) Nomenclature et exemples 82
2) Migration - vaporation - dissolution 83
3) Toxicit 84
4) Utilisation 84
IX. ACIDES CARBOXYLIQUES 85
1) Nomenclature et exemples 85
2) Migration - vaporation - dissolution 85
3) Toxicit 88
4) Utilisation 88
X. AMINES 89
1) Nomenclature et exemples 89
2) Migration - vaporation - dissolution 90
3) Toxid t 92
4) Utilisation 92
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
Pages
XI. AMIDES CARBOXYLIQUES 93
1) Nomenclature et exemples
93
2) Migration - vaporation - dissolution 94
3) Toxicit 96
4) Utilisation
96
XII. NITRILES 97
1) Nomenclature et exemples 97
2) Migration - vaporation - dissolution 98
3) Toxicit 98
4) Utilisation 99
XIII. DERIVES NITRO- 99
1) Nomenclature et exemples 99
2) Migration - vaporation - dissolution 100
3) Toxicit
100
4) Utilisation 101
XIV . COMPOSES DU SOUFRE 101
1) Nomenclature et exemples 101
2) Migration - vaporation - dissolution 102
3) Toxicit 103
4) Utilisation 103
CHAPITRE III APPLICATIONS 104
I. CRITERES DE SELECTION DES SOLVANTS 104
1) L'objet d'art 104
2) L'oprateur 104
3) Le but 105
II. CLASSEMENT DES SOLVANTS 107
1) Pouvoir de pntration - rtention 107
2) Interactions spcifiques 109
3) Utilisation pratique 111
III. EXEMPLES 114
1) Elimination des souillures 114
a) Peinture 114
b) Sculpture 116
c) Peinture murale, papiers peints, cuirs 117
d) Matriaux pierreux 117
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
Pages
2) Enlvement d'un vernis 118
a) Peintures 118
b) Sculptures 120
3) Enlvement des surpeints 120
a) Peintures 120
b) Sculptures 122
3) Divers 122
a) Taches de bitumes 122
b) Taches d'acide sulfurique 123
c) Taches de colles 123
IV. RECHERCHES RECENTES 125
BIBLIOGRAPHIE 127
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
7.
I N T RO O U C T I O N
Un peu partout dans le monde, les restaurateurs abandonnent les
solvants traditionnels, trbenthine, aspic, salive, etc. pour les produits
les plus divers, alcools, ctones, esters, etc. en mlanges compliqus sou
vent issus d'un empirisme peu fiable.
La pratique des solvants en conservation exige une trs grande
prudence tenant compte non seulement des effets immdiats et visibles, mais
aussi des effets longue chance plus difficilement matrisables.
Contrairement ce que l'on pourrait croire, il n'est pas simple
du tout d'expliquer ce qui se passe quant on frotte un tampon imbib de sol
vants sur la surface d'un tableau. Les phnomnes physiques et chimiques
ainsi dclanchs sont dj trs complexes quand on se limite aux mieux con
nus d'entre eux, mais l'on prouve une certaine inquitude en songeant
tout ce que l'on ignore encore.
Le nettoyage d'un objet d'art (peinture, sculpture, textile, ... )
fait intervenir des pralables d'ordre esthtique qui ne seront pas dvelop
ps ici. Notre prsente intervention se situe au moment o le nttoyage a
t jug ncessaire pour la conservation de l'oeuvre d an s son intgrit es
thtique et matrielle. Notre mission consiste rendre cette opration
dlicate et toujours prilleuse ussi contrlable que possible.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
8.
CHAPITR E I
PRO P RI E TE S P H YS IQU E S E T C H I MIQ UES
Bien qu'il ne faille jamais perdre de vue au cours du nettoyage que
l'on traite une oeuvre d'art, nous allons ici nous permettre trs prosaque
ment de considrer que la plupart des matriaux constitutifs sont des CORPS
POREUX.
Les diffrents types de pores sont d'habitude classs en deux grandes cat
gories (1) :
1. LES FISSURES ET FRACTURES
caractrises par l e fait que deux de leurs dimensions sont trs
grandes par rapport la troisime.
2. LES PORES
dont une dimension est beaucoup plus grande que les deux autres.
'1
,\
Quelle que soit la forme des trous, remarquons qu'il existe toujours la
possibilit de donner lieu des phnomnes de capillarit (cf. p. 19).
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
9.
Dposons une goutte de solvant la surface d'un corps poreux,
par exemple une peinture, et observons au microscope :
I) une partie de la goutte disparat dans les pores et fisRures,
II) une autre partie s'vapore plus ou moins rapidement,
III) une partie peut parfois exercer une action dissolvante ; prenons
le cas d'un vernis : il y a gonflement puis migration du matriau solu
bilis. Le solvant s'vapore et il se forme une aurole.
Nous allons tenter de suivre ces trois pistes.
I. MIGRATION DES SOLVANTS
1. Pesanteur, hydrostatique, hydrodynamique (2)
Les liquides sont constitus de molcules distantes l'une de l'au
tre d'environ 10 . Cette distance correspond des interactions non n
gligeables, mais qui leur permettent de rouler les unes sur les autres
tout en restant nanmoins prisonnires de l'ensemble. C'est pour cette
raison que les liquides pousent la forme des rcipients qui les con
tiennent.
Cette distance de 10 est suffisannnent petite pour qu'il soit dif
ficile de comprimer davantage les molcules les unes sur les -autres. Les
liquides sont donc pratiquement incompressibles. C'est ce qui explique
le principe de Pascal : "Toute pression exerce la surface d'un fluide
se transmet intgralement dans tous les sens".
Ainsi, la pression exerce par un tampon d'ouate la surface d'une
peinture sera transmise dans tous les sens par le solvant, ce qui peut
ventuellement provoquer des soulvements distance.
La fixation des caillages doit bien videnunent prcder le nettoyage.
Le fond d'une craquelure emplie de solvant subit une pression p
proportionnelle la hauteur de la colonne de liquide :
p = h X q X g
P pression, h = hauteur, q = masse volumique du liquide,
g module du vecteur champ de pesanteur terrestre.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
10.
Cette pression ne dpend que de la hauteur et non de la forme de la
colonne, c'est--dire de la craquelure, mais la force exerce sur le fond
est gale au poids de la colonne de liquide qui le surmonte, ce qui veut
dire que la surface du fond intervient, F =p x S, S = surface du fond.
Cette pression est gnralement trs faible et tout fait anodine
pour la peinture, mais elle rgit certains mouvements des solvants :
a) Vases communicants
Lorsque des craquelures connnuniquent, les solvants passent de l'une
l'autre de manire ce que les niveaux et les pressions soient ga
les dans les diffrentes branches.
Des crevasses situes dans des couches profondes peuvent se remplir
de solvant grce l'tablissement de siphons.
Ds que le tube C (qui peut tre une craquelure) est rempli de liqui
de, il y a transfert du liquide de A en B, tant que le niveau en A reste
suprieur au niveau en B. Le liquide s'coule de A en B afin d'galiser
les niveaux et les pressions.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
1 1.
2. Viscos it
Les molcules d'un fluide peuvent glisser les unes sur les autres,
mais ce n'est que dans les fluides dits "parfaits" qu'elles le font sans
frottement.
De fait, les liquides prsentent toujours un certain frottement : ils
sont dits "visqueux". On peut considrer que dans un fluide qui s'coule
il y a une srie de lames parallles glissant les unes sur les autres
avec frottement et entranement mutuel.
tc::::::::: .,,;.: ?
Dans une craquelure, les molcules les plus proches des parois sont
freines la vitesse est maximale au centre du conduit. Dans une cana-
lisation de faible section, la viscosit provoque une diminution progres
sive de la pression du liquide. On dit qu'il y a perte de charge.
Ce sont les solvants les plus visqueux qui seront le plus freins,
ce qui entravera leur pntration.
Nous avons mesur la viscosit de quelques solvants courants (3).
Ils peuvent tre classs en solvants visqueux (plus de 10 cp), interm
diaires (de 2 10 cp) et fluides (moins de 2 cp 20 C). Tableau I.
On a tent de rattacher la viscosit au poids molculaire et la
temprature d'bullition, mais aucune proposition n'est rellement satis
faisante (4). On affecte par exemple un coefficient chaque atome et
chaque sorte de liaison du carbone. Ainsi, la mme temprature, la
viscosit d'un corps qui peut tre compris dans une srie homologue de
vrait augmenter quand le poids molculaire augmente. On constate de nom
breuses exceptions cette rgle : l'acide formique est plus visqueux que
l'acide actique et le benzne plus que le tolune.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
12.
Viscosits (3)
VISQUEUX cp 20 C FLUIDES
cyclohexanol 5 6, 2 malonate d'thyle 1, 97
dipropylneglycol 48 ther de ptrole 0,48
dithylneglycol 38 1-mthylpyrr.olidone 1,65
thylneglycol 21 E.G. monothylther 1, 55
dodcane 1,34
dioxane 1, 15
INTERMEDIAIRES N,N-dimthylactamide 1, 13
ttrachlorure de C 0,91
alcool benzylique 6,39 whi.te spirit 0,89
tertiobutanol 5,37 cyclohexane 0,88
alcool isoamylique 4,65 cumol 0,86
isobutanol 3,94 perchlorothylne 0,83
alcool amylique 3,50 N,N-dimthylformamide 0, 77
formamide 3,30 1, 1, 1-trichlorothane o, 76
diacetone alcool 3,0 1 1 ,2-dichlorothane 0,73
butanol 2, 9 6 chlorobenzne 0, 72
butanol sec 2,63 oxyde de mesityle 0,68
isophorone 2,62 actylactone 0,66
n-propanol 2,25 n -butylactate 0,64
isopropanol 2,22 benzne 0,60
dimthylsulfoxyde 2, 1 3 p-xylne 0,57
cyclohexanone 2, JO xylne 0, 56
tolune 0,54
mthylisobutylctone 0,53
roethanol 0,52
chloroforme 0,51
ttrahydrofurane 0,51
actate d'isopropyle 0,46
2-pentanone 0,46
3-pentanone 0,45
isooctane -o, 45
actate d'thyle 0, 4 1
dichloromthane 0,40
n-heptane 0,37
mthylthylctone 0, 36
formiate d'thyle 0, 36
actate de mthyle 0,35
sulfure de C 0,34
actone 0, 3 1
n -hexane 0,30
diisopropylther 0,30
dithylther 0,25
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
13.
Quand on mlange plusieurs solvants, il est trs difficile de pr
voir quelle sera la viscosit finale : selon la proportion des consti
tuants, il peut y avoir une variation rgulire de la viscosit, mais
il arrive que le mlange prsente un maximum ou un minimum de viscosit
pour une composition donne.
Les glycols et les alcools prsentent en gnral une viscosit
leve. C'est une consquence des importantes forces d'interaction qui
existent entre leurs molcules, en particulier des nombreux liens H.
3. Ecoulements laminaires et turbulents (5)
Un fluide qui s'coule sans obstacle dans une conduite bien lisse
et cylindrique prsente d'habitude un rgime dit LAMINAIRE. La vitesse
de l'coulement va en croissant depuis la paroi jusqu' l'axe de la con
duite, o elle atteint sa valeur maximum. Ce cas est rare dans les ma
triaux des objets d'art.
Ds qu'il y a des obstacles, parois rugueuses, conduites tortueuses,
etc., les changements de direction imposes au courant perturbent la vi
tesse d'coulement, qui devient irrgulire ; le rgime est dit TURBULENT.
On peut videmment avoir aussi une combinaison de ces deux types de rgi
mes, ce qui donne un rgime dit MIXTE.
La turbulence provoque des pertes de charge plus importantes que
le rgime laminaire, mais par contre elle favorise le mlange des diff
rentes couches dans le liquide, ce qui entrane ventuellement la disso
lution des parois.
1 II
A ----
T --'t\;,;:
,/ ,- .-:;-.
J --.-,..,.rr
T
A------------- 0
1
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
14.
Si on introduit un liquide color par A, en rgime laminaire il
s'coulera en D sans se mlanger, en rgime turbulent par contre le m
lange se fera rapidement.
Le passage du rgime laminaire au rgime turbulent dpend de la
vitesse d'coulement, de la viscosit du fluide et de la gomtrie des
conduites. O n dfinit un nombre R, le nombre de REYNOLDS qui caractrise
tout coulement visqueux.
V .l
R =
v
V vitesse, l facteur dpendant de la gomtrie de la conduite et
v =viscosit.
Tant que R < 2 320, en I le filet color s'coulera toujours sans se
mlanger dans D, mme s'il y a un obstacle.
Quand 2 320 < R < JO 000, la prsence d'un obstacle B provoquera la tur
bulence (II) .
QUand R > 10 000, il y aura toujours turbulence dans D mme sans obstacle.
4. Interaction aux surfaces
a) Tension_suerficielle
La surface des liquides prsente des proprits trs particulires.
Elle se comporte un peu comme une membrane lastique tendue. Tout le
monde connat ces expriences o l'on montre que la surface d'un li
quide peut supporter le poids d'une pingle ou d'une pice de monnaie.
Ce phnomne s'explique par les interactions qui existent entre les
molcules du liquide.
*
A l'intrieur de la masse liquide, ces interactions sont diriges
dans tous les sens et se compensent. A la surface, par contre, il y
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
15.
a des interactions diriges vers l'extrieur qui ne sont pas compen
ses. Ces forces tendent rendre la surface aussi petite que pos
sible et il faudra surmonter ces forces pour rompre cette surface.
On appelle TENSION SUPERFICIELLE la force qui maintient en contact
les molcules de la surface d'un liquide, sur une longueur d'un cm.
Nous avons mesur (3) cette grandeur pour une srie de solvants cou-
rants.
Tensions superficielles (3)
Dynes/cm
eau 72 ,8 ttrachlorure de carbone 27, 6
formamide 58,3 1, 1, 1-tric.hlorothane 26,7
thylneglycol 49,8 actate d'amyle 26,2
dithylneglycol 45, 7 dod cane 26,
dimthylsulfoxyde 45, 1 alcool amylique 25,8
1-mthylpyrrolidone 42,9 actate de mthyle 25,7
alcool benzylique 4 1, 1 actate de n-butyle 25, 7
N.N-dimthylactamide 38, 1 cyclohexane 25,6
N.N-dimthylformamide 37,9 3-pentanone 25,4
cyclohexanone 34,8 white-spirit 25,4
cyclohexanol 34 ,2 mthyl-thyl-ctone 25,2
chlorobenzne 33,7 butanol 25, 1
dioxane 33,7 actone 24,9
1 , 2-dichlorothane 33,2 2-pentanone 24,9
thylneglycolmonothylther 32,3 actate d'thyle 24,7
perchlorothylne 32,2 mthylcyclohexane 24,6
malonate d'thyle 32, 1 formiate d'thyle 24,5
isophorone 3 1, 7 mthylisobutylctone 24,3
diactone alcool 3 1, 4 n-propanol 24,2
actylactone 31,3 alcool isoamylique 24,2
actonitrile 30,2 butanol sec. 23, 9
sulfure de carbone 29 , 8 mthanol 23,8
benzne 29, 6 isobutanol 23,3
dichloromthane 29 ,5 actate d'isopropyle 22,9
oxyde de msityle 29,2 thanol (absolu) 22,9
tolune 29, 1 isopropanol 21, 7
xylne 29, 0 tertiobutanol 20,8
cumne 28,7 isooctane 19,2
paraxylne 28,6 n h-exane 18,8
ttrahydrofurane 28,2 dithylther 18,6
chloroforme 28,2 diisopropylther 18, 3
ther de ptrole (40 -60 C) 17,9
On voit iue la valeur de la tension superficielle varie fortement
selon la nature du liquide. C'est l'eau qui prsente la valeur la
plus leve. Cette caractristique a t mise en relation avec les
fortes interactions qui existent entre les molcules d'eau.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
16.
b) Mouillement
Plus la tension superficielle d'tm fluide est grande, plus il aura
tendance se rassembler en goutte et plus difficilement il mouillera
un solide.
Les forces d'interaction des molcules du liquide entrent en compti
tion avec les forces d'interaction des molcules du solide. Quand ces
dernires l'emportent, le mouillage est bon, et l'angle de mouillage 6
est petit.
La surface d'un liquide prsente, du fait de la tension superficielle,
une autre structure que les couches profondes. On sait que certaines
molcules se comportent comme des petits aimants : le centre d'action
des charges positives et celui des charges ngatives n'y coincident pas,
ce sont des molcules dites POLAIRES. Les surfaces des liquides polai
res sont constitues de molcules orientes de manire trs prcise :
dans les alcools par exemple (6) , les groupes hydroxyles OH sont diri
gs vers l'intrieur du liquide. Dans le cas des molcules non polai
res, comme le ttrachlorure de carbone, il n'y a pas d'orientation.
Le benzne non compltement symtrique pourrait adopter une position
privilgie plat.
Substances tensioactives
Il existe des substances qui abaissent la tension superficielle d'un
liquide : elles sont dites TENSIOACTIVES. On les appelle aussi TENSIDES
ou SURFACTIFS (7) .
Les molcules de ces substances comportent la fois une partie hy
drophile et une partie hydrophobe.
t'"'\ partie hydrophile
"VVVVVVV'V'\._,)
-" .A ,... "- r.. A. A K"
partie hydrophobe
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
17.
La partie hydrophobe peut tre aliphatique, aromatique ou les deux
la fois, mais elle comporte en gnral un grand nombre d'atomes de
carbone (au moins 10 C).
La nature de la partie hydrophile dtermine un classement en quatre
groupes :
a) La classe la plus importante du point de vue de l'utilisation est
celle qui en solution prsente un ANION, c'est--dire une charge
ngative.
b) Les surfactifs CATIONIQUES se dissocient dans l'eau en donnant des
ions chargs positivement.
Leur utilisation est plus restreinte. Ils servent de germicides,
bactriostatiques, assouplissants, antistatiques et certains comme
apprts hydrophobes sur coton.
c) Les agents tensio-actifs AMPHOTERES peuvent suivant le pH tre
chargs positivement ou ngativement.
La lcithine du jaune d'oeuf en est un exemple.
d,) Les drivs NON IONIQUES ne donnent pas d'ions en solution aqueuse.
La partie hydrophile est constitue par un grand nombre de groupes
hydroxyles ou thoxyliques.
Ces agents tension-actifs ont tendance se grouper aux interfaces
(liquide-solide, liquide-liquide, liquide-air, ... ) . Les molcules
se placent perpendiculairement la surface : l'eau attire la partie
hydrophile et repousse la partie hydrophobe.
Exemple : suspension de graisses dans une eaux savonneuse.
* eau
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
18.
Leur prsence aux interfaces abaisse considrablement la tension
superficielle. Un bon mouillant en faible concentration, 0 , 0 1 % 1 di
minue la tension superficielle de l'eau de plus de la moiti.
Remarquons que certains sels, acides et bases minrales augmentent
la tension superficielle de l'eau. Ainsi, une solution aqueuse sature
en chlorure de sodium prsente une augmentation de la tension superfi
cielle de prs de 15 % ( 12).
La diminution de la tension superficielle facilite le mouillage mais
dfavorise la migration capillaire, ainsi que nous allons le voir ci
aprs.
d) Pression__l'intrieur_d'une_goutte (2)
p
0
La pression superficielle de la goutte exerce une pression sur le
liquide interne due aux interactions des molcules de la surface avec
celles du liquide. L'accroissement de pression hydrostatique, quand
on passe du ct convexe au ct concave de la surface de sparation
de deux fluides, est directement proportionnelle la tension superfi
cielle A et inversement proportionnelle au rayon r de la goutte :
p - p
2A Formule de Laplace
0 r
Cette pression est suprieure la pression extrieure P , car elle
0
doit compenser la fois cette pression extrieure et celle qui rsulte
de la tension superficielle, sinon la goutte s'effondrerait.
Dans le cas des mnisques que l'on peut trs grossirement comparer
des parties de goutte, on peut dmontrer que la pression intrieure est
suprieure la pression extrieure pour un mnisque convexe et l'in
verse pour un mnisque concave.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
19.
Pa le liquide le liquide
e mouille ne mouille
P.
la paroi pas la paroi
.i p >p p <p
/)//
.<.,/./ .
/ '
> 90
0
< 9 0 "P 6
Capillarit
Le phnomne de la capillarit a t constat pour la premire
fois par Lonard de Vine i : i 1 a remarqu que 1 'eau s'levait dans les
tubes de petit diamtre (infrieurs I mm) (8) .
Ce phnomne est dcrit par la loi. de JURIN : "La hauteur laquelle
s'lve un liquide dans un capillaire varie en raison inverse du
rayon du tube l'endroit o s'arrte le liquide et en proportion
directe de la tenson superficielle."
c La pression en C enfonce la
surface du mnisque : elle
A
est suprieure la pression
h
en A.
-s - 0
Considrons un liquide mouillant (mnisque concave) dans un capil
laire. La pression en C, P en D , PD : c'est
C est gale la pression
la pression atmosphrique. En A, la pression du ct convexe du m
nisque P est plus faible que la pression extrieure PC et vaut selon
la formule de Laplace
avec PA PC I
2A
r
<
Au point B situ au mme niveau que D, la pression est gale au
poids de la colonne de liquide au-dessus de la surface, mais elle est
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
20.
aussi gale la pression extrieure P (principe de Pascal).
D
On a donc :
2A
mais p - pC = -
A r
2A
donc h q g
r
Le poids de la colonne de.liquide ,compense la diminution de pression
due au mnisque et
2A
h r q g
Loi de Jurin [
h hauteur de la migration capillaire
A tension superficielle
q densit
r rayon du capillaire
g acclration de la pesanteur (981 cm/sec).
Pour de l'eau montant dans un capillaire de l mm de rayon
A 73 , R = 0, 1 Q 1 , G 981
146
h 1,47 cm
= 98, l
Dans les roches, par exemple, l'eau peut montr. par capillarit
jusqu' des hauteurs surprenantes (9) :
Migration de l'eau par capillarit
-Diamtre du capillaire Hauteur de la migration
----- -----------------------------------------------------------
0,00005 mm 294 m
0,001 nnn 147 m
0,01 mm . 1,47 m
0, 1 mm 14,7 cm
mm 1,47 cm
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
21.
Il est possible de montrer par des calculs (1) que les capillaires
les plus larges se remplissent le plus vite, mais cette vitesse est
freine car ils doivent alimenter les capillaires les plus minces
avec lesquels ils communiquent et o la hauteur de migration est
plus importante.
Si on utilise des substances tensio-actives, comme c'est le cas
dans certaines oprations de fixage, la tension superficielle la
surface du mnisque diminue, ce qui entrave la monte capillaire.
De plus, comme les molcules de tensio-actifs se groupent la sur
face, il y a aussi ralentissement de l'vaporation.
On se rappelle que c'est le rayon du tube l'endroit o s'arrte
le liquide qui conditionne la hauteur de la migration. Il p eut arri
yer que le pore prsente un brusque largissement (10) . :
3
/,
Quand le rayon R est beaucoup plus grand que celui du capillair r,
tant que le liquide n'aura pas atteint l'largissement, les deux capil
laires I et 2 se rempliront la mme allure.
A partir de l'entre du trou, l'ascension sera fortement freine
en 1. Il arrivera un moment o le liquide en 2 atteindra la jonction
3 et continuera remplir le capillaire e n pigeant une bulle d'air
dans la partie largie. Si, au cours de sa migration dans le capil
laire, le solvant rencontre un largissement, il s'arrte. A l'inver
se, dans une craquelure qui se vide, du solvant pourra rester pig
dans des coins.
Notons cependant que quand les trous sont suffisamment petits, un
film de solvant finit par recouvrir les parois par vaporation et
condensation successives ( 11). Il y a aussi intervention d'un autre
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
22.
phnomne 1 'ADSORPTION
e) Adsoretion
L'adsorption est le phnomne selon lequel des substances gazeuses,
liquides ou solides restent fixes la surface de certains solides ou
liquides sans qu'il y ait formation de composs chimiques dfinis ( 13).
C'est un phnomne qui est connu et exploit depuis bien longtemps.
Ds l'Antiquit, Aristote rapporte que l'eau de mer perd son got quand
on l'a fait passer au travers d'une couche d'argile.
On appelle ADSORBANT le solide ou le liquide qui retient les substan
ces et ADSORBE, la substance qui est retenue.
Adsorption des gaz et des vapeurs
L'adsorption est un phnomne de surface : la quantit de gaz ad
sorb augmente avec la surface de l'adsorbant.
Il semble que l'on doive distinguer deux types d'adsorption : une
adsorption dite PHYSIQUE, o les molcules sont simplement accumules
prs du solide sans aucune union fixe entre les deux phases. Cela
pourrait correspondre la liqufaction locale du gaz. La couche ainsi
-6
adsorbe peut atteindre une paisseur de 10 cm soit 20 100 diamtres
molculaires.
Dans l'autre type d'adsorption dite CHIMIQUE, il y aurait des in
teractions adsorbant-adsorb et la pellicule n'aurait que l'paisseur
d'une molcule : elle est dite MONOMOLECULAIRE.
Adsorption des liquides par les solides
Il semble que dans le cas des liquides, l'adsorption soit essentiel
lement chimique et que la couche adsorbe soit monoroolculaire.
L'adsorption des solvants se complique du fait qu'ils contiennent
plus ou moins de substances dissoutes qui seront galement adsorbes.
On a constat en effet que lorsqu'une solution est mise en contact d'un
adsorbant, la concentration de la solution change. L'adsorbabilit des
deux constituants peut donc tre diffrente et la composition de la cou
che adsorbe n'est pas ncessairement la mme que celle de la solution.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
23 .
Progression des solvants dans les corps poreux
L'adsorption joue un rle certain lors du mouvement des solvants
dans un corps poreux. Rose (Il) propose le schma suivant
_ ____,_
-4'.
,,;=.,
2 3 4 5 6
flux de la vapeur
flux du liquide
1) Il y a d'abord migration de la vapeur et adsorption sur les parois
des pores, la couche est monomolculaire.
2 ) Ds que les parois sont satures la vapeur passe librement.
3) Le liquide conunence alors se condenser dans les tranglements.
4) Il adsorbe ensuite sur les parois de la cavit.
5) Le liquide commence fluer sur les parois.
6) Il remplit toute la cavit.
Le liquide se dplace sous forme de vapeur des points de tension
de vapeur leve vers des points o elle est plus faible, jusqu' ce
qu'il y ait quilibre. La condensation provoque un rchaufement des
zones froides. L'vaporation provoque un refroidissement des surfaces
o la tension de vapeur tait plus forte.
5. Diffusion
Considrons un tube contenant un liquide ayant une certaine masse
volumique q . Ajoutons prudemment dans le tube un autre liquide de
1
masse volumique q , plus grande que q :
2 1
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
24.
Les deux liquides vont se mlanger, mme si on ne les agite pas,
plus ou moins rapidement. Le mme phnomne se passe entre solides
de masses volumiques diffrentes, mais beaucoup plus lentement.
Il y a dplacement d'atomes ou de molcules dans un matriaux donn
c'est la DIFFUSION ( 1 3, 14).
La vitesse de diffusion dpend de la taille des particules migran
tes. Dans une SOLUTION, le solut et le solvant se trouvent diviss
3
jusqu' l'chelle molculaire ( I 0- m.) . Quand la taille des particu-
-3
les atteint l'chelle colloidale : de JO m 0 , 2 m, on a une
DISPERSION COLLOIDALE. La dispersion de ces grosses particules est
beaucoup plus lente que celle des molcules ou ions en solution vraie.
Exemples solution de sulfate de cuivre, 2 = eau.
sol. de bleu de Prusse (obtenu en mlangeant des solu
tions trs dilues de ferrocyanure de potassium et d'un
sel ferrique), 2 = eau.
Le sel de cuivre forme une solution homogne aprs un jour ou deux
le bleu de Prusse ncessite plus d'une semaine pour se mlanger.
Quand la diffusion se fait au travers des trous d'une membrane,
seules les particules suffisamment petites passent, les plus grosses
sont bloques : il y a DIALYSE.
-. , . .1 .: , . .
.. ' ... #}' ' . . . ,' .
. . ... . 1 .. " . ' o
. : 0 : . , .
:.... o
:_. -. :,
'! :-
: 1. : : .,;,,. , . '4
. .:. . 1,
Lors du nettoyage d'un tableau contenant des couches de peinture
l'huile d'un cetain ge, la diffusion et la dialyse entraneront l'
limination par les solvants des petites molcules, glycrol, acides
gras de faible poids molculaire, etc. forms au cours du vieillisse
ment et qui assuraient la souplesse du film. Aprs action des sol
vants, la peinture deviendra donc plus cassante.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
25.
Si des solutions d e concentration diffrente sont spares par
une membrane en deux compartiments, on constate que le solvant migre
d'un compartiment l'autre de manire galiser les concentrations
c'est le phnomne d'OSMOSE.
solution
,.
solvant
pur
1
,solution
solvant
, _t_i_ -
L'osmose peut donc provoquer galement des mouvements de solvants.
Ainsi dans le schma B, le solvant monte au travers de la membrane
dans le tube contenant la solution. La hauteur de la colonne dans le
tube mesure la PRESSION OSMOTIQUE.
Dans les peintures, il semble bien que le phnomne d'osmose soit
le principal responsable de la formation des cloques par transfert
d'eau ( 15).
II. EVAPORATION
La vitesse d'vaporation d'un solvant est une des questions les plus
frquentes et aussi les plus embarrassantes que le restaurateur pose au chi
miste. En effet, cette vitesse d'vaporation dpend d'un grand nombre de
facteurs souvent contradictoires.
1. Pression ou tension de vapeur saturante
. c )
vapeur
liquide liquide
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
26.
Un liquide plac dans un rcipient ouvert ou rpandu sur une sur
face s'vapore progressivement jusqu' ce que toutes les molcules l'
tat liquide soient passes l'tat vapeur.
Si on ferme hermtiquement le rcipient, il s'tablit un quilibre
entre le liquide et sa vapeur. Aprs un certain temps, la vapeur atteint
une pression caractristique, pour chaque liquide une temprature donne
c'est la PRESSION DE VAPEUR SATURANTE ( 16 ) . Le nombre de molcules qui
passent de l'tat vapeur l'tat liquide et inversement s'quilibrent pour
maintenir cette pression constante ( une temprature donne).
Plus la pression de vapeur saturante est leve, plus il y a de mo
lcules l'tat vapeur en flacon ferm. En flacon ouvert, le liquide
s'vaporera donc d'autant plus vite.
2. Ebullition
La tension de vapeur augmente avec la temprature. Ainsi, la temp
rature d'bullition d'un liquide correspond une valeur de la tension de
vapeur qui est gale la pression extrieure au-dessus de ce liquide,
quelle que soit la valeur de cette pression. L'bullition est en effet
une forme particulire d'vaporation qui se produit au sein d'un liquide.
Considrons une bulle d'air la profondeur h dans le liquide.
Cette bulle existe, car la pression qui rgne l'intrieur compense la
pression extrieure dont la partie la plus importante est constitue par
la pression atmosphrique H. Quand on chauffe, la pression l'intrieur
de la bulle augmente. Au moment o elle atteint la valeur de la pression
atmosphrique, elle remonte la surface o elle crve en abandonnant as
sez d'air pour qu'il se reforme d'autre bulles : c'est l'bullition.
Pour un corps pur, la temprature d'bullition reste constante pen
dan toute la dure de l'bullition, pour autant videmment que la pression
extrieure ne varie pas. Dans un mlange de solvants, au contraire, la
temprature pour laquelle la pression de vapeur atteint la valeur de la
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
27.
pression extrieure va dpendre de la composition du mlange. Normale
ment, c'est le compos le plus volatil qui s'vapore le plus vite et le
liquide s'enrichit en compos le moins volatil. La temprature d'bul
lition augmente alors progressivement.
Dans un mlange, il peut arriver que suite de fortes interactions
intermolculaires, il se forme ce que l'on appelle un AZEOTROPE. C'est
un mlange qui bout temprature constante et qu'il n'est donc plus pos
sible de sparer par distillation. Il correspond des proportions bien
dtermines de chacun des solvants. Certains de ces mlanges peuvent
tre utilement utiliss en conservation, notamment quand on a besoin d'un
solvant qui contient de l'eau mais dont on dsire qu'il soit plus volatil
que l'eau. On choisit de prfrence ceux qui prsentent un point d'bul
lition plus bas que le solvant le plus volatil.
Azotropes
Constituants T 0 b. oc T o b. Aotropes Composition en %
acide actique 1 18, 1 76 , 6 3
eau 100,0 97
actone 56,5 56,08 88, 5
eau 100,0 1 1,5
thanol 78, 5 76, 7 68, 0
tolune 1 10 , 6 32,0
mthyl thylctone 79,6 73, 4 88,0
eau 100,0 12,0
isopropanol 82,3 76, 3 38,2
tolune 1 1 0, 6 48,7
eau 100,0 1 3, 1
La temprature d'bullition a t une des premires caractristi
ques utilises pour classer les solvants. On distinguait gnralement
les solvants bas point d'bullition (moins de 100 C) , ceux point
d'bullition moyen (entre 100 C et 150 C) et les solvants haut point
d'bullition (plus de 150 C).
Pourtant, de mme que pour les pressions de vapeur,
ON NE PEUT PAS LIER DIRECTEMENT LA TEMPERATU RE D'EBULLITION A LA
VITESSE D'EVAPORATION.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
28.
Un exemple caractristique est celui du propanol qui bout 9 7 C : il
s'vapore pourtant deux fois moins vite que l'actate de propyle qui bout,
1 ui, 10 1 C
D'autres facteurs interviennent en effet et perturbent cette relation
directe.
3. Chaleur latente d'vaporation ( 17)
T 0 constante
tt1
Considrons un thermostat, c'est--dire une enceinte maintenue une
teprature constante choisie. Plaons-y un rcipient contenant un liqui
de sous un piston bien hermtique. Soulevons trs lentement le piston : le
liquide passe progressivement l'tat vapeur et un moment donn il ne
reste plus une goutte de liquide. Tout au long de cette vaporation, le
thermostat a d fournir de la chaleur pour maintenir la temprature cons
tante, car l'vaporation entrane un refroidissement.
La quantit totale de chaleur fournie pour que 1 g de liquide soit
pass compltement l'tat vape,ur temprature constante est appele la
CHALEUR LATENTE DE VAPORISATION de ce liquide. Elle varie selon la pres
sion atmosphrique.
On constate que les valeurs les plus leves de la chaleur de vapo
risation sont prsentes par l'eau et par les alcools. Ceci s'explique
par les trs fortes interactions intermolculaires qui rgnent l'tat
liquide entre les molcules de ces composs, et en particulier aux asso
ciations par liens d'hydrogne (cf. p. 56). Les alcools forment en effet
des agrgats de diffrents types ( 18).
R
'0 - H R
'0 - H . . R.'\0 - H R-0
/
H
o - R
monomres dimres
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
29.
R R R
\ \ \
0-H . [ . O-H ) 0-H
polymres
Dans la phase vapeur, il n'y a que du monomre, sauf des pres
sions trs leves. Il faut donc fournir au liquide suffisamment d ' ner
gie (chaleur) pour briser les polymres en monomres susceptibles, de pas
ser l'tat vapeur. Il en rsulte une valeur leve de la chaleur la
tente de vaporisation.
La consonunation de chaleur lors de l'vaporation d'un liquide fait
que dans certains cas on atteint la temprature de condensation de l'eau
et l'humidit contenue dans l'air ambiant aux environs innndiats de la
surface d'vaporation se condense. Ce phnomne peut tre gnant si la
surface contient des substances sensibles l'eau, telles des rsines
terpniques naturelles. On observe alors des matits, des blanchiments
et autres dfauts optiques (19). C'est souvent le cas quand on utilise
des solvants qui s'vaporent trs rapidement, comme l'isooctane ou l'ther.
Le tableau ci-aprs rsume les valeurs des trois paramtres :
pression de vapeur, temprature ,d'bullition et chaleur latente de vapo
risation pour quelques solvants courants. Ils influencent tous trois la
volatilit d'un solvant, de sorte qu'il est difficile de faire des pr
visions.
Pour avoir des chances d'tre "volatil", le solvant doit prsenter
la fois une pression de vapeur saturante leve, un bas point d'bul
lition et une faible chaleur latente de vaporisation.
Ces conditions sont runies notamment pour l'ther, le dichloromthane,
le sulfure de carbone, etc.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
30.
Paramtres influanant la "volatilit" d'un solvant
Pression de vapeur Temprature Chaleur latente
Solvants en mm Hg 20 C d'bullition de vaporisation
760 mm Hg en cal.
eau 17,5 I_O 540
ther 440 34,6 86
dichloromthane 440 41 78,7
sulfure de carbone 360 46 82
formiate d'thyle 200 54 97
actone 178 56,2 125
chloroforme 160 61,3 59
mthanol 100 65 262, 8
benzne 74 80 94
actate d'thyle 73 77 87
thanol 40 78 204,3
heptane 40 98,2 76
isooctane 40 38 99 , 3 -
tolune 37 110, 6 83
isopropanol 33 82,4 159
paraxylne 10 138 81
diactone alcool 1 168 111
thylneglycol 0,06 197 19 1
glycrol 0,0025 2 10
4. La conductibilit thermique
La chaleur se transmet d'un corps chaud un corps froid ou d'une
zone plus chaude une zone plus froide d'un mme corps. Cela s e fait
plus ou moins rapidement selon que ce ou ces corps sont plus ou moins CON
DUCTEURS de la chaleur. Certaines substances comme les mtaux s.ont trs
conducteurs, d'autres comme le bois, le verre, . . . le sont moins et peuvent
servir d'ISOLANTS thermi ques.
Coefficients de conductibilit thermique 20 C (20)
air 0,0000014
cire 0,00009
lin 0,0002
bois 0, 0003
papier 0,0003
chaux 0,002
gypse 0,003
actone 0, 0004
thanol 0, 0004
tolune 0,00038
isopropanol 0,000336
ther 0,000328
dichloromthane 0,000 2 9 1
chloroforme 0,000246
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
31 .
L'vaporation d'un solvant exigeant un apport de chaleur, il l'em
pruntera d'autant plus facilement au milieu environnant que ce dernier
est conducteur de la chaleur.
Il faut nanmoins tenir compte de ce que si l'vaporation se fait
trop brusquement , cela provoquera un fort refroidissement qui peut
freiner la suite du processus.
Tous les solvants ont une conductibilit thermique suprieure
celle de l'air. En remplissant les fissres et les pores lors d'un net
toyage, ils amliorent donc momentanment la conductibilit thermique du
corps poreux.
5. Description de l'vaporation
Le schage des couches de peinture par dpart de solvant a fait
l'objet de nombreus_es recherches dont C.H. Hansen est l'un des pionniers
(20, 2 1 , 22, 2 3). Une revue taye a t publie rcemment par Newman
et Nunn (24).
Hansen a montr que le schage d'un film de peinture peut se divi
ser en deux. phases
La premire phase (I) est contrle par la rsistance de la surface
au passage du solvant vers l'air : la surface est encore mouille par
le solvant et il faut tenir compte de facteurs tels que la chaleur la
tente d'vaporation du solvarit, sa tension de vapeur, le coefficient
de diffusion du solvant dans l'air, le mouvement de l'air la surface,
etc.
La seconde phase (II) consiste essentiellement dans la rsistance des
couches internes du film lcher le sol vant. Cette tape serait con
trle surtout par le coefficient de diffusion du solvant dans le po
lymre. C ' est l'tape de RETENTION du solvant. Elle peut durer plu
sieurs annes.
Dans certains cas, la premire phase prsente une importante pr
pondrante. C'est ce que propose Sletmoe (25) pour le schage de films
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
32 .
de rsines alkydes et thylcellulose contenant des solvants qui ne for
ment pas de liens hydrogne (hydrocarbures saturs, aromatiques et chlo
rs) . Le passage de la surface semble l ' tape la plus lente. C'est elle
qui impose la vitesse-limite de l'ensemble : elle est dite DETERMINANTE.
Une des explications retenir serait que le refroidissement la surface
conscutif la consommation de la chaleur latente de vaporisation rdui
rait la fois la pression de vapeur du solvant et le coefficient de dif
fusion.
L'auteur dcrit de la faon suivante l'vaporation d'un solvant
partir d'une solution
1) diffusion travers la masse liquide de A en B,
2 ) passage de la surface liquide B ,
3 ) diffusion travers l a masse d'air laminaire stagnant l a surface du
liquide de B en C,
4) vacuation dans la rgion d'air turbulent D.
air turbulent
c
air laminaire
B
solution
Dauchot et De Witte (26) 0nt tudi le schage du vernis Paraloid B 7 2
que nous utilisons pour l e vernissage des peintures l'IRPA. Des solu
tions dans le tolune et dans le xylne 10 % ont t respectivement con
sidres. Les chantillons taient dposs respectivement sur une coupelle
mtallique et sur un chantillon de peinture. En suivant l'vaporation par
traceurs radioactifs, ils ont constat que le tolune pur s'vapore plus
vite que le p - xylne pur et que le solvant s'vapore moins vite sur la cou
pelle que sur l'chantillon de peinture.
Les auteurs expliquent ce phnomne en remarquant que le vernis, sui
vant les irrgularits de la peinture, est mince par endroits, ce qui peut
favoriser l'vaporation du solvant. On pourrait galement avancer l'expli
cation de Sletmoe concernant le refroidissement local qui dans ce cas-ci
est sans doute plus sensible sur la coupelle mtallique trs conductrice
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
33 .
que sur la couche de peinture.
Par ailleurs, aprs la formation du film, le tolune s'vapore moins
vite que le p-xylne. Une explication propose par les a uteurs serait
qu'il y a sans doute plus d'interactions du type polaire entre le to
lune et le Paralo1d car le p-xylne, quant lui, prsete un moment
dipolaire nul.
Yaseen et Ashton (27) montrent que durant la phase II de diffusion
du solvant dans la couche solide, l'limination du solvant est directe
ment proportionnelle la diffrence de tension de vapeur du solvant au
travers du film et inversement proportionnelle l'paisseur d u film.
Comme il n'y a pratiquement pas de solvant dans l'atmosphre aprs l a
phase I , l a diffusion v a continuer jusqu' c e qu'il n'y ait pl us de sol
vant dans le film. Nanmoins la sortie des pour-cents restants est trs
lente, d'une part quand il s'agit d'un film en formation, parce que la
rsistance la diffusion augmente ; d'autre part (ce qui est aussi vrai
pour un film dj sec), parce que la diffrence de pression de vapeur au
travers du film est trs faible. Il n'est pas rare de trouver encore des
solvants dans des films de peint ure qui ont t exposs au-dehors pendant
plus de deux ans.
L'vaporation de solvants aprs application sur un corps poreux
comme lors du nettoyage d'un tableau peut aussi tre divis en deux ta
pes : la premire tape, rapide, o l'vaporation du solvant rest en
surface prdomine, la deuxime, plus lente, o le solvant qui a pntr
dans le substrat ressort peu peu.
Anciennement, on dterminait la vitesse d'vaporation en dposant
0, 5 ml de solvant sur un papier filtre et en mesurant le temps d'vapora
tion l'abri des courants d'air. L'ther dithylique tait pris comme
rfrence, son temps d ' vaporation tant pos gal un. Aux Etats-Unis,
on a longtemps utilis une mthode r.iesurant le temps d'vaporation de
5 ml de solvant contenus dans un creuset en porcelaine d'environ 4 cm de
diamtre, avec l'actate de butyle comme standard (28) . Ces diffrentes
mthodes donnent des rsultats non comparables, ce qui les rend trs ala
toires. En fait, ces vitesses d'vaporation correspondent assez bien
la phase I mais ne tiennent pas compte de la phase II. Elles ne sont pas
utilisables ni pour des mlanges de solvants, ni pour prvoir l'vapora
tion aprs imprgnation d'un corps poreux.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
34.
M. Dauchot a tudi l'aide de traceurs radioactifs l'vaporation
de solvants utiliss sur une peinture (29). Pendant les trois ou quatre
premires minutes, c'est la couche reste en surface qui s'vapore. Elle
se comporte comme le solvant isol. Plus tard, on observe un freinage de
l'vaporation qui peut s'expliquer par la pntration dans les pores.
Selon l'allure du phnomne, on peut dduire dans quelle mesure un solvant
est pntrant. M. Dauchot classe par ordre croissant de pntration suc
cessivement l'isopropanol, l'thanol, le mthanol et l'actone. Notons
que cet ordre correspond des valeurs croissantes d e la tension superfi
cielle (cf. p. 15) et des valeurs dcroissantes de la viscosit (cf. p. 12).
Ces deux paramtres pourront utilement contribuer prvoir le pouvoir de
pntration ainsi que nous le dtaillerons plus loin.
Les mesures montrent en outre que la quantit de solvant retenu est
trs diffrente selon qu'on l'applique la goutte ou au tampon, dans le
cas de l'thanol et l'isopropanol, mais non dans le cas du mthanol et de
l'actone. L'aut eur interprte ce phnomne de la manire suivante : pour
les solvants peu diffusants, il y a une grande diffrence car le tampon
fait pntrer une quantit de solvant qui la goutte ne pntre pas, ce
qui n'est pas le. cas pour les solvants trs pntrants qui diffusent vite
dans le substrat.
Schoeller tudie des phnomnes trs analogues accompagnant l'vapo
ration de l'eau dans les sols (30). Il considre successivement l'vapo
ration partir d'une nappe d'eau, l'vaporation par un sol satur d'eau
et finalement l'vaporation par un sol non satur d'eau. Ces trois tapes
peuvent tre compares ce qui se passe au cours du nettoyage d'un corps
poreux l'aide de solvants.
Pour l'vaporation de l'eau sur le sol, il faut tenir compte d u d
ficit de saturation de l'air en eau, de la pression baromtrique, de l'a
gitation de l'air, des dimensions (tendue et profondeur) de la couche li
quide, de la couleur du sol.
Un sol compltement imbib d'eau s'vapore autant qu'une surface
d'eau et mme quelquefois davatange. L'eau qui s ' vapore ainsi peut tre
renouvele par monte capillaire, surtout quand les capillaires affleurent
en grand nombre, mais ce rapprovisionnement est trs lent, et d'autant
plus lent que le sol est compos d'lments plus grossiers.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
35.
Un sol non satur d'eau : l'eau libre ou l'eau capillaire est
descendue en dessous de la surface du sol. Le mouvement de l'eau sous
forme de vapeur se fera si l'air n'est pas satur en vapeur d'eau, des
rgions de forte tension de vapeur vers les rgions plus faible ten
sion de vapeur. Pour l'eau capillaire, le passage de l'eau liquide en
eau vapeur dpend de la taille des capillaires. Plus les capillaires
sont troits, plus petit est le rayon de courbure et donc plus faible
est la tension de vapeur, selon la formule de Lord Kelvin
2 HT
p
r r pour un mnisque concave
o Pr est la tension de vapeur saturante au-dessus d'une surface sph-
rique de rayon r, P la tension de vapeur au-dessus d'une surface plane
00
de rayon 00
, T la tension superficielle et H une constante dpendant de
la densit du liquide. L'vaporation se fera donc d'autant plus lente
ment que les capillaires sont plus troits.
L'eau ainsi vapore la surface des mnisques doit se diffuser
vers la surface du sol. Cette diffusion sera d'autant plus aise que
les canaux sont courts et largement ouverts. Quoiqu'il en soit, cette
diffusion est extrmement lente : une couche de 70 cm de sable, avec des
2
grains de 2 nun de diamtre vapore environ 6 litres par m et par an,
soit une paisseur de 6 rmn d'eau.
6. 1esure de 1' vaporation et de la rtention des solvants dans les peintures
L'tude de l'vaporation t de la rtention des solvants dans les
couches picturales a t aborde par Jones (31) et Dauchot (29) l'aide
de molcules marques.
Nous avons opt pour une mthode gravimtrique l'aide d'une ther
mobalance, vu la difficult de se procurer les traceurs correspondant
toute la gamme des solvants utiliss en conservation. La prcision des
mesures en valeur absolue est sans doute moindre, mais la mthode permet
une bonne valuation relative. Les essais ont t effectus en dposant
une quantit connue de solant sur un fragment de peinture de surface
standard. Il s'agit d'une peinture dcorative dnue de valeur artisti
que, mais bien date 1896. Le ciel offre une vaste surface bleue rela
tivement uniforme dont la structure picturale est la suivante
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
36 .
vernis mastic + huile
huile + blanc de plomb + bleu de Prusse
prparation au blanc de plomb
Les donnes, quantit et temps de rtention, reprises dans les gra
phiques, doivent tre interprtes en comparant les solvants les uns aux
autres. Elles donnent des valeurs essentiellement relatives qui ne sont
pas ncessairement identiques en valeur absolue pour d'autres conditions
exprimentales. La majorit des solvants prsentent une vaporation en
deux phases : une phase rapide suivie d'une phase lente o les derniers
pour-cents s'vaporent petit--petit.
Certains solvants s'vaporent totalement et rapidement sans que nous
ayons . pu mesurer un quelconque ralentissement (exemple : ther, thylique,
diisopropylther, ttrachlorure de carbone, isooctane, mthylcyclohexane,
benzne).
A l'autre extrme, il existe des solvants dont l'vaporation est
trs lente ds le dbut (exemple : thylneglycol, formamide, acide ac
tique, acide formique, butylamine).
Il est clair que la constatation visuelle de l'vaporation d'un sol
vant est souvent trompeuse e t qu'une partie non ngligeable peut rester
parfois trs longtemps emprisonne dans le corps poreux. Comme pour les
icebergs, on ne voit qu'une fraction de la ralit.
Les mesures par la thermobalance (3) indiquent que la quantit de
solvant encore prsente en dbut de phase II est gnralement faible,
quelques pour-cents. Nanmoins, il existe une srie de solvants o cette
quantit est nettement plus leve. Dans ce cas, le danger est d'autant
plus grand que la phase II est plus lente. Les solvants les plus nuisi
bles cet gard sont les glycols, la trbenthine, la butylamine, la
formamide. Ils sont susceptibles de ramollir dangereusement des liants,
vernis ou glacis sensibles, par exemple des rsines naturelles ou des
huiles insuffisamment polymrises et oxydes (peintures des XIXme et
X.Xme sicles).
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
37.
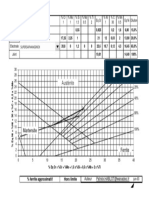
Les courbes d'vaporation permettent de distingue diverses cat
gories de solvants. Nous proposons de les grouper en quatre sries :
SOLVANTS A RETENTION TRES FORTE : l ' vaporation est trs lente ds le
dbut, de sorte qu'on ne distingue gure qu'une phase II sans phase I.
Aprs 2 4 h , il reste encore plus de 10 % de la quantit applique.
Exemple : thylneglycol, formarnide, acide actique, acide formique,
butylamine, trbenthine, cyclohexanol, dimthylsulfoxyde,
malonate d'thyle, mthylpyrrolidone, . . .
SOLVANTS A RETENTION FORTE la phase I est lente , elle dure prs d'un
demi-jour (environ 12 h) . La phase II dbute quand il reste encore en
tre 3 10 % de solvant dans la peinture.
Exemple diactonealcool, alcool amylique, dimthylformamide,
ttrahydrofurane, tertiobutylamine, . .
SOLVANTS A RETENTION MOYENNE : la phase I dure entre 30 minutes et
4 heures, la phase II commence avec 2 3 % de la quantit initiale
de solvant.
Exemple : les alcools j usqu' l'alcool butylique (4 atomes de C) compris,
l'ammoniaque (6 M) , l'eau, le cumne, le xylne , le paraxylne,
le chlorobenzne, . . .
Nous classons aussi dans cette srie la plupart des ctones et des
esters, bien qu'ils se distinguent par une phase I plus rapide, gnrale
ment termine avant 30 minutes.
SOLVANTS A RETENTION FAIBLE : la phase I est termine endans les 30 mi
nutes aprs l'application du solvant sur la peinture. Il ne reste que
des fractions de pour-cent en dbut de phase II. Parfois mme, cette
dernire n'existe pratiquement pas.
Exemple : la plupart des hydrocarbures saturs, la plupart des drivs
halognes, le benzne, le tolune, les thers thyliques et
isopropyliques, le CS2 , l'actonitrile, .
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
Evaporation des solvants et rtention dans les peintures
11'f'OAOCAA9UflES
1 .cyclohot- Jl.dlct,lv.......
2.Ntl\ylcycloi-..oc- 13 . l . Z -dict.loroio,,"'t:
3.l'>el)l- 1 4 . t , l , 1 -t..-J c::hlON)V\e.-.e
4,t.ooct.,.,. l5 ,JMr,c.t,loroithyl
s, .....1C.o .p,,.l c. 15.t.vct\l-- de c:r.
1 7 .<;h1o.-o'""
J8 .cf'olo.-ot,e,.,,r.,...
7, 0..nr.i,...
.t.Olui....
9. ...yt .... 19. cil<iV'lyl<it.r.o,.
.e.,....,...
10.,,.,....yl ...... 20.dl l oM:iproi>yl it"'-r
ll ZI , t.iv-hydrOI'....,._
ESU;.M
J .ch.o""' 9.ror"'it.e d' itf\yle
Z.fMlt.hyl;h,,..yic11h- IO c.1itt oe et.t'lyl
'.J.lfl.;U.yl 1110buty lcito"" 1 1 .cctt o',h.nyle
4, z -f"tno,... ll, ce1.t 0' 1oOroo;h.
S, 3- pi,l'ltnoNi, l) .ci\ot o,r butyh
6.oc.:;.t.)'l ocitone 1<1 , .,,;1.ot d'"-VI
1.cycli;:,tw1t..,.."' tS.lont d'it*"'yle
l ,Mtnol
l,l.t\4Jn01
,.op,e<'l,Ql
4, , oop.-Qp.,..ol
S,bvt..,_OJ n,
6, l eotM.ot-1
1,bVt..,.ol -c.
0.Alc:.-)'liq.,.
t. .._ 11oeyl iQV9
10,dio.ci\-.ol-.ool
1 1 ,C)'CJON",r-J
12.9-ylef"loglyc:oJ
AMlHES 01\'C:AS
l .butyll,..., 6 ,cu
t. trtlobut)'l,.1""' 7 - Cp.A(6MJ
A.tClOts
,.,or-Jc1e
411.dh,,ttylt'orw.-1
Nlfftllf$
2 J S o 789,0 20 )O <()50 lt.J
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
39.
III. DISSOLUTION
J . Introduction e t dfinitions
Un solide en SOLUTION dans un liquide s'y trouve dispers jusqu'
l'chelle des molcules ( 10 ) . Autrement dit, les molcules de sol-
vant ont d s'introduire entre les molcules du solide et les carter les
unes des autres pour s'y placer elles-mmes.
solution
solide
0
,,. 0
Certaines substances ne se laissent pas disperser aussi finement.
Soumises un bon solvant, elles forment de gros aggrgats ou MICELLES
dont la taille varie entre O.OOJ e t 0.2 : ce sont les DISPERSIONS
COLLOIDALES. La plupart des molcules de grande taille adoptent ce
comportement.
Selon les interactions en prsence, les dispersions collodales
peuvent se prsenter sous trois formes :
1) ' amorphe (rpartition dsordonne) ou cristallin (arrangement
-
rgulier). Les micelles collodaux trs proches les uns des autres
interagissent fortement. Beaucoup de substances filmognes se figent
sous cette forme en schant.
2) Le_COACERVAT, les particules collodales peuvent, un peu comme dans
l'tat liquide, glisser les unes sur les autres, mais leurs interactions
non ngligeables contrecarrent la tendance l'expansion (exemple : le
blanc d'oeuf).
3) Q, les particules collodales qui forment la phase disperse sont
-
indpendantes les unes des autres et rparties statistiquement dans le
solvant ou phase dispersante (32).
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
40.
Quand on essaie de dissoudre une substance filmogne vieillie, par
exemple un vieux vernis ou un surpeint, il est rare que l'on obtienne une
vraie solution, ou mme un sol. La plupart du temps, le solvant parvient
seulement gonfler le solide jusqu' un tat plus ou moins proche du
coacervat (33). Cet tat relativement fluide permet nanmoins l'limina
tion mcanique de la couche l'aide d'un tampon d'ouate ou d'un scalpel.
2. Donnes thermodynamiques (34)
La thermodynamique tudie les changes d'nergie qui ont lieu au
cours d' un phnomne (par exemple la dissolution d'un vernis, la vapori
sation d'un solvant) entre un SYSTEME et le milieu extrieur. Ce systme
est une portion de matire, pour nous par exemple ce sera l'ensemble
solvant-solut que l'on isole par la pense. Par convention, on compte
positivement l'nergie que le systme reoit du milieu extrieur et n
gativement celle qu'il donne l'extrieur.
L'tude de ces changes permet de prvoir si un phnomne a des chan
ces de se produire. Nous tenterons quant nous de prciser quelles sont
les conditions favorables pour qu'un solvant dissolve un solut.
L a thermodynamique classique s'appuie sur deux principes qui n'ont
jamais t dmontrs. Ils rsultent de nombreuses constatations expri
mentales.
a) Premier_principe : CONSERVATION_DE L'ENERGIE
La quantit totale d'nergie d'un systme est constante, quelle que
soient les transformations de cette nergie l'intrieur du systme.
L'nergie peut en effet se prsenter sous plusieurs formes mcani-
que, chimique, thermique, lectrique, etc.
Exemples : Dans une pile lectrique, l'nergie chimique est transforme
nergie lectrique. Dans une machine vapeur, l'nergie thennique est
transforme en nergie mcanique (locomotive). Dans les turbines d'un
barrage, l'nergie mcanique est transforme en nergie lectrique, etc.
Mais ces transformations ne se font pas intgralement d'une forme
l'autre. Quand on brle du charbon pour produire de la chaleur (nergie
calorifique) que l'on utilise ensuite en nergie mcanique, cette nergie
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
41.
mcanique ne reprsente qu'une faible partie de l'nergie donne par
le charbon. Le reste n'a pas disparu, mais au cours des diffrentes
transformations qui ont men de l'nergie calorifique l'nergie m
canique, il s'est form de l'nergie thermique basse temprature
moins apte fournir du travail et qui s'est dissipe dans le milieu
ambiant sans utilit : on dit que l'nergie a tendance se DEGRADER.
Le premier principe peut donc tre nonc de la manire suivante :
dans un systme isol qui subit des transformations, l'nergie se
conserve mais se dgrade.
La somme de toutes les nergies (mcaniques, thermiques, chimiques, . . . )
qu'un systme donn peut changer avec l'extrieur s'appelle son
ENERGIE INTERNE. On ne peut l'valuer d'une manire absolue, seules
ses variations sont mesurables.
b) Deuxime_erinciEe ENTROPIE
La plupart des transformations se font dans un sens privilgi
par exemple, quand on touche une barre mtallique chaude avec une
barre froide, la chaleur passe du corps chaud au corps froid. Le
corps froid ne devient jamais plus froid.
Ce sens privilgi correspond une augmentation du DESORDRE. On
a en effet constat que quand un systme peut voluer spontanment de
diffrentes faons, c'est celle qui provoque l'augmentation maximum
de dsordre qui se produit.
Deux gaz spars se mlangent quand on ouvre le robinet. La trans
formation est irrversible. Elle s'arrte quand le dsordre est maxi
mum. On traduit cette notion par une grandeur thermodynamique appele
ENTROPIE S. La variation de l'entropie traduit la variation du
dsordre.
Quand un solvant dissout un solut, les molcules de solvant. sont
cartes l'une de l'autre et il en est de mme pour les molcules de
solut. Il faut vaincre l'nergie de cohsion qui existait entre ces
molcules et les remplacer par de nouvelles interactions mixtes sol
vant-solut.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
42.
Cette opration de mlange ncessite une certaine nergie que l'on ap
pelle CHALEUR DE MEL.ANGE (ENTHALPIE).
On dfinit une nouvelle grandeur thermodynamique, l'ENERGIE LIBRE,
qui dpend la fois de la chaleur de mlange et de l'ntropie et dont
le comportement indique s'il y aura ou non dissolution.
l llH - T t:.S
6F est la variation de l'nergie libre de diss olution
6H est la variation de la chaleur de mlange
6S est la variation de l'entropie, donc du dsordre
T est la temprature absolue.
Hildebrand pose le principe que la variation de l'nergie libre de
dissolution d'un polymre dans un solvant doit tre ngative pour
pour qu'il y ait dissolution. Autrement dit, il faut que la disso
tution entrane une diminution de l'nergie libre.
Pour simplifier, on peut considrer que les polymres prsents dans
les peintures (vernis, liants) sont l'tat amorphe (non cristallin)
et que leur dissolution peut tre considre coI!lllle un simple mlange (35).
Dans le solvant liquide, l '. tat de dsordre (S) est relativement
grand car les molcules peuvent glisser les unes sur les autres, bien
qu'elles restent prisonnires de la masse liquide. Elles peuvent aussi
quitter la phase liquide pour la phase vapeur.
Les grosses molcules de polymres, par contre, sont beaucoup moins
mobiles cause de leur taille et de leur forme.
Quand on mlange les petites molcules de solvant avec ces grosses
molcules, ces dernires acceptent une augmentation de l'entropie. En
effet, elles deviennent plus libres de bouger (selon la viscosit) et
de plus elles peuvent se disposer autrement (entropie de configuration)
car la nouvelle libert de rotation autour des liens C-C permet la
molcule d'adopter diffrentes formes.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
43.
Il en rsulte que la dissolution entrane une grande variation de
l'entropie e t le facteur - T S tend rendre ngative la variation
de 1'nergie libre.
Il faut encore dterminer H qui mesure la chaleur de mlange.
Hildebrand suppose que l'nergie ncessaire pour que les molcules de
solut soient spares l'une de l'autre par les molcules de solvant
peut tre mesure par la chaleur de vaporisation, car il y a aussi
sparation des molcules au cours de la vaporisation.
Si l'nergie ncessaire pour sparer les molcules A l'une de l'au
tre est trs diffrente de celle qui est ncessaire pour les molcules
B, chaque espce de molcule prfrera ses semblables e t ne se mlan
gera pas aux autres (36).
Par contre, si les nergies sont du mme ordre de grandeur, les A to
lreront les B proximit e t vice-versa. Dans ce cas, H est petit
et F est rendu ngatif par le terme - T S.
c) Paramtre_de_solubilit h
Hildebrand propose donc un PARAMETRE DE SOLUBILITE S qui serait
gal la racine carre de l'nergie ncessaire pour sparer les
molcules d'une espce donne (en cal/ml) (37, 4 1 ) .
Selon cette thorie, plus les paramtres de solubilit de deux
substances sont semblables ., plus il y a de chances qu'elles soient
miscibles l'une dans l'autre.
Stolow (31) a utilis cette notion dans le cas de l'huile de lin
ge. Il tudie le gonflement d'une couche picturale l'huile et au
blanc de plomb (paisseur 200 - vieillissement 27 semaines 32 C)
dans diffrents solvants. Les solvants qui provoquent le maximum de
gonflement sont ceux dont les nergies de cohsion et donc le param
tre de solubilit sont les plus semblables ceux de l'huile.
d) T.riangle de solubilit
-- --- -------------
Partant de ces donnes, une srie d'auteurs, parmi lesquels Crowley,
Teague et Lowe (38), Hansen (39) et Teas (40). ont tent d'ajuster ce
paramtre de solubilit aux donnes de l'exprience pour permettre son
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
44.
utilisation dans des problmes pratiques. C'est ce qui a men dfi
nir un TRIANGLE DE SOLUBILITE.
Il rsulte de ces diffrents travaux que le paramtre de solubilit
comporte trois termes, rsultant respectivement de trois types d'inter
action : les forces de dispersion de Van der Waals, c ' est--dire celles
que nous dcrivons plus loin sous le titre "interactions entre molcu
les non dipolaires ", les interactions entre dipoles et les inter
d p
actions par liens d'hydrogne . Hansen propose la relation :
h
Teas propose une autre forme d'quation qui donne une meilleure r
partition des solvants dans le triangle car, avec la relation de Hansen,
un grand nombre de solvants taient confin dans le coin droit du
triangle.
d
100
d + p
+ <\
p
fp 100
d + p + 6h
h
)00
d + p + <\
Dans cette reprsentation, chaque solvant occupe une place bien d
termine dans un triangle dont chaque ct reprsente une chelle de
chaque composante du paramtre de solubilit.
O n dtermine ensuite exprimentalement le comportement de diffrents
types de polymres dans ces solvants. Hansen (39) a ainsi mesur la
solubilit d'une trentaine de polymres trs divers (mtacrylates,
poxy-, actate de polyvinyle, ureformaldhydes, etc.) dans 90 sol
vants diffrents. Il examine le comportement de 0,5 g de solut dans
5 ml de solvant et il classe les rsultats selon l'chelle
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
45.
soluble
2 presque soluble
3 fortement gonfl, faiblement soluble
4 gonfl
5 faiblement gonfl
6 pas d'effet visible.
Chaque polymre prsente sur le triangle une aire de solubilit.
Ces notions ont t appliques dans le domaine de la conservation
et l'on se rfrera utilement aux publications de R.L. Feller (42, 64) ,
G. Torraca (43) , L.S. Mora, P. Mora et P. Philippot (44). Ces der
niers ont mesur la solubilit des principales substances filmognes
naturelles (cf. p. 46 et 47).
Connaissant l'aire de solubilit d'un polymre dans le triangle,
on peut choisir des solvants de part et d'autre de cette aire, ven
tuellement mme tombant en dehors de la zone de solubilit, mais dont
le mlange permettra de dissoudre le polymre.
Exemples : L'aire de solubilit de l'huile est situe dans le triangle
l'endroit marqu en pointill.
Le mlange d'un alcool et d'un compos halogn mme tombant cha
cun en dehors de cette aire donne un point qui peut se siter dans
l'aire
f f f
d p h
(43)
mthanol 30 22 48
1,2-dichlorthane 67 19 14
pour un mlange 50 50 15 11 24
X 50/J00 = J/2 33, 5 9,5 7
48,5 20,5 31
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
TRI ANGLE DE SOLUBILITE (40) SOLUBILITE DES SUBSTANCES
FILMOGENES NATURELLES (44 )
fd
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
d ' aprs J . P . Teas (40)
d ' aprs J . P . Teas (40)
f f f f f f
d p h d p h
1 - Methanol 1 4 . 30 31 23 46 36 - n-Butyl acetate 8 . 46 60 16 24
3 - E thanol 1 2 . 92 36 19 45 36A - Isoamyl ace tate 8. 32 60 27 13
4 - n-Propanol J l .97 40 16 44 37 - Isobutyl isobutyrate 7 . 80 63 22 15
5 - n-Butanol 1 1 . 30 43 14 43 38 - Ace toni tri le 1 1 . 75 41 43 16
6 - 1 -Pentanol J0.60 47 12 41 38A - Butyroni tri le 9 . 96 48 39 13
7 - 2-Ethyl butanol J O . 38 48 JO 42 39 - Nitromethane 1 2 . 06 41 46 13
8 - 2-Ethyl hexanol 9 . 85 53 6 41 40 - Nitroe thane 1 1 . 09 47 42 11
9 - Methyl isobutyl carbinol 9 . 72 51 7 42 4 1 - 2- Nitropropane 1 0 . 02 58 33 9
JO - Propylne glycol 14 . 80 39 15 46 42 - Aniline 1 1 . 04 SS 21 24
1 1 - Ethylne glycol 1 6 . 30 32 17 SI 43 - Ni trobenzene 10.62 59 29 12
1 2 - 1 i 3-Butanediol 1 4 . 14 35 17 48 44 - Ethanolamine 1 5 . 48 31 32 37
1 3 - G ycerol 2 1 . 10 26 22 52 45 - Dime thyl formamide 12. 14 41 32 27
1 4 - Cyclohexanol 1 0 . 95 50 12 38 46 - Dipropyl amine 7 . 79 72 12 16
1 5 - m-Cresol 1 1 . 10 49 17 34 4 7 - Die thyl amine 7.96 62 19 19
!SA - Ethyl lactate ] 0 . 50 44 23 33 4 7A- Morpholine 10.52 53 21 26
!SB - n-Butyl lactate 9 . 40 52 22 26 4 7B - Cyclohexyl amine 9 . 05 63 15 22
16 - Diethylne glycol 1 4 . 60 25 30 45 4 7C - Pyridine 10. 6 1 56 22 22
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
1 7 - Dipropylne glycol 15 . 5 2 30 25 45 48 - Carbon tetrachloride 8 . 65 85 2 13
1 8 - Butyl Cellosolve 10 . 2 5 46 20 34 49 - Chloroform 9.21 67 10 23
1 9 - Methyl Carbitol 10.80 44 22 34 50 - Ethylene chloride 9 . 76 63 23 14
20 - Celloso,lve solvent 1 1 .88 43 20 37 5 1 - Methylene chloride 9 . 93 59 20 21
2 1 - Diacetone alcohol JO. 18 37 29 34 52 - 1 , 1 , 1 -Trichloroe thane 8.57 68 17 15
22 - Cellosolve acetate 9.60 50 34 16 52A - 1 -Chlorobutane 8 . 44 66 23 11
22A- Methyl Cellosolve 1 2 . 06 39 22 39 5 3 - Trichloroethylene 9.28 68 12 20
23 - Diethyl ether 7 . 62 67 23 10 53A - 2 ,2-Dichloroethyl ether 10.33 54 37 9
23A - Furan 9 . 09 65 12 23 54 - Chlorobenzene 9 .5 7 70 15 15
24 - Dioxane 9. 74 58 28 14 55 - o-Dichlorobenzene 9 . 98 69 15 16
2 5 - Methylal 8 . 52 57 32 JI 5 6 - a-Bromonaphtalene 1 0 . 25 68 18 14
26 - Diethyl sulfide 8.46 66 26 8 56A - Cyclohexyl chloride 8.99 68 24 8
26A - Carbon disulfide 9.97 86 7 7 5 7 - Benzene 9 . 15 76 7 17
26B - Dimethyl sulfoxide 1 2 . 93 37 33 30 5 8 - Toluene 8. 9 1 78 6 16
2 7 - Propylene carbonate i 3 . 30 48 43 9 59 - Ethyl benzene 8 . 80 80 5 15
28 - y-Butyrolactone 1 2 . 78 43 36 21 5 9 A - Xylene 8 . 80 82 6 12
29 - Acetone 9. 77 50 37 J3 60 - S tyrene 9 . 30 76 9 15
30 - Methyl ethyl ketone 9 .27 53 30 17 6 J - Tetralin 9 . 50 83 4 13
3 1 - Methyl isobutyl ketone 8.57 56 23 21 62 - Hexane 7 . 24 96 2 2
3 IA - Methyl isoamyl ketone 8.63 58 22 20 63 - Cyclohexane 8. 1 8 94 2 4
32 - Diisobutyl ke tone 8. 1 7 67 16 17 64 - Water 2 3 . 50 19 22 58
32A - Isophorone 9. 71 52 25 23 65 - Ace tic acid 1 0 . 35 40 19 41
32B - Ace tophenone 9.68 58 25 17 66 - Formic acid 12. ]5 33 20 47
33 - Cyc lohexanone 9.88 56 22 22 67A- Butyri-c acid 1 1 . 30 53 13 34
33A - Tetrahydro furan 9 . 52 55 22 23 68 - Benzaldehyde 1 0 . 40 57 16 27 .i,-
.......
34 - Mesi tyl oxide 9 . 20 55 24 21 69 - Ace tic anhylride 1 0 . 85 36 37 27
35 - Ethyl acetate 9 . 10 51 17 37 70 - Formamide 28 42 30 (43)
7 1 - 1 , 2-dichlorothane 67 19 1 4 (43)
48.
La composition d'un dcapant commercial efficace pour les surpeints
huileux est : 45 % de dichloromthane, 15 % de mthanol, 25 % de butanol
et 15 % de formamide. Nous pouvons aisment trouver un mlange plus
simple qui tombe au mme endroit dans le triangle :
f f f
d p h
dichloromthane 59 20 21 X 45/ 100
mthanol 31 23 46 X 15/ !OO
butanol 43 14 43 X 25/100
formamide 28 42 30 X 15/100
46,05 22, 25 31 , 6
Nous le remplaons par le mlange
actate d'thyle 51 17 37 X 50/100
dimthylformamide 41 32 27 X 50/ 100
45, 0 24, 5 32, 0
L'exprience montre que ce mlange prsente la mme efficacit que le
dcapant.
Des travaux rcents raliss par Ahmad et Yaseen tentent de prvoir
les valeurs des paramtres de solubilit des solvants et des polymres en
fonction des groupements d'atomes qu'ils contiennent (45) . Ils cons ta
tent une augmentation du paramtre de solubilit pour les sries :
onormal > o iso
. > o tertio
.
0 0
amylphnylther > amylthylther
> o ortho
o para > ometa
Nous avons cependant remarqu que la place d'un mlange de solvants
dans le triangle ne suffit pas pour choisir une formulation destine
un nettoyage particulier. La vitesse d'vaporation joue galement un
grnd rle dans l'efficacit. Le triangle ne permet pas de tenir compte,
en outre, de facteurs trs importants connne le pouvoir de pntration, le
temps de rtention, etc.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
49.
3. Interactions spcifiques
Les forces d'interactions que le solvant doit surmonter pour s'in
troduire entre les molcules ou les micelles des substances dissoudre
dpendent de la nature de ces substances.
Une substance A sera soluble dans un solvant B si l ' nergie ncessaire
pour sparer les molcules A les unes des autres est du mme ordre de
grandeur que celle qui est ncessaire pour sparer les molcules B les
unes des autres.
Dans le cas contraire, chaque espce de molcules prfrera ses
semblables et ne se mlangera pas aux autres.
Pour tablir correctement un choix rationnel des solvants, il faut
avoir des ides plus prcises sur- les interactions spcifiques possibles
entre le substrat dissoudre et les solvants. On peut dire, d ' une ma
nire trs gnrale, que la vieille rgle des alchimistes : "SIMILIA
SIMILIBUS SOLVUNTUR", le semblable dissout le semblable, est trs souvent
vrifie.
Dcrivons rapidement les principales interactions spcifiques (46, 47)
a) Attractions_ou_reulsions_lectriques_entre_ions
Les ions sont des atomes ou des groupes d'atomes porteurs d'une
charge lectrique. Ils peuvent exister l'tat solide, comme dans
le cas du chlorure de sodium dont les cristaux sont forms d'un assem
blage d'ions (lectrolyte vrai) mais, le plus souvent, ces ions se
forment seulement en solution (lectrolytes potentiels).
Certains solvants ont en effet la proprit de provoquer l'ionisa
tion et parfois la dissociation de certains soluts :
eau
solvants
+ -
AB (A B ) + B
ionisation dissociation ions spars
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
50.
Les forces lectriques entre les ions (dites forces de Coulomb)
sont d'autant plus grandes que les charges Q et Q sont grandes, mais
A B
elles diminuent quand la distance r entre les ions augmente et quand
la CONSTANTE DIELECTRIQUE, E, (une grandeur lie la conductibilit
lectrique) du solvant augmente.
Forces de Coulomb
Seuls les solvants grande constante dilectrique pourront surmon
ter les forces puissantes liant les ions entre eux et provoquer ainsi
la DISSOCIATION. Ces solvants sont appels SOLVANTS DISSOCIANTS.
On les classe arbitrairement en trois catgories : solvants non dis
sociants E < 15, dissociants moyens 15 < E < 40, dissociants forts
E > 40.
Constantes dilectriques 25 C
N-mthylformamide 182,4
N -mthylactamide 175, 7
formamide 109, 5
eau 78,5
carbonate de propylne 65, 1
dimthylsulfoxyde 48,9
nitromthane 38,6
dimthylactamide 37,8
thylneglycol 37,7
actonitrile 37,5
dimthylformamide 36,7
nitrobenzne 34,8
mthyl- 1-pyrrolidone-2 33
mthanol 32,6
dithylneglycol 29,4
benzonitrile 25, 2
thanol 24, 3
actone 20,7
propanol 20, 1
mthylthylctone 18,5
isopropanol 18,3
cyclohexanone 18, 3
actophnone 17,4
butanol 17, 1
ther monothyl E.G. 15,9
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
s 1.
isoamyl alcool 1 4, 7
alcool benzylique 1 3, 1
pyridine 1 2, 3 '
tertiobutanol 12,2
1, 2-dichlorothane 10,4
dichloromthane 8, 9
ttrahydrofurane 7, 4
acide actique 6,2
actate d'thyle 6,0
chlorobenzne 5,6
chloroforme 4,7
ther dithylique 4,2
diisopropylther 3,9
benzne 2,3
tolune 2,4
sulfure de carbone 2,6
ttrachlorure de carbone 2,8
trithylamine 2,4
cyclohexane 2,0
hexane 1, 9
On voit que les amides sont trs dissociants, vennent ensuite les
nitriles, les alcools et les ctones. Les facteurs striques inter-:
viennent une fois de plus, le propanol est plus dissoiant que l'iso
propanol, le butanol est plus dissociant que le tertiobutanol.
Les esters, les drivs chlors et les hydrocarbures aromatiques
et saturs se situent parmi les composs les moins dissociants.
Le pouvoir dissociant d'un solvant n'est pas ncessairement li
son pouvoir ionisant, qui est son aptitude transformer une liaison
covalente en liaison ionique (ionisation) . Le pouvoir ionisant d
pend de la capacit d'un solvant capter ou donner des lectrons.
Ainsi, l'acide actique est ionisant mais non dissociant. L'eau est
les deux la fois, ce qui explique en partie son exceptionnel pou
voir solvant.
Les solvants dissociants agiront particulirement sur les soluts
polaires, savoir les protines, les polysaccharides, les rsines
terpniques trs oxydes, etc.
b) !!ractions_et_reulsions_lectries_entre molcules_dieolaire
On sait que dans certaines liaisons, les lectrons sont attirs
davantage vers l'un des atomes (dit plus lectrongatif) , ce qui fait
apparatre un DIPOLE.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
52.
Exemple
, L'importante de cette dissymtrie des charges est mesure par le
moment dipolaire de la substance.
Parmi les groupements ou atomes CAPTEURS D'ELECTRONS, citons les
groupes amines NH , mthoxyle OCH , hydroxyle OH e t les atomes Cl,
2 3
Br, 1. Le groupe mthyle CH est DONNEUR D'ELECTRONS.
3
Pour que les attractions entre dipoles soient maximums, ils doivent
tre convenablement orients. Or on sait que dans les liquides les
molcules sont orientes au hasard. Cet effet lectrique dit d'ORIEN
TATION dpend donc fortement de la temprature et de la distance entre
les dipoles.
+ ---. - + -
-- + +-- +
Les hydrocarbures saturs et aromatiques ainsi que les molcules
symtriques (CC14, CS2, .. . ) ont des moments dipolaires nuls ou trs
petits. Les halognures, les alcools, les theroxydes, les esters,
les acides, les amines ont des moments dipolaires moyens.
Les glycols, les ctones, les amides, les nitriles, les drivs du
soufre sont classer parmi les molcules les plus polaires. Ces der
nires auront donc aussi beaucoup d'action sur les ions et les molcu
les polaires et en particulier les huiles et les rsines trs oxydes.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
53.
Moments dipolaires
carbonate de propylne 5,0
N-mthylactamide 4,3
mthyl-1-pyrrolidone-2 4, 1
nitrobenzne 4,0
N -mthylformamide 3,8
dimthylformamide 3,8
dimthylactamide 3, 8
actonitrile 3,5
formamide 3,4
nitromthane 3, 1
trithylneglycol 3,0
cyclohexanone 2,9
actone 2, 7
mthylthylctone 2,7
dithylneglycol 2, 3
pyridine 2,2
thylneglycol 2,0
actate d'thyle 1,85
eau 1, 8
1,2-dichlorothane 1, 75
alcool benzylique 1, 7
propanol 1, 7
isopropanol 1, 7
butanol 1,7
alcool isoamylique 1, 7
acide actique 1, 7
tertiobutanol 1,7
tetrahydrofurane 1, 7
thanol 1, 7
mthanol 1, 65
dichloromthane 1,5
chlorobenzne 1,55
diisopropylther 1,3
dithylther 1, 25
chloroforme 1, 1
tolune 0, 4
benzne 0
sulfure de carbone 0
cyclohexane 0
hexane 0
tetrachlorure d e carbone 0
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
54.
c) Actions_entre molcules_eolaires_et non polaires
Une molcule possdant un dipole permanent peut provoquer la forma
tion d'un DIPOLE INDUIT en s'approchant d'une molcule non polaire.
Ces FORCES INDUITES ne dpendent pas de la temprature, puisque
l'orientation du dipole induit est forcment la mme que celle du di
pole inducteur. Elles varient nanmoins avec la distance et la faci
lit de la deuxime molcule orienter ses charges lectriques,
c'est--dire sa POLARISABILITE.
La polarisabilit d'une molcule est due la prsence d'lectrons
mobiles faciles dplacer. Ces lectrons se rencontrent surtout dans
les drivs aromatiques (benzne, tolune, . . . ) et les composs ayant
des doubles liaisons conjugues :
C =C - C = C ou C =C - C =O
Une proprit physique, l'INDICE DE REFRACTION, est directement
lie la polarisabilit. On se rappelle que l ' indice de rfraction
d'un milieu est le rapport entre la vitesse de propagation d' un rayon
lumineux dans le vide par rapport sa vitesse dans le milieu
vide
2 milieu
La lumire se propage plus lentement dans un milieu transparent 2
que dans le vide, car il y a un freinage d l'interaction de la lu
mire avec les lectrons des molcules du milieu. Une valeur leve
de l'indice de rfraction correspond une forte polarisabilit de la
molcule.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
55.
Indices de rfraction
bromobenzne 1,6598
sulfure de carbone 1,6255
nitrobenzne 1 , 5525
alcool benzilique 1,5396
benzonitrile J,5289
chlorobenzne J,5248
perchlorothylne 1 , 5053
pyridine 1,5092
benzne J , 50 1 1
tolune 1 , 4969
o-xylne J ,5054
m-xylne 1,4972
p-xylne 1,4958
dimthylsulfoxyde J , 4783
trichlorothylne 1,4777
1, 1, 2-trichlorothane 1, 4 7 1 1
1-mthyl-2-pyrrolidone 1, 4666
tetrachlorure de carbone 1,4603
trithylneglycol 1, 4568
formamide 1,4475
dithylneglycol 1,44 72
chloroforme 1 , 4433
dimthylactamide 1, 4351
thylneglycol 1, 4 3 1 8
N -
mthylformamide 1 , 4310
N-mthylactamide 1,4277
dimthylformamide 1,4269
cyclohexane 1, 4263
dichloromthane 1, 4246
carbonate de propylne 1 , 4209
dioxane 1,4224
dithylneglycol dithylther 1, 4 1 15
alcool isoamylique 1, 4053
tetrahydrofurane 1, 4050
butanol 1 , 3992
nitromthane 1,3935
isooctane 1, 3935
propanol 1,3853
tertiobutanol 1, 3838
mthylthylctone 1, 3785
isopropanol 1, 3 7 7 1
hexane 1,3749
actate d'thyle 1, 3724
acide actique 1, 372 1
diisopropylther 1, 36 79
thanol 1, 3 6 1 1
actone 1, 3588
<lithylther 1, 3526
actonitrile 1 , 3442
eau 1 , 3330
mthanol 1, 3285
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
56.
Les solvants les plus polarisables ont des fortes interactions avec
les molcules polaires.
d) Actions_entre molcules_non_eolaires
La polarisabilit influence galement les interactions qui peuvent
se produire entre des molcules sans dipole permament. Leur nuage
lectronique peut nanmoins tre dform momentanment l'approche
d'une a-tre molcule, mme si cette dernire ne prsente pas de di
pole permamen t.
Ces sortes d'interactions s'appellent FORCES DE DISPERSION. Elles
sont responsables des forces de cohsion entre molcules peu ou pas
polaires. Elles sont particulirement puissantes chez les hydrocarbu
res aromatiques dont les nuages lectroniques sont trs dformables.
e) Liens_d'hdrogne
La liaison d'hydrogne est l a mise en commun d'un atome d'hydrogne
entre un DONNEUR D'HYDROGENE X et un CAPTEUR D'HYDROGENE Y portant une
paire d'lectrons libres (18, 46).
- +
XH + y + X H + y + XH y
X est un atome lectrongatif. Il favorise la formation d'un di
pole qui sera attir par la paire d'lectrons ports par Y. Vu sa
petite taille et l'absence de nuage lectronique autour de lui, le
proton autorise un rapprochement plus pouss des atomes X et Y, d'o
une plus grande force du lien.
Vu les lectrongativits, ce sont les atomes d'oxygne qui sont
les meilleurs donneurs X ; l'azote l'est galement, mais dans une
moindre mesure ; le carbone est un donneur faible. Les solvants pos
sdant une groupe donneur de protons (OH, NH, . . ) sont appels
SOLVANTS PROTIQUES, les autres sont dits APROTIQUES.
Le tableau ci-aprs rsume les participations possibles des diff
rents types de composs, aux liaisons H.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
5 7.
Liens d'hydrogne
COMPOSES DONNEURS H CAPTEURS H
hydrocarbures saturs, CS2,
CCl4, . . .
cires, bitumes, etc, . .
drivs halogns contenant
des H +
(CHC13)
ctones, aldhydes, thers,
amines tert., esters, hydro
carbures thylniques et +
aromatiques, DMF,
huiles fraches
eau, alcools, glycols,
acides carboxyliques,
amines primaires et
secondaires, amides, + +
Polysaccharides, protines,
rsines terpniques, huiles
ges
Seule l'eau est capable de rivaliser avec les nombreux liens d'hy
drogne qui lient entre elles les molcules de polysaccharides et de
protines. Il faudra donc utiliser un solvant aqueux pour dissoudre
ou gonfler ces substances, du moins sans les dgrader. Il est en ef
fet possible d'liminer des protines en les traitant avec un solvant
acide : ce dernier provoque une hydrolyse des grosses molcules et les
spare en fragments plus petits. La couche perd ainsi sa rsistance
mcanique et s'limine facilement.
Les alcools, les amines primaires et secondaires, les amides sont
des bons solvants des rsines terpniques et des huiles ges.
f) gs_d'lectrons
Un grand nombre de complexes ou de composs molculaires peuvent
tre forms par un donneur et un accepteur d'lectrons.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
58.
Les lectrons changs peuvent tre de diffrents types (o, halo
gnures d'aloyle ; n , hydrocarbures thylniques, aromatiques
n, paire d'lectrons libres).
Les donneurs d'lectrons "n" groupent des solvants trs importants
ces lectrons sont par exemple les deux paires d'lectrons libres qui
se trouvent dans l'atome d'oxygne ou la paire d'lectrons libres de
l'atome d'azote.
oxygne azote
On les trouve dans les ctones, les thers, les alcools, les amines,
les amides, etc.
Ces solvants sont COORDINANTS : ils forment des liaisons de coordi
nation (mise en commun de deux orbitales et de deux lectrons, ces der
niers tant fournis par le mme atome, contrairement la liaison cova
lente o chaque atome fournit un lectron). C'est le pouvoir donneur
d'lectrons du solvant qui . dtermine aussi son aptitude ioniser les
composs dissous : ils peuvent donc tre IONISANTS.
En rsum, si l'on veut considrer l'ensemble des interactions sp
cifiques pour chaque grande "famille" de composs chimiques utiliss comme
solvants, il faut donc valuer dans quelle mesure ils sont : DISSOCIANTS,
IONISANTS, POLARISABLES, PROTIQUES et COORDINANTS. Selon le nombre d'inter
actions possibles, on peut tablir un classement de l'action des solvants,
que nous reprendrons au chapitre III.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
59.
C H A P I T R E I I
D E S C R I P T I O N DE S P RI N C I PA U X S O L VAN T S
UT IL I S E S E N CO N S E R VAT I O N
!. HYDROCARBURES SATURES
J . Nomenclature et exemples (49 , 50, 5 3, 54)
Les HYDROCARBURES SATURES sont des composs organiques qui ne con
tiennent que des atomes de carbone et d'hydrogne et uniquement des
liaisons simples. Le carbone porte donc quatre liaisons et l'hydrogne,
une. Ils sont de ce fait trs peu ractifs.
Les HYDROCARBURES ALIPHATIQUES SATURES (ou ALCANES) prsentent des
chanes ouvertes (a) ; dans les hydrocarbures ALICYCLIQUES, les chanes
forment des cycles (b).
H H
H H H H 1 1
1 1 1 1 H - c -c -H
H - C - c - c - C -H 1
1 1 1 H -c -c -H
H H H H 1 1
H H
C H C H
n 2n+2 n 2n
n-butane cyclobutane
(a) (b)
Les hydrocarbures saturs liquides qui sont utiliss comme sol
vants prsentent entre cinq et dix-sept atomes de carbone. Ils sont
obtenus principalement par distillation du ptrole.
Exemples
= CH -(CH \-CH , principal constituant de la "ligroine" ou
3 2 3
ther de ptrole 6 0-80.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
60.
n-octane CH -(CH2 ) -CH , sa concentration dans l'essence sert de rf
3 6 3
rence pour chiffrer le pouvoir dtonant.
isooctane 2 , 2 , 4-trimthylpentane
H C -
3
solvant intressant comme diluant vu son faible pouvoir pn
trant et gonflant et sa trs faible ractivit.
2. Migration - vaporation - dissolution
Nous rapportons ici les caractristiques physiques mesurables (48-3)
susceptibles d'influencer la migration des solvants (viscosit et tension
superficielle), leur vaporation (temprature d'bullition, pression de
vapeur, chaleur latente de vaporisation) et les interactions spcifiques
responsables de la dissolution (constante dilectrique, moment dipolaire,
indice de rfraction). La j ustification de ce choix a t donne plus
haut.
1 Solvant
PENETRATION (3) VOLATILITE - RETENTION INTERACTIONS SPECIFIQUES
visco- T. Superf. T0bull. P. vap. L.vap. Cte di- moment 20
sit dyn/cm 760 mm mm Hg cal/g lectr. dipo- n
D
cP. 2 0 C 2 0 C Hg 20 C laire
- (debyes)
n-hexane 0,30 18 , 8 68,6 120 82 1,9 0,0 1, 3750
cyclohexane 0,88 25,6 80,7 77 86 2,0 0,0 1 ,4263
mthylcy-
clohexane 0,65 24,6 100,9 40 77 2, 1 0,3 1 , 4235
n-heptane 0,37 2 1, 2 98,2 36 76 1, 9 7 0,0 1 , 3877
n-octane 12 5 , 6 JO 71
isooctane 0,45 19,2 99,3
n-decane .173, 7 2,7 60 0,0 J , 4]20
n-dodecane 1 , 39 26 2 16 0, 0 J ,40
ther de { 40 -
ptrole 0, 48 19 ,9 60
white- 150 -
spirit 0,89 2 5, 4 { 195
Les hydrocarbures saturs aliphatiques se classent parmi les subs
tances trs peu pntrantes ; les hydrocarbures alicycliques le sont
lgrement plus.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
6J.
b) EvaE.oration
La phase I, qui correspond l'vaporation du solvant rest la
surface du corps poreux, est infrieure 15 min. pour les hydrocar
bures saturs jusqu' 8 atomes de carbone (isoocta.n e). La rtention
est faible pendant la phase II, de l'ordre de .! 2 %. Le white
spirit, cependant, le solvant le moins volatil test de cette srie,
n'est compltement vapor qu'au bout de 7 jours.
c) Dissolution_-_interactions_sE.cifiques
Les molcules d'hydrocarbures saturs n'ont pas de moment dipolaire
permanent et une constante dilectrique trs faible. Le groupement
mthyle peut fonctionner comme donneur d'lectrons, mais l'effet est
courte distance (2 3 C). C'est ce qui fait que les drivs iso
et tertio- sont lgrement plus polaires que les chanes linaires.
On peut de toute manire les ranger parmi les solvants NON IONISANTS
et NON DISSOCIANTS. Ils n'ont aucun effet solvant sur les lectroly
tes potentiels (sels, acides, bases).
Ils sont APOLAIRES, trs peu POLARISABLES et APROTIQUES. Ils n'
changent pas facilement d'lectrons : ils sont NON COORDINANTS.
En rsum, ces composs sont remarquablement inertes. On les uti
lisera comme diluants.
3. Toxicit
Ces composs sont peu toxiques. A forte dose, ils peuvent tre
irritants pour les voies respiratores et mme narcotiques. Comme ils
sont bons solvants des graisses, il faut viter le contact cutan pro
long. Nous donnons ci-aprs les "Concentrations perrnissibles maximales"
ou MAC, c'est--dire la concentration moyenne du solvant dans l'air am
biant applicable pour une exposition rpte (8h/jour - 5jours/semaine)
pendant toute une vie professionnelle et ne produisant pas d'effet no
cif, et qu'il ne faut pas dpasser (51).
Solvant HAC en ppm (52)
n-hexane !OO
heptane 500
cyclohexane 300
mthylcyclohexane 500
octane 500
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
62.
4. Utilisation
Les hydrocarbures aliphatiques dissolvent bien les composs qui
contiennent comme eux des chanes hydrocarbones. C'est le cas des ma
tires grasses : graisses, huiles, cires , paraffines, bitumes, caoutchouc
naturel, .
Etant bons s olvants des graisses, ils peuvent servir au nettoyage
sec des textiles. Nous utilisons le white-spirit pour nettoyer des
textiles dont les teintures ne rsistent pas l'eau ou dont les fibres
sont trop endommages pour que l'on puisse risquer de les soumettre au
gonflement rsultant de l'humidification.
Remarquons que les solvants techniques tels que le white-spirit,
la ligroine, les naphtes, . contiennent une proportion variable d'un
autre type de composs, les aromatiques, qui influencent fortement le
pouvoir solvant.
II . H YDROCARBURES NON SATURES ETHYLENIQUES
Ce chapitre sera bref vu les inconvnients prsents par ces com
poss, qui les rendent peu recommandables en conservation.
1. Nomenclature et exemples
Les hydrocarbures non saturs thylniques contiennent une ou plu
sieurs liaisons C = C. Ils sont en chane ouverte (alcnes) ou cyclique
( cycloalcnes).
Quand deux doubles liaisons C = C ne sont spares que par une
seule liaison simple C - C, on dit que les doubles liaisons sont CONJU
GUEES (c).
CH2
/ \
CH2 = CH2 CH CH2 CH2 CH - CH CH2
Il 1
CH CH C H
C H 2 4 6
2 4 /
CH C H 2n-2
2 n
CH
n 2n
C
6 0
H
l
thylne 1,3-butadine
C H
n 2n-2
(a) (c)
cyclohexne
(b)
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
63.
Ces doubles liaisons les rendent trs sensibles aux ractions
d'oxydation et de polymrisation qui donnent naissance des produits
colors et insolubles.
On trouve ce genre de composs dans la trbenthine (2-pinne (d),
terpinnes a et S (e) , dipentne (f) ) et dans l'essence d'aspic.
CH3 CH CH3 CH
3 2
2-pinne a terpinne dipentne = dl limonne
(d) (e) (f)
2. Migration - vaporation - dissolution
Malgr leur bon pouvoir solvant, notamment sur les rsines natu
relles, il vaut mieux proscrire ces substances pour le nettoyage des
obj ets d' art.
Les ractions d'oxydation et de polymrisation forment des composs
bruntres et insolubles qui restent pigs dans les corps poreux.
La trbenthine stagne plusieurs mois dans les milieux poreux ; elle
peut provoquer des ramollissements dsastreux dans les peintures jeunes.
3. Toxicit (5 1)
Ces composs sont des dprimants du systme nerveux central, des
anesthsiques et des irritants des muqueuses (pneumonie) et de la peau.
L'essence de trbenthine peut causer une inflammation des reins.
Solvants MAC (ppm)
essence de trbenthine 100
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
64.
III. HYDROCARBURES AROMATIQUES
1. Nomenclature et exemples
Ces composs non saturs sont caractriss par la prsence d'lec
trons (47) dlocaliss sur toute la molcule. On les reprsente souvent
par la vieille formule de Kekul (a), bien qu'elle ne traduise pas la
ralit.
CH
/
CH CH
Il I
CH
' CH
CH
benzne tolune ortho- meta- para-
xy 1 n e
(a) (b) (c)
cumne cymne
(d) (e)
2. Migration - vaporation - dissolution
1
PENETRATION VOLATILITE - RETENTION i INTERACTIONS $PECIFIQUES
visco- rsuperf. T bull. 0
P.vap. L. vap. Cte moment
sit dyn/cm 760 nnn mm Hg 20
cal/g dilec- dipo- n
cP 20 C 20 C Hg o
trique laire
{debyes)
benzne 0,60 29,6 80, 1 ) 0 0 (26 C) 94,3 2, 3 0,0 1,5014
tolune 0,54 29, 1 I JO, 6 2 0 ( 18,4 OC) 86 2, 4 0,4 1,4969
o -xylne 144,4 5(20,2 C) 82,9 2,4 0,6 2 1, 5029
m-xylne 139, 1 5 ( 16, 8 C) 81 , 8 1,4945
p-xylne 0 ,5 7 28,6 1 38 , 3 5 ( 1 5, 5 OC) 8 1, 0 0,0 1,4932
cumne _o , 86 28,7 152 , 4 5(26 , 8 C) 2,3 1, 4947
cymne 1 , 00 176,7 5(44,6 C) 2, 25 1,4947
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
65.
a) Migration
Vu leur viscosit faible et leur tension superficielle assez le
ve, les solvants aromatiques sont PENETRANTS.
b) Evaeoration
Les solvants aromatiques utiliss en conservation s'vaporent ra
pidement et ils sont peu retenus dans les couches picturales. Dans
nos essais sur prouvettes de peinture, le benzne est compltement
limin aprs 8 minutes, le tolune aprs 100 minutes, le paraxylne
aprs 1 jour, le cumne aprs 3 jours.
c) Dissolution
Avec leur constante dilectrique basse et leur faible moment dipo
laire, les interactions des hydrocarbures aromatiques avec le solut
sont relativement faibles. Elles rsultent essentiellement de la
polarisabilit des molcules : forces d'induction et de dispersion.
Ils sont NON (peu) IONISANTS, NON DISSOCIANTS, APOLAIRES, TRES POLA
RISABLES, DISPERSIFS.
Au point de vue des changes d'lectrons, ils peuvent fonctionner
comme donneurs d'lectrons 1T , ce sont des BASES MOLLES et ils peuvent
donc aussi intervenir dans des liens d'hydrogne conuue capteurs de
protons.
3. Toxicit
Les hydrocarbures aromatiques exercent une action dprimante sur le
systme nerveux central. Ce sont des irritants pour la peau et les
muqueuses. Le benzne attaque la molle osseuse. Il faut viter son
emploi.
Solvant MAC (ppm)
benzne 6
tolune 200
xylne 200
curnne 50
4. Utilisation
Les solvants aromatiques dissolvent trs bien les huiles, les
graisses et les cires, les paraffines, crsines, bitumes, etc. comme
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
66.
les hydrocarbures saturs.
Grce notamment leur bonne po1arisabilit, ils dissolvent en
outre une autre srie de composs comme certaines rsines naturelles
fraches (colophane, damar, lmi, mastic) . Le cumne, ou p m
-thyl iso
propylbenzne a t propos comme substitut de la trbenthine. Ces sol
vants diss olvent aussi la plupart des rsines synthtiques.
IV. HYDROCARBURES HALOGENES
!. Nomenclature et exemples
Fanai les drivs halognes (fluor, chlore, brome, iode) des hydro
carbures, seuls les chlorures s ont des solvants couramment utiliss en
conservation.
dichloromthane chloroforme ttrachlorure de 1 , 2-dichlorothane
carbone
(a) (b) ( c) (d)
CHCl = CC1
2
1 , 1, 1-trichlorothane trichlorothylne perchlorothylne
(chlorothne) (TRI) (PER)
(e) . ( f) (g)
Cl
monochlorobenzne
(h)
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
67.
2. Migration - vaporation - dissolution
PENETRATION !VOLATILITE - RETENTION INTERACT. SPECIFIQUES
visco- T"superf. Tbull. P.vap. L.vap. Cte di- Moment
Solvants
si t dyn/cm 760 mm mm Hg cal/g lectr. dipo- 20
cP 20 C 20C Hg 20 C laire n
D
debyes
dichloro- 0,40 29,5 40,7 349 78,74 9, 14 1,54 1, 4244
mthane
chloroforme 0,51 28,2 61,3 159 , 6 59 4,90 1, 1 1, 4467
1, 2-dichlo- 0 , 75 33,2 83, 7 60 77, 3 JO , 5 1, 75 1, 4451
rothane ( 18 C)
ttrachlo- 0,97 27,6 76, 7 91 46,5 2,24 o,o 1,4630
rure de C
1 , 1, 1-tri-
chloro- 0, 76 26,7 74, 1 100 54,2 1,4376
thane
perchloro- 0,83 32,2 120 , 8 20 50, 1 2,20 1,5035
thylne (26 C)
chloro- 0, 72 33,7 131,8 8, 76 77, 6 5,5 3 1,55 I , 5250
benzne
Les hydrocarbures halogns sont des solvants trs MOBILES. Ils
pntrent facilement dans les corps poreux mais en ressortent aussi
aisment.
Except pour le chlorobenzne, la phase I est infrieure 15 min.
pour tous les solvants repris au tableau. La phase II est galement
courte. Parmi les solvants chlors tudis, c'est le chlorobenzne
qui reste le plus longuement dans la peinture : un jour.
c) Dissolution
-
Les 1 .1a1sons
C-C 1 sont susceptibles de s'1on1ser en c - c1 vu
0+
l'lectrongativit du chlore. Dans certaines molcules trs sym
triques, ces dipoles s'annulent (ttrachlorure, trans-dichlorothane).
Les halognures non symtriques peuvent nanmoins fonctionner comme
donneurs d'lectrons.
Les halognures saturs sont PEU IONISANTS, NON DISSOCIANTS (le
dichloromthane et le 1, 2-dichloromthane le sont plus que les autres),
apolaires pour les symtriques et PEU POLAIRES pour les autres, PEU
POLARISABLES, Certains peuvent former des faibles liaisons d'hydrogne
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
68.
1 +
Cl C-H O. Ils peuvent aussi tre accepteurs de H . Le ttrachlo-
2
rure et le 1 ,2-dichlorothane sont NON COORDINANTS.
Les halognures aromatiques sont TRES POLARISABLES.
3. Toxicit
Ces solvants sont dangereux pour le foie, les reins et le systme
nerveux central. Vu leur action dgraissante, il faut aussi viter le
contact cutan.
Solvant MAC ppm
dichloromthane 500
chloroforme 50
ttrachlorure de C 10
1,2-dichlorothane 50
1 , 1, 1-trichlorothane 350
1, 1, 2-trichlorothylne 100
perchlorothylne 100
chlorobenzne 75
4. Utilisation
Les solvants chlors sont utiliss dans l'industrie pour leurs pro
prits so1vantes trs prononces pour les matires grasses (nettoyage
sec). Ils dissolvent certaines rsines naturelles, surtout les molles,
mais plus difficilement les copals durs, la sandarac, la shella, etc.
V . ALCOOLS
1. Nomenclature et exemples (18, 49, 50)
Les ALCOOLS sont des drivs comportant un ou plusieurs (POLYOLS)
groupements HYDROXYLES, OH ports par un carbone satur.
On distingue les alcools PRIMAIRES, R C-H20H,SECONDAIRES, R-CHOH-R'
et TERTIAIRES, R-COH-R'.
R"
CH CH2 0H
3
mthanol thanol propanol
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
69.
butanol isobutanol
CH -CH-CH -CH -OH
3 I 2 2
alcool amylique CH
3
alcool isoamylique alcool benzylique
R-CHOH-R':
butanol
secondaire
is opropanol
OH H
OH
(quatorial-axial)
R-COH-R' : OH O H
I li ? 3
CH -C-CH -C-CH CH -C-OH
3 I 2 3 1 3
CH CH
3 3
diactone alcool tertiobutanol
C'est l'thanol (de l'arabe alkohol : matire subtile) qui a donn
son nom la fonction. Ses solutions aqueuses provenant de ractions de
fermentation sont connues depuis la plus haute antiquit.
Etant donn sa grande affinit pour l'eau, l'alcool anhydre ncessite
une prparation spciale. Les solutions que l'on achte dans le com
merce contiennent environ 5 % d'eau (alcool 95 %) . Il est dnatur par
addition d'ther pour le rendre impropre la consommation.
: Quand le groupement hydroxyle est port par un carbone thylni
que, le driv est appel ENOL, R-CH =CHOH. Ce sont des drivs insta
2
bles qui se transforment en drivs carbonyls.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
70.
Il
CH =CHOH CH3 -C-H
2
alcool vinylique actaldhyde
Quand l'hydroxyde est attach un cycle aromatique, le compos est
un PHENOL.
OH
OH
phnol t><. naphtol fl naphtol
Ces composs sont des solides temprature ordinaire . Ils sont
trs rpandus dans la nature (protines, tanins, colorants, etc.)
2. Migration - vaporation - dissolution
PENETRATION (3) VOLATILITE - RETENTION INTERACTIONS SPECIFIQUES
SOLVANTS visco- T. To moment
superf. bul l . P vap. L. Cte 20
sit nun Hg vap. dilec- dipo- n
cP.20 C dyn/cm 760 nun
20 c cal/g trique
laire D
20 c Hg debyes
mthanol 0, 52 23, 8 65 100 262, 8 31, 2 1, 65 1, 3285
thanol 1, 0 8 22, 9 78 40 204,3 25, 7 1,7 1, 3611
n-propa-
nol 2, 25 24, 2 97 20(25 C) 163 20, 1 1,7 1,3 853
isopro-
panol 2,22 21, 7 82 33 159, 4 18, 3 1,7 1, 3771
butanol 2, 96 25,1 118 4,3 9 143, 3 17,1 1, 7 1,3992
isobuta-
nol 3,94 23, 3 108 10(21 , 9 C) 138, 8 17,9 1,7 1,3962
butanol
sec. 3,63 23, 9 100 12,1 l, 3 949(dl)
tertiobu-
tanol 5, 37 20, 8 83 30, 6 134, 4 12, 2 1, 7 1,3847
ale. amy-
li que 3 , 50 25, 8 138 2, 8 136 5, 1 1,4100
ale. isoa
mylique 4, 65 24, 2 132 2,3 120, 6 14,7 1,7 1,4075
cyclo-
hexanol 56, 2(48) 34, 2 161 1 105, 4 15 1, 7 1,465
ale. ben-
zylique 6, 3 9 41, 1 205 108 13 1, 7 1, 5395
diactone
alcool 3,01 31,4 167 4 111 2, 5 1, 4242
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
71.
Les alcools aliphatiques prsentent des tensions superficielles
comparables, mais une viscosit croissante avec la longueur de l a
chane carbone. Leur pouvoir de pntration diminue donc avec l'aug
mentation du poids molculaire (29) . Le diactone alcool peut tre
considr comme fort pntrant.
b) olatilit_-_rtention
Dans l' ensemble, la phase I est rapide (entre 30 minutes et 4 heu
res ) , sauf pour le diactone alcool et le cyclohexanol.
La rtention pendant la phase II est la moins leve pour l ' thanol,
suivi dans l'ordre du propanol, du butanol, du mthanol et de l'iso
propanol. Les quantits retenues s ont infrieures 3 %. La dure de
l'vaporation est de quelques j ours, sauf pour le diactone alcool o
selon nos mesures, elle s'tale sur plus de 20 jours.
Les alcools prsentent de fortes interactions intermolculaires qui
se traduisent par des chaleurs latentes de vaporisation leves et des
pressions de vapeur s aturantes faibles. A poids molculaire compara
ble, ils s ont donc beaucoup moins volatils que les hydrocarbures ali
phatiques correspondants et mme que les drivs halogns. Le mtha
nol, en particulier, prsente une trs haute chaleur latente de vapo
risation. Sa rtention est leve.
c) Dissolution
Le groupement hydroxyle 0-H s e caractrise surtout par sa capacit
de former des liens d'hydrogne. Les alcools peuvent fonctionner la
fois comme donneurs de protons, mais aussi comme accepteurs, grce aux
deux paires d'lectrons non-liants de l'oxygne (lectrons n) :
C O - H
Ils sont de ce fait IONISANTS, COORDINANTS et PROTIQUES. Ils sont ga
lement DISSOCIANTS vu leur constante dilectrique leve, le mthanol
prsentant la valeur la plus leve.
Ils sont PEU POLARISABLES d ' aprs leur indice de rfraction, sauf
videmment dans le cas de l'alcool benzylique o la proximit du cycle
joue son rle.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
72.
3 . Toxicit (51)
Bien que les alcools soient dans l ' ensemble peu dangereux, i l faut
se rappeler que le mthanol peut provoquer, surtout par ingestion, des
troubles digestifs, mtaboliques, neuropsychiques et oculaires. Le cy
clohexanol a une action narcotique. Il affecte le foie, les reins et le
systme vasculaire. L ' alcool isoamylique a des vapeurs toxiques dont
l'inhalation prolonge conduit au coma.
Solvant M . A. C . e n ppm (52)
mthanol 200
thanol 1000
isopropanol 400
propanol 200
n-butanol 100
cyclohexanol 50
4 . Utilisation
Les alcools faible poids molculaire ne sont pas miscibles dans
les hydrocarbures aliphatiques, avec lesquels ils ont fort peu d'interac
tion possible.
Par contre, grce leurs caractres coordinant et protique, ils se
rangent parmi les solvants les plus utiliss en conservation. Ils dissol
vent les rsines naturelles y compris la sandarac, les copals, la shellac,
etc. Ils sont donc fort utiles pour l'limination des vernis. L'alcool
n-butylique est utilis dans de nombreuses formules industrielles de pein
tures, vernis et dcapants, mais il est relativement toxique.
L'alcool benzylique est un solvant de la glatine et, chaud, de
la casine.
Le diactone alcool dissout les huiles, graisses, cires et rsines
naturelles. Son action et sa rtention le rangent parmi les "dcapants"
(cf. p. 107 ).
Le phnol dilu dans l'eau ( 3 : 1 ) est utilis comme luant dans la
sparation des acides amins, pour l'analyse des protines ( 55).
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
73.
Vbis . GLYCOLS - POLYOLS
1. Nomenclature - exemples
Des solvants industriels importants comportent plusieurs fonctions
hydroxyles : ce sont notamment des drivs de l'thylneglycol.
0
Il
CH 0H-CH 0H CH -C-0-CH -CH OH
2 2 3 2 2
thylneglycol (E.G.) E . G . monoactate
glycrine
0 0
Il Il
CH OH-CH -O-CH -CH CH -C-0- (CH ) -0-C- CH
2 2 2 3 3 2 2 3
E . G . monothylther E . G . diactate
"cellosolve"
0
Il
CH -CH -0-(CH ) -0-C- CH
3 2 2 2 3
actate de cellosolve E.G. thoxythylactate
CH OH-CH -0- CH CH OH-CH -0-CH -CH OH
2 2 3 2 2 2 2
mthylcellosolve dithylneglycol
CH -CH -0-CH -CH -0-CH -CH OH
3 2 2 2 2 2
dithylneglycolmonothylther
= "carbitol"
0
Il
CH -C-0-CH -CH -0-CH CH -CHOH- CH 0H
3 2 2 3 3 2
actate de mthylcellosolve propylneglycol
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
74.
2. Migration - vaporation - dissolution
PENETRATION l VOLATILITE-RETENTION INTERACTIONS SPEC IFIQUES
T. To moment
SOLVANTS P vap. L. Cte 20
viscosit superf bull. dipo-
nnn Hg vap. dilec- n
(48) cP dyn/cm 760 mm laire D
(3) 20 c cal/g triqu e debyes
Hg
thylne-
glycol
(E.G.) 21 49,8 197 1 (54 C) 191 38, 66 2,0 1, 4318
di E.G. 38 45, 7 245, 5 1 (92 C) 150 2,3 1 , 4472
tri E.G. 47,8 45,2 287 0, 1 (83 C) 179 3,0 1 , 4568
E.G. ac-
tate 182
cello-
solve 2 , 05 32 13 5 3,8 1, 406
actate
de cel-
losolve 1, 2 31,8 156 1, 2 1,4030
carbitol 3, 85(25 C ) 35, 5 196 1 (45 C) 96, 3 1,4273
Vu leur forte tension superficielle, les glycols prsentent une im
portante pntration capillaire, tempre nanmoins pour les composs
haut poids molculaire par une grande viscosit.
b) Volatilit - rtention
La volatilit trs faible de ces composs et leur rtention leve
les rangent parmi les solvants les plus dangereux du point de vue de
leur utilisation sur les objets d'art. Leur emploi est d'autant plus
prilleux que leur pouvoir solvant est trs efficace. Une fois appli
qus sur une peinture par exemple, ils vont poursuivre insidieusement
pendant plusieurs mois leur action ramollissante sur les liants, les
colorants, les vernis. En outre, tant donn leur forte hygroscopici
t (l'thylneglycol peut fixer jusqu' deux fois son poids en eau),
ils vont fixer l'humidit ambiante, ce qui est dangereux pour les
liants et vernis et favorise la croissance de moisissures.
Nous dconseillons donc formellement leur utilisation sur des corps
poreux.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
75.
c ) Dissolution
Les proprits sont celles des alcools : POLAIRES, IONISANTS, COOR
DINANTS, PROTIQUES, DISSOCIANTS et moyennement POLARISABLES. Leurs
interactions spcifiques nombreuses et diverses les rangent parmi les
DECAPANTS.
3. Toxicit
Vu leur faible volatilit, ils ne prsentent de rels dngers que
par ingestion (reins, oedme pulmonaire, . .. ). La dose lthale d 'thyl
neglycol pour l'homme est de 1 , 4 ml/kg.
Solvant MAC (ppm)
cellosolve 200
actate de cellosolve 100
mthylcellosolve 25
actate de mthylcellosolve 25
L'thylneglyco-lmthylther (mthylcellosolve) a provoqu de graves
intoxications dans l'industrie (anmie, retardation mentale, etc , ) .
4. Utilisation
Ces alcools sont miscibles en toute proportion avec l 'eau. On peut
aisment les mlanger aux autres alcools, aux ctones, mais ps ou trs
difficilement aux hydrocarbures saturs et aromatiques, et leurs drivs
halogns.
Les glycols sont utiliss comme antigels et conrrne agents humidi
fiants. L ' i ndustrie des peintures et des matires plastiques les utili
sent comme solvants. Ils entrent notamment dans la composition des en
cres ' imprimerie et pour stylos bille. Ils dissolvent les huiles, la
plupart des rsines naturelles et synthtiques, la casine, les dextri
nes, la glatine, etc. Rptons que, malgr leur intressant pouvoir
solvant, il vat mieux les viter en conservation car ils sont fortement
retenus dans les corps poreux.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
76.
VI. ETHERS - OXYDES
1 . . Nomenclature - exemples
Les thers-oxydes sont des composs de formule
R-0-R'
qui rsultent de l'union de deux alcools avec limination d'une molcule
d'eau. Les alcools peuvent tre identiques (ETHERS SIMPLES) ou diff
rents (ETHERS MIXTES).
Les thers subissent une autoxydation plus rapide la lumire qu'
l ' obscurit. Il se forme le plus souvent des peroxydes instables (explo
sion possible) qui se dcomposent spontanment en acides, alcools et
thers ; leur hydrolyse donne de l'eau oxygne, des aldhydes et des al
cools. Ces produits oxydants peuvent tre dangereux pour les liants,
vernis, pigments, colorants, fibres, etc. Il est donc prudent de s 'assu
rer de l'abs ence de peroxydes dans les solvants thers que l'on utilise.
Ils ragissent avec les drivs chlors qui changent leur chlore
contre des radicaux varis. La raction peut tre violente.
0
ther thylique ther isopropylique
- 0-CH -CH
2 3
ph netole
11
mthylphnylther thylphnylther 11
0
/ / ""'
r2
r2 ,H 2 r2
CH --- CH CH CH
2 2 2 2
""' 0 /
ttrahydrofurane dioxane
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
77.
N.B. Nous avons dcrit les thers de glycols sous la rubrique "glycols
polyols", vu leurs proprits trs comparables.
z. Migration - vaporation - dissolution
PENETRATION VOLATILITE-RETENTION INTERACTIONS SPECIFIQUES
T. To moment
vis co P vap . L. Cte
superf. bull. dipo
l si t nnn Hg vap. dilec
dyn/cm 76 0 mm laire
j CP 20 C 20 c cal/g trique
20 c Hg debyes
ther - J
thylique 1 0,24 18,6 34, 6 400(18 C) 86 , 0 8 4, 4 1,25 1,3526
! t.isopro-J r
! pylique 0, 3 8 18,3 1 6 8 , 4 ; 200(30 C) 6 8 1, 3 1,3679
l t.nbuti-
lique 1, 6 22, 9(48) ! 142, 4 ' 68, 8 1,2 1,3992
t. isoamy- 1
1
1
1f 1ique 24, 8(48) 173 , 4 ; l(l8 C) 6 5 , 9 3,14
1
1 ttrahydro
i furane 0,51 28, 2 66 76(25 C ) 7,58 1,7 1, 4050
! dioxane 1 , 15 33, 7 101,3 40(25 C) 9 8 , 6 2, 23 0, 4 1 , 4224
t.mthyl
phnyl 155, 4 1 , 27 1,5179
t.thyl-
phnyl 170 1,0 1, 5076
Malgr leur faible viscosit, les thers aliphatiques sont peu p
ntrants, car leur vaporation est trop rapide. Par contre, le ttra
hydrofurane, un ther cyclique, peut tre considr connne fort pn
trant .
b) Evaeoration
La phase I prdomine chez les thers dithyliques et diisopropyli
ques. C'est le dernier qui prsente l'vaporation la plus rapide (en
viron 10 minutes ) . Le ttrahydrofurane est retenu prs de 14 jours.
Les thers aliphatiques de faible poids molculaire sont beaucoup
elus volatils que les alcools correspondants, car les OH responsables
des fortes interactions par liens H n'y sont plus prsents.
c) Dissolution
------ -----
Les thers contiennent des oxygnes porteurs d'lectrons n non
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
78.
liants
..
C-0-C. Ils peuvent donc fonctionner comme donneurs d'lectrons.
Ils sont ds lors IONISANTS, COORDINANTS et accepteurs de protons.
Ils sont PEU DISSOCIANTS vu leur faible constante dilectrique (con
trairement aux alcools correspondants) et aussi moins POLAIRES que les
alcools. Le moment dipolaire varie avec l'angle C-0-C et aussi cause
de l ' effet des dipoles induits dans les CH qui s'opposent au dipol
3
coc (49,58).
Le caractre donneur d ' lectrons (donc la basicit selon Lewis) va
rie selon la disponibilit du doublet d'lectrons port par l 'oxygne .
Des tudes par spectromtrie infrarouge ont montr que les thers de
phnols sont moins basiques que les thers aliphatiques et que les
thers cycliques ( ttrahydrofurane) sont plus basiques que les thers
"ouverts". Dans les thers acycliques, l'ordre de basicit dcrois
sante gnralement trouv est
3. Toxicit
L'ther thylique est connu pour ses proprits anesthsiques. Les
thers en gnral exercent une action irritante sur les voies respiratoi
res, les yeux, la peau et les muqueuse s . Le dioxane et le ttrahydrofu
rane peuvent en outre attaquer le foie et les reins.
Solvant MAC (ppm)
thylther 400
diisopropylther 500
dioxane 50
ttrahydrofurane 200
4 . Utilisation
Les thers aliphatiques sont de trs bons solvants des huiles,
graisses et cires. L'ther isopropylique peut tre utilis pour l ' limi
nation de la cire d ' abeille superflue aprs une fixation.
En les mlangeant des hydrocarbures aromatiques, on obtient de
bons solvants pour rsines naturelles non vieillies (cf. triangle de so
lubilit).
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
79.
Le dioxane est utilis comme solvant des rsines cellulosiques (ac
tate, thyl-benzyl) . Il dissout aussi certains colorants et des composs
inorganiques. Le ttrahydrofurane est souvent utilis pour dissoudre des
hauts polymres et en particulier le chlorure de polyvinyle.
VII . CETONES
1. Nomenclature - exemples
O)
Les ctones contiennent le groupement CARBONYLE (C=
0
Il
R-C-R'
0 0
Il Il
CH -C-CH CH -C-CH -CH
3 3 3 2 3
actone mthylthylactone
O CH.
Il / 3
CH -C-CH -CH
3 2
,
CH3
mthylisopropylctone mthylisobutylctone
O CH
Il / 3
CH3-C-CH=C
\
CH
actylactone 3
ou 2, 4-pentanedione oxyde de msityle
0 0
li Il
CH -C-CH -CH -CH CH -CH -C-CH -CH
3 2 2 3 3 2 2 3
2-pentanone 3-pentanone
mthylpropylctone
'
Il
c
0 CH
Il / 3 CH
CH -C-CH-C-OCH Il
3 '\ 3
CH 3 C--CH
3
/
CH
pentoxone 2
cyclohexanone isophorone
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
Bo.
2. Migration - vaporation - dissolution
PENETRATION VOLATILITE-RETENTION INTERACTIONS SPECIFIQUES
Solvants v1.sco- T. To moment
sit P vap. L. Cte 20
su- bull. dipo-
mm Hg vap. dilec- n
cP perf. 760 mm !aire D
2 0 c cal/g trique
(3) Hg
actone
(3)
0,31 24,9 56, 2 185 125,3 21,45
debyes
2,7 1, 3588
-
mthylthyl 0,36 25,2 79, 5 1 0 0 (25 C) 106 25,45 2,7 1,3785
mthyliso-
propyl 89 2 0 (18 C) 89,9 2,7 1,3878
mthyl n-
butyl 0,63 127 10 83 12 2,7 1,4024
mthyliso-
butyl 0,53 24,3 116 15 87 13, 11 2,7 1 , 3958
mthylamyl 0,81 150 3 83 1,410
acthylac-
tone 0,66 31,3 ' 140,5 1, 4512
cyclohexa-
none 2,10 34, 8 159 5 (26 C) 98 18, 2 0 2,7 1, 4500
oxyde de
msityle 0,88 2 9, 2 129 8, 7 86 15 1 , 444
: 2-pentanone 0,46 24,9 102 10(17, 9 C) 91 1 , 3895
3-pentnone 0,45 25,4 101,5 30 91 15 1,3905
pentoxone 159 2,6 79 1, 4181
isophorone 2 , 62 31,7 215 0,3 1
Vu leur faible viscosit et leur tension superficielle moyenne, les
ctones sont dans l'ensemble pntrantes.
b) Volatifit_-_rtention
Dans l'ensemble des ctones tudies, la phase I de l'vaporation
est rapide (moins d'une demi - heure). La quantit de rtention au
cours de la phase II est faible (moins de 3 %) et la dure est courte,
4 jours pour la mthyl-isobutylctone qui est une ctone peu volatile.
c) Dissolution
La liaison carbonyle C = 0 forme un dipole du fait de l'lectron
gativit de l'oxygne, les lectrons 1T de la double liaison sont plus
attirs sur l'oxygne que sur le carbone :
+ S-
' C O
/
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
81.
Par ailleurs, l ' o xygne porte deux paires d ' lectrons non liants :
il peut fonctionner comme donneur d'lectrons n . Les ctones sont donc
DIPOLAIRES 1 IONISANTES, DISSOCIANTES , COORDINANTES, ACCEPTEURS de PRO
TONS et, ainsi que l'indiquent les indices de rfraction, PEU POLARI-
SABLES.
3. Toxicit
Comme elles sont trs odorantes, il y a peu d'intoxication car on
les dtecte rapidement. Elles peuvent provoquer des troubles digestifs,
des irritations (yeux, voies respiratoires, peau) et une action narcotique.
Solvant MAC (ppm)
actone 1000
mthylthylctone 200
mthyl- n-propyl 200
mthyl-n-butyl 100
mthylisobutyl 100
isophorone 5
cyclohexanone 50
1-mthylcyclohexanone 50
4. Utilisation
Les ctones figurent parmi les solvants les plus utiliss indus
triellement. Elles sont de bons solvants des matires grasses, huiles,
cires . . . , de certaines rsines naturelles (pas la shellac) , de nombreux
polymres synthtiques (actate de cellulose, thylcellulose, P . V . A., m
thyl mtacrylate .. . ) et de colorants (encres ) .
La mthylthylctone est fort utilise pour la fabrication de colle
base de caoutchouc nitrile et noprne, pour les nitrocelluloses et les
rsines vinyliques . Nous l'utilisons de prfrence l'actone (cf. cha
pitre III) car elle produit moins de blanchiment. La cyclohexanone entre
dans la formulation de nombreux solvants pour peinture, vernis et encres.
Sa toxicit rend son utilisation peu recommandable.
L'isophorone est un trs bon solvant de nombreuses rsines naturel-
les et synthtiques mais v u le sys tme Il
c- c = c,
elle est trs sensible l'oxydation et jaunit rapidement . I l vaut donc
mieux l'viter en conservation. On peut faire la mme remarque pour
l'oxyde de msityle. L ' actylactone a aussi tendance jaunir.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
82.
Le pentoxone est trs utilis dans l ' industrie des peintures car i l
permet d'obtenir des mlanges peu visqueux e t peu volatils l a fois.
V I I I . ESTERS
1 . Nomenclature - exemples
Les esters rsultent d'une raction entre un alcool et un acide avec
limination d'eau. Ils rpondent la formule gnrale :
R-C-0-R'
Il
0
0 0
Il Il
H-C-OCH -CH 3 CH3-C-OCH3
2
formiate d'thyle actate de mthyle
" 0
CH -C-0-CH -CH
0
Il
CH -C-0-CH -CH2-CH2 -CH3
3 2 3 3 2
actate d'thyle actate de butyJe
O CH 0
11 / 3 Il
CH3 -C-0-CH -cH2-c CH -CHOH-C-0-CH2-CH3
2 3
CH3
lactate d'thyle
actate d'isoamyle thyl-2-hydroxypropanoate
L'actate d ' amyle commercial est un mlange d ' isomres dont le plus im
portant est l ' a ctate d'isoamyle.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
83.
2. Migration - vaporation - dissolution (3, 48, 56)
PENETRATION VOLATILITE - RETENTION INTERACTIONS SPECIFIQUE:
T. To moment
SOLVANTS vise. P vap. L. Cte 20
superf. bull. dipo-
cP m m Hg vap. dilec- n
dyn/cm 760 mm laire o
20 C 20 c cal/g trique
20 C Hg debyes
formiate
d'thyle 0, 3 6 24,5 54,3 200 97 9,1 1, 9 1,3597
formiate
d'amyle 0,8 25 123,5 7, 7 1, 9 1, 398
actate de
mthyle 0,35 25, 7 57, 8 200(24 C) 104,4 7,3 1, 7 1, 3593
actate
d'thyle 0, 41 24, 7 77, 1 l00(27 C) 87, 6 6, 4 1,8 1, 3725
actate de
propyle 0, 58 24, 6 101, 6 20(16 C) 80 8, 1 1,9 1, 384
actate d'iso
propyle 0,46 22, 9 88, 8 40(l 7 C) 79,4 1, 9 1, 3772
actate de
butyle 0,64 25, 7 126, 5 10 73, 9 5, 1 1,3951
actate
d'amyle 0,87 25,8 142, 1 69 4,81 1,8 1,4005
propionate
de butyle 146,5 1, 9 1,401
propionate
d'amyle 0,94 1 60 63 4, 25 1,406
lactate
d'thyle 2, 6 30 154, 5 1, 8 1, 9 1,4118
malonate
d'thyle 198-199 1,4143
Vu leur tension superficielle moyenne (environ 25 dyn/cm) et leur
faible viscosit, les esters ont une capacit de pntration dans les
corps poreux assez comparable celle des ctones.
b) EvaEoratio!!
La phase I est infrieure 10 minutes pour le formiate d'thyle et
les actate de mthyle, thyle et isopropyle. Elle reste en de
d'une heure pbur l'actate de butyle et de 4 heures pour l'actate d ' a
myle. La rtention pendant la phase II est fajble (1 2 %). La du
re de cette phase II est gnralement courte (de 30 minutes quel
ques heures). Signalons nanmoins deux solvants esters qui sont rete
nus plus longtemps : l'actate d'amyle (environ 4 j ours) et le malona
te d'thyle (plusieurs mois ) .
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
84.
c) Diss olution
Les es ters sont des solvants assez inertes. Ils sont PEU DISSO
CIANTS, PEU IONISANTS , PEU POLARISABLES. Ils possdent des-paires d '
lectrons non liants sur les atomes d ' oxygne , mais il faut tenir comp
te d ' une certaine dlocalisation des lectrons l ' intrieur du groupe.
S
\.:X:r:_.s....
Il
R - C - 0 - R
Ils peuvent fonctionner connue accepteurs de protons.
3. Toxicit
A forte concentration, les esters prsentent une action anesthsique.
L'actate de mthyle libre du mthanol dans l'organisme.
Dans l 'ensemble, la plupart des es ters aliphatiques et aromatiques
utiliss dans l'industrie sont peu toxiques.
Solvant MAC (ppm)
formiate de mthyle 100
formiate d'thyle 100
actate de mthyle 200
acftate d'thyle 400
actate de propyle 200
actate de butyle 200
actate d ' amyle 100
4. Utilisation
Les esters constituent une importante catgorie de s olvants pour
l'industrie des peintures, des encres, en parfumerie et cosmtologie, en
pharmacie . . . Ils ont t les premiers solvants des rsines nitrocellu
losiques et ils sont d'excellents solvants pour un grand nombre de rsi
nes naturelles et synthtiques non vieillies .
Les actates sont les plus utiliss, surtout l ' actate d'thyle que
l'on additionne s ouvent de l'alcool, par exemple pour dissoudre l'ac
tate de cellulose (5 30 %) et les rsines naturelles.
Les propionates prsentent une volatilit plus faible que celle des
actates et un pouvoir s olvant lgrement infrieur . Ils peuvent tre
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
85 .
utiles pour fabriquer des vernis qui doivent scher en atmosphre humide,
car ils vitent la condensation d'eau qui accompagne un schage trop ra
pide.
IX. ACIDES CARBOXYLIQUES
1. Nomenclature et exemples
Les acides carboxyliques contiennent le groupement CARBOXYLE
0
Il
R - C - OH
0
Il Il
HC-OH CH -C-OH
3
acide formique acide actique
2. Migration - vaporation - dissolution
PENETRATION VOLATILITE-RETENTION INTERACTIONS SPECIFIQUES
T. To P. moment
SOLVANTS vise. L. Cte 20
superf bull. vap. dipo- n
cP vap. dilec- laire
dyn/cm 760 mm mm Hg D
20 C
cal/g trique
20 C Hg 20 c debves
acide formique 1,8 37, 6 100, 7 40 1, 3714
acide actique 1,22 27,8 118, 2 11, 7 97,1 6, 4 1, 5 1, 37 18
L'acide formique et l'acide actique sont fortement pntrants .
b) Evaporation
L'vaporation est trs lente ds le dbut ; il n'y a pratiquement
pas de phase I. La rtention est trs leve, ce qui range ces compo
ss parmi les additifs dangereux n'utiliser qu'en faible quantit.
Dans nos expriences, l'chantillon trait n'tait pas encore revenu
son poids initial avant dpt de l'acide, mme aprs 9 mois d'attente.
La diffrence de poids (environ 0,02 %) pourrait tre due la forma
tion de formiates et d'actates (sels ou esters).
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
86.
-----------
c) Dissolution
Les acides carboxyliques font, comme leur nom l 'indique, partie de
la catgorie des acides. Il est utile de rappeler en quelques mots la
signification de ce terme.
L' eau pure H o contient une trs petite proportion d'ions -forms
2
par dissociation selon l ' quation :
que l'on crit d'habitude
o H+, l'ion hydrogne s'appelle aussi PROTON. Conune au total l ' eau
pure est neutre, la quantit d ' ions positifs est gale la quantit
d'ions ngatifs. A la temprature de 25 C, leur concenration est de
14
l0- ions g/1.
On peut montrer que dans toute solution aqueuse dilue,
le produit des concentrations des ions H+ et OH- est constant et gal
10- 1 .i ions g / 1 .
14
10- ions g/1
Quand on introduit un acide, par exemple de l'acide actique, il se
dissocie en partie et i l ajoute des ions H+ dans l 'eau
Le nombre d'ion OH- dans l'eau doit donc diminuer pour que le pro
duit (oH- ) x LH+) reste gal 10 14 ions g/ 1 . La solution devient ACIDE.
Pour la facilit, on a convenu d'une chelle plus pratique, l ' ai
de des valeurs du pH (Srensen) .
1
pH log
10
De O 6, les solutions sont acides, neutres pour le pH 7 et basi
ques entre les pH 8 14.
La force d'un acide est lie son degr de dissociation dans l'eau
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
87.
et on la caractrise par la constante d'quilibre de la raction de
dissociation temprature constante
(H+) x (A-)
Ka constante de dissociation
AH)
1
p Ka log , Ka -log Ka
o
Quand l'acide est faible, il est peu diss oci et Ka est petit.
Constantes de dissociation Ka (25 C) (46)
.
Solvant acide formique acide actique
eau 1, 76. 10" 4 1, 75. 10-5
eau 90 % + mthanol 10 % 1,25.10-5
eau 80 % + mthanol 20 % 8, 34. 10 -6
benzne trop petit pour
tre mesur
L'acide formique est donc plus fort que l'acide actique, ce qui
est sans doute d en partie l'effet inductif du groupe CH .
3
Dans d'autres solvants que l'eau, la dissociation dpendra de la
basicit du solvant (cf. tableau ) .
Cette basicit peut tre envisage selon la dfinition de Bronsted,
selon laquelle LES BASES SONT DES ACCEPTEURS DE PROTONS ou de Lewis :
LES BASES SONT DES DONNEURS D'ELECTRONS. Pour les ACIDES, la dfini
tion de Bronsted les dcrit comme DONNEURS de PROTONS et celle de
Lewis comme ACCEPTEURS D'ELECTRONS.
Les acides carboxyliques peuvent prsenter une structure dipolaire
par dlocalisation des lectrons :
b
(?: f':r
li
R - C - OH
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
88.
Ils sont PROTIQUES mais aussi accepteurs de protons. Ils se trou
vent d'ailleurs d'habitude sous forme dimre :
O...H - 0
h \
R - C C - R
\
0 - H... O
En conclusion, les acides carboxyliques sont IONISANTS, DIPOLAIRES,
PEU POLARISABLES, PROTIQUES.
3. Toxicit
L'acide formique est un puissant irritant de la peau et des muqueu
ses. L ' acide actique produit des irritations cutanes, oculaires, des
muqueuses respiratoires et l ' rosion des dents. D'habitude, . le dsagr
ment par irritation oculaire sert d ' avertissement avant d ' atteindre des do
ses vraiment dangereuses.
Acide MAC (ppm)
acide formique 5
acide actique 10
4. Utilisation
L'addition d'acides carboxyliques est efficace quand on cherche
liminer des couches base de protines ou de calcaire (cf. cnapitre III ) .
L'acide actique trs dilu est ajout la colle animale pour en
amliorer la pntration lors de la fixation. Classiquement, on prpare
la colle en laissant gonfler 750 g de colle animale dans 1500 ml de vinai
gre conunercial pendant un an dans une cave obscure. Aprs ce dlai, le
pH de la solution est de 4, ce qui correspond une viscosit faible de
la glatine (min. pH 5 ) . Par ailleurs, l'acide actique forme avec
l'eau un azotrope (30 % acide actique + 97 % eau) plus bas point d'
bullition que les deux constituants, 76, 6 C, ce qui est favorable pour
le schage.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
89 .
X . AMINES
1. Nomenclature - exemples
Le groupe AMINES est constitu d'un atome d'azote portant deux ato
mes d'hydrogne NH , AMINES PRIMAIRES, un atome d'hydrogne NH, AMINES
2
/ Rl
SECONDAIRES ou trois radicaux hydrocarbons N - R , AMINES TERTIAIRES.
\ 2
R3
thylnediamine dithylamine trithylamine
n -butylamine
n-amylamine tertiobutylamine
NH 2
"" CH "'
0
/
CH2 CH2 CH
2 2
1 1 1 1
CH CH
CH
2
"- CH2
/
CH
2 2
""' N
2
cyclohexylamine morpholine pyridine
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
90.
2. Migration - vaporation - dissolution
PENETRATION VOLATILITE-RETENTION INTERACTIONS- SPECIFIQUES
T. To moment
vise. P vap- . L. Cte 20
superf bull. dipo-
cP mm Hg vap. dilec- n
dyn/cm 760 nun laire D
20 C 20 C cal/g trique debye
20 C Hg s
thylne-
diamine 116-117 1,4540
trithylamine 89-90 1,4003
n - butylamine 78 1,3 1 , 4010
tertiobuty-
lamine 46,4 0,7 1,37
n-amylamine 1 , 018 24,4 104 35(26 C) 108 1,3 1 , 4068
cyclohexy la-
mine 134,5 1 , 4565
morpholine 2,23 37,5 129 1,58 1,4540
pyridine 0,97 38 115 , 5 20(20 C) 2,2 1 , 5102
Nous manquons de donnes pour les amines aliphatiques , car leur ef
fet corrosif aurait endorrnnag nos appareils de mesur e .
L'amylamine es t moyennement pntrante. La morpholine et la pyridi
ne sont trs fortement pntrantes.
b) Evaporation
Les amines s'vaporent trs lentement, mme celles dont la tempra
ture d'bullition est basse (tertiobutylamine : 4 6 , 4 C ) . La rtention
est trs leve (plus de 10 % pendant plus d'un mois pour la n-butyla
mine). Il faut aussi tenir compte de la fixation d'eau due leur for
te HYGROSCOPICIT . L'ammoniaque (6N) prsente une rtention moindre
(moins de 3 % aprs 15 heure s ) .
c) Diss olution
Les amines sont des bases. Les amines primaires sont mme des bases
plus fortes que l'arranoniaque . Comme pour les acides, l a force d'une
base est lie son degr de dissociation dans l'eau et on la caract
rise par la constante d'quilibre de la raction de dissociation tem
prature ordinaire :
R - NH + H O -" R-NH+ + OH-
2 2 .....- 3
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
91.
-
(R-NH;l, (OH )
K' -log
b p
(RN H ) . (H o)
2 2
La dissociation d ' une ami.ne dans un autre solvant que l ' eau se fait
aussi en empruntant un proton au solvant.
La basicit est d'autant plus forte que le est grand ou le p
petit
Base ( 5 7 ) (25 C) p
NH 0H
4 1 , 79 K 10 -5 4,75
mthylamine 4, 34 ,,. 10-4 3,36
dimthylamine 5,20 10-4 3,28
trimthylamine 5,45 .. 10 -5 4,26
thylamine 5 , 6 K 10-4 3,25
dithylamine 3,65 )( 10-s 7,4 4
trithy lamine 5,63 )( 10-4 3,24
n-butylamine 4,09 x 10-4 3,39
isobutylamine 3, 1 )(. 10-4 3, 5 1
sec-butylamine 3 , 6 Ji. 10-4 3,44
ter-butylamine 2 , 8 X 10-4 3,55
aniline 3, 82 ,r. 10-10 9 , 42
pyridine 1,71 )( 10-9 8, 7 7 ( 20 C)
morpholine 9,61
Les amines aromatiques sont des bases beaucoup plus faibles que les
aliphatiques, car l a paire d ' lectrons libres de l ' azote est dlocali
se dans le cycle aromatique.
Les amines peuvent servir de capteurs de protons dans les liens
d ' hydrogne grce leur paire d ' lectrons non lis, mais les amines
primaires et secondaires peuvent aussi donner des protons et agir connue
des solvants PROTIQUES. Pour ces dernires, il y a AUTOASSOCIATION.
H
R - N/
' H
H :
,.
N - R
H/
Il y aura association des amines avec tout solvant donneur de pro-
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
92.
tons (alcools) ou capteur de protons (ctones) .
Les amines sont donc IONISANTES, PEU POLAIRES, PEU DISSOCIANTES,
moyennement POLARISABLES et DISPERSIVES, COORDINANTES (donneurs n ) .
Les amines primaires e t secondaires sont PROTIQUES.
3. Toxicit
Les vapeurs et les solutions ont une intense action irritante sur
la peau, les yeux, les voies respiratoires . Les amines aromatiques sont
cancrignes.
Solvant MAC (ppm)
aniline 5
dimthylamine (gaz) 10
thylamine 10
dithylamine 25
thylnediamine 10
cyclohexylamine 10
isopropylamine 5
butylamine 5
4. Utilisation
L'utilisation des amines est peu reconunandable en conservation.
Elles prsentent de nombreux dangers et pour les oeuvres et pour l' opra
teur : elles sont trs toxiques, pntrantes, corrosives et hygroscopiques.
Elles attaquent les huiles mme vieillies, les rsines terpniques et de
nombreux pigments et colorants.
Dans les cas de trs vieux surpeints huileux qui rsistent tous
les autres solvants, il faut parfois se rsoudre utiliser un solvant al
calin. Il est alors prfrable d'employer de l' ammoniaque, car i l est
moins basique et sa rtention est moindre.
La pyridine a t utilise (59) pour liminer des collages la
shellac sur des cramiques . La pyridine dissout en outre des colorants
dont l ' indigo et mme des composs inorganiques (ex. : carbonate de zinc).
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
93.
XI. AMIDES CARBOXYLIQUES
1. Nomenclature - exemples
Le remplacement du groupe OH d'un acide carboxylique par un atome
d'azote substitu forme le groupe AMIDE. Selon les substituants de l'a
zote, on distingue les amides PRIMAIRES,
H Il /H Il /Rl
0 0 0
Il
-C-N\/ -C-N -C-N,
Rl R
2
AMIDES PRIMAIRES SECONDAIRES TERTIAIRES
SECONDAIRES et TERTIAIRES. Les "acides amins", constituants de base des
protines, sont des amides. Les amides cycliques sont appeles LACTAMES.
11 / CH
0
Il 3
H-C-NH H-C-N
2
H
formamide N-mthylformamide dimthylformamide
0 0
H
o- CH
Il Il il 3
CH3 -C-NH2 CH -C-N/ CH -C-N /
3 3
'\ CH3 '- CH3
actamide (solide) N-mthylactamide dimthylactamide
CH
3
1
CH
/
N
" C=O
2
1 1
CH CH
2 2
N-mthylpyrrolidone ure
(lactame)
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
94.
2. Migration - vaporation - dissolution
PENETRATION VOLATILITE-RETENTION INTERACTIONS SPECIFIQUES
p vap.
T. To moment
vise . L. Cte 20
superf bull. dipo-
20 C mm vap. dilec- n
20 C 760nun laire D
cP(57) Hg cal/g trique
dvn/cm Hg debves
formamide 3,30 58, 35 210 109,5 3, 71 1,4475
N-mthylfor-
mamide 180,5 182,4 3, 8 1,4310
dimthylfor-
mamide 0,80 37,9 153 3,7 36,7 3, 8 1, 4269
N -mthylac-
tamide 202,4 175, 7 4, 3 1,4277
dimthylac-
tamide 0,92 38,1 165,5 3, 8 1,4356
N m- thylpyr-
rolidone 42,9 204 33 4, 1 1, 4666
Parmi tous les solvants utiliss en conservation, les amides se
classent parmi les plus pntrants .
b ) Evaporation
Les amides primaires et N-monosubstitus tant fortement autoasso
cis sont peu volatils ( c f . interactions spcifiques ou dissolution).
La formamide ne prsente pratiquement pas de phase 1 . Son vapora
tion est trs lente ds le dbut et sa rtention trs leve. Ce sol
vant est donc trs dangereux et il vaudrait mieux l ' viter sur des c o u
ches picturales.
Le dimthylformamide est galement peu volatil, mais la rtention
diminue notablement aprs quelques heures.
c) Diss olution
Les amides prsentent des constantes dilectriques trs leves :
ils sont donc TRES DISSOCIANTS. Leur moment dipolaire les range aussi
parmi les composs TRES POLAIRES. Ils sont en outre POLARISABLE S .
:o:
11 .. H(R)
H - C - N/
(R) \. H(R)
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
95.
L'oxygne porte deux paires d'lectrons non liants, l'azote, une
paire. Ils peuvent donc jouer le rle de BASE (selon Lewis) = ce sont
des solvants COORDINANTS. L'association amide - acide se fait surtout
sur l'oxygne (60). La basicit des amides dpend de leur substitu
tion.
0 0
" li
H-C-NH2 est moins basique que CH -c-NH , vu l'effet inductif du
3 2
groupe CH . En solution aqueuse, les amides sont d'ailleurs pratique
3
ment neutres, car il y a dlocalisation des lectrons non liants de
l'azote :
C.r
CH -C-NH CH -C /
0
f-
3
u
2 3 \.. s.
NH 2
L'orbitale basique de l'azote est conjugue avec l'orbitale 1r du
groupe caboxyle, ce qui provoque la rigidit du lien "peptidique"
CO-NH et une basicit infrieure celle des amines.
Les amides comportant un atome d'hydrogne sur l'azote sont des sol
vants AMPHOTERES, ils peuvent fonctionner soit comme acides, soit comme
bases (formamide, N-mthylformamide, N-mthylactamide, actamide)
0 0
1( H fi +
R -C-N/ + AH R -C -NH +
'R ! 2
R
0
"> R-C-N-
li
+ B + BH +
R
Les amides peuvent, par ailleurs, s e comporter comme capteurs de pro
tons vu leurs paires d'lectrons libres et, ceux qui prsentent des hy
drognes sur l'azote peuvent en outre tre PROTIQUES (amides primaires
et N-monosubs titues).
Ici aussi, les donnes de la littrature plaident en faveur de la
fixation du proton sur l'oxygne plutt que sur l'azote. Les amides
primaires et N-monosubstitues peuvent s'auto-associer.
1
,O. . . . HN,
R-C ,; ,rC-R
,
NH. . . 0
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
96.
Cette auto-association joue un rle considrable dans les proprits
des protines et des polyamides synthtiques (nylon) .
Quand on mlange ces amides avec un autre solvant, accepteurs de pro
tons, il faut qu'ils soient trs basiques pour rompre cette auto-asso
ciation et la concentration de l'amide doit tre trs faible. Par con
tre, si le solvant est donneur de protons, la rupture de l' auto-associa
tion est plus frquemment observe.
Les lactames (ex. 2-pyrrolidone) forment des auto-associations trs
stables quand les cycles sont petits (forme cis). La protonation se
fait aussi sur l ' oxygne.
Si on veut mlanger un amide avec un autre solvant pour le nettoyage
d'oeuvres d ' art, on aura donc intrt viter des solvants protiques
(ex. alcools) car ils entreraient en comptition pour l ' association
avec le substrat dissoudre, ce qui diminuerait l'efficacit de la so
lubilisation.
3. Toxicit
La formamide est un irritant modr de la peau et des muqueuses.
L ' exposition prolonge au DMF peut provoquer des troubles digestifs,
de l'insomnie, de l'intolrance l ' alcool, des irritations cutanes .
Solvant MAC (ppm)
dimthylformamide 20
dimthylactamide 10
actamide cancrigne
4. Utilisation
Etant donn leur fort pouvoir pntrant et leurs multiples interac
tions spcifiques possibles, les amides sont des solvants extrmement ef
ficaces ranger dans la catgorie des dcapants, car ils ramollissent les
huiles mme aprs vieillissement prolong. Leur utilisation est donc
exclure pour nettoyer des tableaux rcents jusqu'au XVIIIe sicle compris.
La formamide dissout la casine, le glucose, les tannins, l'amidon,
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
97.
l a lignine, mais aussi des sels inorganiques, chlorures de cuivre, zinc,
tain, cobalt, fer, aluminium, nickel, les actates de mtaux alcalins et
quelques sulfates et nitrates . On l'emploie comme plastifiant des papiers,
colles animales et vgtales.
La dimthylformamide est parfois appele le "solvant universel orga
nique". Il dissout un grand nombre de rsines naturelles, y compris la
shellac et les copals, et ramollit les huiles mmes trs ges. Il faut
y faire appel pour liminer la plupart des vieux surpeints l'huile. Il
est recommand de l ' additionner d'un solvant plus volatil mais non proti
que counne le tolune, un solvant chlor ou l'actate d'thyle.
Le dimthylactamide peut servir de solvant lectrolytique non a-
queux.
L'ure est utilise pour ass ouplir la cellulose dans l'indus trie des
papiers, grce notamment son fort pouvoir capteur de protons.
X I I . NITR I L E S
1 . Nomenclature - exemples
Les nitriles sont des composs contenant le groupement CYANO
C :: N
actonitrile benzonitrile
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
98.
2. Migration - vaporation - dissolution
PENETRATION VOLATILITE-RETENTION INTERACTIONS SPECIFIQUES
visco- To moment
T. P vap. L. Cte 20
sit bull. dipo-
superf mm Hg vap. dilec- laire n
cP 760 lllil1 D
(3) 20 C cal/g trique debyes-
(3) Hg
actonitrile 0,32 30, 2 81, 6 60(l6 C) 174 37, 5 3, 5 1, 3442
benzonitrile 190,7 25,2 3, 9 1,5289
L'actonitrile se range parmi les solvants TRES PENETRANTS.
b) Evaeoration
L' actonitrile s ' vapore rapidement ( 1 heure environ) et ne prsente
pratiquement pas de phase II, donc trs peu de rtention
c) Dissolution
Les nitriles sont TRES DISSOCIANTS, DIPOLAIRES e t les drivs aroma
tiques sont POLARISABLES.
En outre, vu la prsence de l'atome d'azote qui possde une paire
d ' lectrons non liants, ils sont BASIQUES selon la dfinition de Lewis,
mais la basicit est fortement diminue par la proximit de la triple
liaison : le est trop faible pour tre mesur.
Ils sont APROTIQUES mais peuvent accepter un proton.
3 . Toxicit
Ces composs, si intressants du point de vue des solvants, sont mal
heureusement trs toxiques. Ils peuvent pntrer dans l ' organisme par in
halation, ingestion et par la peau. L'intoxication se manifeste par des
nauses, astnie, difficults respiratoires et l ' issue peut tre mortelle.
Solvant MAC (ppm)
actoni trile 20
Il est donc dconseill de les utiliser sans absolue ncessit.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
99.
4. Utilisation
L'actonitrile dissout un grand nombre de composs organiques
(graisses, huiles, goudrons, stroides colorants . . ) et inorganiques
(nitrate d'argent, bromure de magnsium . . . ) .
X I II. DERIVES N I TRO-
1. Nomenclature - exemples
On distingue quatre types de composs
les NITRATES , les NITRITES , les drivs NITRO- et NITROSO
R-0-NO R-0-NO R-NO -O
R N
2 2
Pour ce qui est des solvants, seuls les drivs nitro- prsentent de
l'intrt :
nitrom thane nitrothane
CH -CH-CH
3 1 3
N02
1-nitropropane 2-nitropropane
nitrobenzne
6= essence de "MIRBANE"
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
100.
2. Migration - vaporation - dissolution
PENETRATION VOLATILITE - RETENTION INTERACTIONS SPECIFIQUES
T. To P. moment
SOLVANT visco- L. Cte 20
. superf bull. vap. dipo-
sit vap. dilec. laire n
dyn/cm 760 rran mm Hg D
cP cal/g 2 5 c debyes. _
2 0 C Hg 2 0 C
nitro-
mthane 0,62 37 101, 1 27,8 38, 6 3, 1 1,3935
nitro-
thane 0, 66 31 114, 0 15, 6 1,3916
1-nitro-
propane 30(56) 131, 6 7, 5 1 0 , 3 7 (25 C) 3 , 19 1, 4015
2-nitro-
propane 30(56) 120,3 12,9 9,88(25 C) 3,7 1,3941
nitro-
benzne 2 , 03 210, 8 34,8 4, 0 1,5525
Les drivs nitro- sont TRES PENETRANTS.
b) Evap_oration
Nous n'avons pas jusqu' prsent ralis de mesures pour ces compo
ss.
X
c ) Dissolution
1
Les drivs NITRO- sont DISSOCIANTS et POLAIRES. Les aromatiques
sont trs POLARISABLES.
L'lectrongativit des deux oxygnes donne au lien hydrogne-carbo
ne adjacent un caractre acide : (50)
6.10 10 - 1 1
3. Toxicit
La toxicit des drivs nitro- augmente avec le poids molculaire.
Ils peuvent provoquer des chutes de . tension, des nauses , des cphales
et dans les cas les plus graves de la mthmoglobinmie.
Le nitrobenzne est particulirement toxique.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
101.
Etant donn ces dangers, il est recommand d 1 viter si possible l'u
sage de ces solvants.
Solvant MAC (ppm)
nitromthane 100
nitrothane 100
1-nitropropane 25
2-nitropropane carcinogne
nitrobenzne 1
nitrotolune 5
4. Utilisation
Malgr leur toxicit, les nitroparaffines sont u tilises dans l'in
dustrie, souvent en mlange avec des ctones ou des alcools.
Ils dissolvent les matires grasses, certains colorants et plusieurs
rsines synthtiques (poxy, polyurthanes, nitrocellulose - certaines r
sines acryliques et vinyliques). L'emploi de nitroparaffine avec des pig
ments au plomb ou avec des amines prsente des dangers d ' explosion.
XIV. COMP O S E S DU S O UF R E
1 . Nomenclature - exemples
Certains composs du soufre prsentent un intrt connne solvants
0 0
Il Il
R S- -R' R-S-R' R-S-R'
Il
0
SULFURES SULFON ES SULFOXYDES
Il
CH -S-CH
3 3
sulfure de carbone dimthylsulfoxyde
ttramthylnesulfone - sulfolanne
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
102.
2 . Migration - vaporation - dissolution
PENETRATION VOLATILITE - RETENTION INTERACTIONS SPECIFIQUES
...
T. To L. moment
viscosit Cte 20
superf bull. P . vap. vap. dipo-
cP dilec- n
dyn/cm 760 nun nun Hg mm Hg laire D
20 c trique
debyes
20 C H!!
cs 2 0,36 29,8 46,2 400(28 C) 84 2,6 0,0 1,6255
dimthyl
sulfoxy- 2,1 45,1 189 0,4 162 48,9 3,9 1,4783
de DMS
sulfo- l0,3(30 C) 283 44 4, 8 1,4817
lanne
Etant donn sa visc.osit moyenne et sa tension superficielle trs
leve, le DMS se situe parmi les solvants les plus pntrants cits dans
le prsent travail.
b) Evaporation
Le di mthylsulfoxyde se range parmi les solvants rtention leve
et de longue dure (cf. p. 107 ) .
c) Dissolution
Les sulfones et sulfoxydes sont TRES POLAIRES et TRES DISSOCIANTS .
La contribution des formes dipolaires (Ib) et (Ilb) est importante (50)
:o:
Il
R-S-R
Cf
R - S-R
+
la lb
:O: :0:
Il 1
R-,S -;-R -E---,,- R-s +R
11 I_
:Q: :o:
IIa Ilb
Les paires d'lectrons non liants prsents sur les atomes d'oxygne
et de soufre en font des BASES selon Lewis et des capteurs de protons.
Ces solvants sont fortement hygroscopiques .
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
103.
3. Toxicit
Le DMSO peut provoquer des urtiquaires, des nauses, mais sa toxici
t est limite.
Le sulfure de carbone par contre, vu sa volatilit, provoque des
nauses, narcoses, troubles psychiques, troubles de la vision, perte du
dsir sexuel, coma
Solvant MAC (ppm)
10
4 . Utilisation
Etant donn leur forte constante dilectrique, les sulfones sont u
tiliss connne fluides dilectriques pour condensateurs.
Ils entrent dans la composition de certains dcapants. Ils servent
de solvants dans des encres, dtergents, bactricides, insecticides et a
gents tannants .
Le DMS forme des complexes avec les mtaux.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
104.
C H A P I T R E I I .I
AP P L I CAT 1 0 N S
I . CRITERES DE SELECT I O N D E S SOLVANTS
1. L' objet d ' art
Le respect de l'objet d'art est videmment le premier critre de
toute intervention. Vu le risque que prsente tout nettoyage, il ne peut
tre entrepris que sur justification taye tant du point de vue esthti
que que matriel. I l est indispensable de procder des tests prlimi
naires permettant de garantir l'inocuit de l ' opration. Pour plus de s
curit, nous excluons d'office les solvants qui pourraient prsenter des
dangers pour l'objet, non seulement dans l ' innndiat mais aussi longue
chance. C'est ainsi que nous avons renonc uti lisr les solvants
trs forte et longue rtention (glycols, formamide, trbenthine, butyla
mine ... ) sur des corps poreux.
Les solvants instables. la lumire et qui ont tendance jaunir ou
polymriser sont galement limins (composs thylniques connne le di
pentne, la trbenthine, actylactone, N-mthyl-pyrrolidone . . . ) . Ces
rgles sont applicables tout objet poreux, peintures, sculptures poly
chromes, peintures murales, etc. Dans. le domaine des textiles, le sol
vant le plus ad.quat est l'eau. Nanmoins certaines fibres trs altres
ou de mauvais colorants n'y rsistent pas. Il faut alors recourir des
solvants organiques mais en vitant les solvants chlors vu une ventuel
le acidit due au dgagement d'acide chlorhydrique.
Les solvants base d'eau doivent tre utiliss avec une extrme pru
dence, car de nombreux matriaux peuvent tre endommags.
2. L'oprateur
La plupart des solvants prsentent divers degrs une toxicit qui
exige certaines prcautions.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
105.
Il est raisonnable d'exclure d'office certains produits vraiment
dangereux comme le benzne (MAC 6), la butylamine (MAC 5), le cs 2 (MAC 10),
les drivs nitro- et nitrile, le ttrachlorure de carbone (MAC 10), l'i
sophorone (MAC 10) . (cf. chapitre II).
On vitera autant que possible le contact cutan prolong (usage de
btonnets ou de gants) et on veillera assurer une bonne aration des lo
caux. Dans les cas o l'on doit utiliser de grandes quantits de s olvants,
par exemple pour le traitement de grandes surfaces, il est ncessaire
d'interrompre rgulirement le travail pour permettre aux oprateurs de
renouveler l'air de leurs poumons !
Le port du masque est parfois recommand, soit pour des personnes
trs sensibles, soit dans le cas o il faut utiliser d'une manire prolon
ge des solvants dangereux : mthanol, solvants chlors , solvants aromati
ques.
3. Le but
Dans le cas des peintures et des sculptures polychromes, les princi
pales applications des solvants sont :
a) le nettoyage de souillures superficielles,
b) l'limination d'un verni s ,
c ) l'limination d'un surpeint.
Les solvants sont utiliss aussi pour dissoudre des colles destines des
imprgnations, des fixages de ?oulvements, des collages, etc. Dans ces
trois derniers cas , le s olvant vhicule un solut dont les proprits con
tribuent largement aux caractristiques de migration et de volatilit.
Selon les cas, on aura intrt choisir des solvants action su
perficie lle (nettoyage des souillures) ou plus profonde (enlvement des
surpeints). La nature des matriaux liminer conditionnera aussi la s
lection des solvants prsentant les interactions spcifiques les plus fa
vorables.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
Pntration des solvants dans les corps poreux
Tension LES PLUS PENETRANTS
superF.
dyn./cm AMINES
AMIDES
ac. Formique
35 -- - ---- ----- - -- - - - - -- - - -- - --- -
HYOROC.
CHLORES
diactoneal cool
30
AROMATIQUES
CETONES
25
ESTERS
mthanol croissant --
------ - - - - - -thanol
- - - - ------- --
HYOROC .
20 SATURES
ETHERS
.PENETRANTS
15
l 2 3 Viscosit cP
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
107.
I I . CLASSEMENT DES SOLVANTS
1. Pouvoir de pntration - rtention
Nous avons dcrit au chapitre I les principaux phnomnes responsa
bles de la pntration des liquides dans les corps poreux.
Nous avons expriment qu'un classement des capacits de pntra
tion pouvait tre tabli avec une bonne approximation pour les solvants
utiliss en conservation en se basant sur deux grandeurs physiques mesura
bles : la viscosit et la tension superficielle.
Ainsi que le montre le tableau ci-aprs, nous pouvons classer en
premire approximation les amines, les amides, l ' acide formique parmi les
solvants les plus pntrants, les hydrocarbures chlors et aromatiques
parmi les pntrants forts , les esters, les ctones et les alcools parmi
les pntrants moyens et les hydrocarbures saturs et les thers de petit
P . M. parmi les s olvants les moins pntrants .
Le pouvoir de pntration d'un solvant doit tre considr en mme
temps que l a dure et la quantit de s a rtention dans le corps poreux
( c f . p . 37) .
Les solvants les plus dangereux pour les matriaux pict9raux origi
naux s ont viderranent ceux qui tant trs pntrants prsentent aussi une
forte et longue rtention.
Catgorie I : trs pntrants - rtention leve et longue
"DECAPANTS" trbenthine, THF, glycols , diactonealcool,
formamide,. OMS , butylamine 7 t-butylamine,
DMF, acide formique, acide actique.
Catgorie II pntrants moyens - rtention moyenne
solvants "MOYENS" ctones, alcools, esters, eau.
Catgorie III : trs pntrants - rtention faible et courte
s o lvants "MOBILES" drivs halogns , aromatiques.
Catgorie IV peu pntrants - rtntion faible et courte
solvants "VOLATILS" hydrocarbures satures, thers de petit P.M.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
108.
Pour viter des interactions incontrlables et dont la probabilit
augmente avec la dure de sjour, il est conseiller d ' viter autant que
possible l ' utilisation des solvants rtention trs leve et de longue
dure.
Dans le cas o l ' on ne peut viter l'emploi de solvants rtention
forte (enlvement de certains surpeints), il est prudent de les - doser le
plus parcimonieusement possible et d ' essuyer soigneusement l ' e xcdent avec
plusieurs tampons d'ouate sche (comme pour un polissage). Il n'est pas
mauvais de complter ce traitement par l'emploi d ' un sche-cheveux. Il
souvent illusoire en effet de recourir des "rinages". Cela ne fait
qu' augmenter la quantit des solvants qui pntrent dans les couches po
reuses et qui devra ensuite en ressortir.
Nanmoins, si la couche est trop ramollie pour pouvoir utiliser de
l'ouate sche, on peut ventuellement recourir aux solvants rtention
faible (cf. p. 37). Attention dans ce cas, aux risques de blanchiment et
vrifier auparavant avec le triangle de solubilit (cf. p . 4 7 ) si le m
lange ainsi form est bien inoffensif.
Par ailleurs, il nous semble dangereux de gnraliser la mthode du
"Re-forming". Elle est particulirement prilleuse quand on la pratique
avec des "dcapants" comme le diactonealcool et l ' actate de cellos olve
(62, 63, 64) ou la dimthylformamide (67). Mme avec des solvants moins
dangereux, cette mthode augmente anormalement la quantit de matire
trangre introduite dans la peinture. Il serait prudent, selon nous, de
rserver ce traitement des cas bien particuliers o les mthodes classi
ques ont chou et aprs avoir soigneusement test l' inocuit du procd
pour la couche originale (s urtout sur les glacis ) .
Les solvants rtention moyenne forment la majorit et seront donc
choisis de prfrence. Ils conviennent d ' ailleurs la plupart des trai
tements, vu leur grande diversit.
Les solvants rtention faible peuvent jouer un rle trs utile
dans les mlanges .
Signalons pour terminer qu'il est toujours prudent d ' attendre au
moins deux mois avant de vernir un tableau. En cas de dlai plus court,
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
109.
il est prfrable de recourir au pistolet, de manire obtenir une couche
moins continue permettant encore l'vaporation des ventuels solvants r
siduels.
2. Interactions spcifiques
Ainsi que nous l'avons vu au chapitre I (III. DISSOLUTION) , la solu
bilit d ' une substance A dans un solvant B est lie aux interactions sp
cifiques qui peuvent s ' tablir entre A et B.
Rappelons que les principales forces d'interaction sont :
a ) les FORCES D'ORIENTATION, entre molcules qui, par suite d'une distri
bution non symtrique des charges lectriques, prsentent un MOMENT
DIPOLAIRE ;
b ) les FORCES INDUITES entre molcules dipolaires et non dipolaires. La
POLARISABILITE de la molcule sans dipole permanent favorise la forma
tion du dipole induit ;
c) les FORCES DE DISPERSION entre molcules non dipolaires
d) les FORCES DE LIAISON HYDROGENE, ou mise en commun d ' un atome d'hydro
gne entre un donneur de proton et un capteur de proton portant une
paire d'lectrons libres
e) les FORCES COULOMBIENNES entre ions. Les solvants qui parviennent
surmonter ces puissantes forces d'interaction sont dits "dissociants"
f) les FORCES DE TRANSFERT DE CHARGE entre un donneur et un accepteur d'
lectrons. Ces solvants sont dits "coordinants" car i l forment des li
aisons de coordination avec le solut. Connne c'est le pouvoir donneur
d ' lectrons qui dtermine l'aptitude ioniser les composs dissouts,
ils sont aussi souvent "ionisants".
Le tableau ci-aprs dtaille pour chaque famille de solvants, les
interactions spcifiques possibles (a, b, c, d, e, f) et les substances
qu ' ils sont ainsi susceptibles de dissoudre.
Solvants Interactions Soluts
paraffines, graisses, cires,
hydrocarbures (c) bitumes, color. carotnoides,
saturs caoutch. natur . , polycyclo
hexanone, butylmtacrylate
--------------------------------
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
110.
Solvants Interactions Soluts
idem (cf. + haut) + rsines
hydrocarbures (b) (c) ; natur. fraches (pas shellac,
aromatiques (d) (f) : peu copals, sandara c). La plupart
des rsines synthtiqu!S
------------------ -------------------------------
-
drivs (c) ;
(a) : peu idem (cf. + haut)
chlors
(b ) : arom.
(c) ; idem (cf. + haut)
esters (a) (b) (e) : trs peu
+ qq colorants.
(d) capt. H : peu
--------------------------------
(c) ( f ) ; idem (cf. + haut)
thers (d) capt. H pas les rsines synthtiques
(a) (e) : trs peu
--------------------------------
alcools :
mthanol ( c ) (d) (e) (f) idem (cf. + haut) + shellac,
thanol sandarac, copals frais, PVA,
autres idem cert. acryliques.
diactonealcool idem + (a)
--------------------------------
idem ( cf. + haut). Plupart des
(a ) (c) ,
rsines nat. et synth ._ (pas shel
ctones (d) capt. H
lac), colorants, encres, peint.
(e) (f)
l'huile rcentes.
glycols, polyols, (a) (b) (c) (d) (e) (f) dcapants trs dangereux :
thers et esters hygroscop. viter.
------------------ ------------------------ --------------------------------
(a) (b) (c) (d) dcapants : viter formamide,
amides DMF capt. H. viter sur des peintures r
(e) ( f ) centes y compris XIXe sicle.
amines dangereuses, toxiques , viter
(b ) (c ) ( d ) ( f )
huiles polym. shellac.
------------------ ------------------------ --------------------------------
acides carbox. (a) (d) (f) protines
Rappel (a) forces d 'orientation, (b ) forces induites, ( c ) forces de disper
sion, (d) liaison hydrogne, (e) forces coulombiennes, ( f ) forces de
transfert de charge.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
111.
3 . Utilisation pratique
Les problmes poss par les ateliers nous ont incits mettre au
point une mthode permettant un choix systmatique et rationnel des sol
vants.
Nous avons donc tabli une liste de solvants tester successivement
pour rpondre aux problmes les plus courants : nettoyage de souillures
superficielles, enlvement d ' un vernis rsineux, dcapage d'un surpeint.
Les solvants sont utiliss purs ou en mlange volontairement simples,
deux composs ou au maximum trois composs. I l est en effet erron de
croire que les actions des constituants s'additionnent en les mlangeant.
Elles peuvent tout aussi bien s ' annuler les unes les autres, ce qui con
trecarrie l'action dissolvante.
Par ailleurs, vu la complexit des mcanismes mis en jeu, i l est d
j trs difficile de prvoir l ' action de mlanges binaires. Au-del de
deux constituants, on perd rapidement toute possibilit de raisonnement.
Nanmoins, il nous est apparu par l'exprience qu'il tait avanta
geux de travailler avec des mlanges simples contenant un solvant "actif"
(catgorie I ou II) dilu dans un solvant "mobile" (catgorie III) ou "vo
latil" (catgorie IV). Ce type de mlange peut en effet tre aisment "a
just" chaque problme . Selon l'effet observ, on pourra augmenter ou
diminuer la concentration du solvant actif.
La liste que nous proposons ci-aprs n'a rien de dfinitif. Il ne
faut surtout pas la considrer comme la "solution miracle" tous les pro
b lmes de solvants en conservation. Il ne s'agit que d'une approche aussi
logique que possible et qui de fait s ' est avre efficace. Nanmoins, la
liste a t modifie de nombreuses fois au gr d ' expriences nouvelles e t
nous esprons bien pouvoir encore l' amliorer.
Elle permet de situer des points de repre mais chaque tableau, cha
que sculpture peut susciter des cueils particuliers. Il faut alors, au
dpart des tests, doser de nouveaux mlanges mieux adapts au problme.
Le chimiste pourra aider utilement le restaurateur dans ce choix.
On remarquera dans le tableau ci-aprs que nous n'utilisons pas
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
112.
Liste de s olvants-tests.
N.B. IV s olvant "VOLATIL", III solvant "MOBILE", II solvant "MOYEN", I "DECAPANT".
But N Solvants Proportions Catgories
1 isooctane pur IV
2 diis opropylther pur IV
nettoyage 3 white-spirit 16 % d'aromati- (IV-1II)
ques
superficiel 4 p-xylne pur III
5 p-xylne + trichloro
50 : 50 IV + III
------------------- --
thane
-------------
6 isooctane + isopro
limination d'un panol 50 : 50 IV + II
vernis rsineux 7 tolune + isopropanol 50 : 50 III + II
8 isooctane + ther +
thanol 80 : 10 : 20 IV + IV + II
9 " " fi
SS : 15 : 30 IV + IV + II
vernis rs ineux 10 actate d ' thyle +
en couches mthylthylctone 50 : 50 II + II
paisses 11 isopropanol + mthyl
------------------- -- isobutylctone 50 : 50 II + II
-------------
12 dichlor othane + m
thanol 50 : 50 III + II ( I )
13 tolune + DMF 75 : 25 III + I
14 trichlorothane + di
limination d'un actone alcool 75 : 25 . III + I
surpeint huileux 15 trichlorothane + DMF 50 : 50 III + I
16 actate d ' thyle + DMF 50 : 50 II + I
17 isopropanol + ammonia-
que + eau 90 : 10 : 10 II + I + II
18 " 50 : 25 : 25 Il + I + II
------------------- --
Il "
limination d ' une 19 dichloromthane + for-
colle ou d'un miate d'thyle + 50 : 50 : 2 III + I I + I
surpeint protique acide formique
20 tolune + isoprop + eau 50 : 65 : 15 III + II + II
limination d ' une
21 mthylthylctone+eau 25 : 75 II + II
colle ou d'un sur-
22 actate d'thyle + THF
peint polysac
+ eau 5 : 35 : 45 I I + I + II
charide ac. actique + eau 5 : 95 I + II
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
113.
d' actone . Nous avons constat que ce solvant provoque souvent des b l a n
chiments, peut-tre cause d e sa phase I trs rapide et nous lui prf
rons donc le mthylthylctone.
Notons galement que les solvants des vernis rsineux ont des f
d
(paramtre de solubilit pour les forces de dispersion) en accord avec la
valeur propose par Feller (42), f = 75 et celle des solvants de Ruheman
d
(69), f = 72.8 ! 1 2 . 6. Pour les vernis en couches paisses, les mlan
d
ges ont des valeurs f plus basses, environ 50.
d
Les tests se font en trois tapes :
1 ) Dpt d'une goutte de solvant l'aide d'un tube capillaire (diamtre
du dpt : environ 2 mm).
Observation au binoculaire la dissolution entrane la formation d'une
aurole.
2) Test l'aiguille sur l'endroit du dpt : on peut ainsi constater le
degr de ramollissement soit de la couche diss oudre, soit de la cou
che sous-jacente.
3) Essai au btonnet muni d ' un petit tampon d'ouate . On conserve le tam
pon de manire se rappeler le rsultat obtenu.
Il est bien entendu que ces tests doivent tre excuts des en
droits de l ' objet soigneusement choisis . Il faut que les rsultats soient
significatifs mais qu'ils ne mettent pas en danger l ' intgrit esthtique
de l'oeuvre.
Pour un tableau, par exemple, nous choisissons, sur les bords, une
plage claire (bleu du ciel), une plage rouge et une plage sombre (bruns ).
La plage claire permet de bien discerner l'action diss olvante grce au
contraste ; les rouges et les bruns doivent ensuite tre tests, car bien
souvent ils sont moins rsis tants aux solvants . La couleur des tampons
doit tre soigneusement observe pour vrifier s'il n ' y a pas entranement
de pigments.
Il est prfrable de ne pas faire ces essais sur l ' e xtrmit des
bords qui ont t protgs par le cadre. Le vernis prsente bien souvent,
cet endroit, une meilleure solubilit vu sa moindre altration.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
114.
Le protocole des essais est prsent de la manire suivante
solvant aurole tampons
aiguille remarques
no la goutte
1 + dur il faut frotter
On notera dans la colonne des remarques, les effets divers du sol
vant : par exemple, s'il produit du blanchiment, des cristallisations,
s'il pntre vite ou lentement, s'il produit du gonflement, s'il faut
l'utiliser en frottant, en roulant le tampon ou toute autre observation.
Chaque objet d'art pose un problme particulier. Il faut l'aborder
sans ide prconue : repartir chaque fois zro. Prenez le temps de
commencer les tests de solubilit par les solvants les moins dangereux.
Les risques doivent tre rduits au minimum ncessaire et sffisant, un
nettoyage est toujours une agression.
Certaines couches picturales prsentent une sensibilit anormale
aux solvant s . Mme des tableaux vieux de plus de deux cents ans occa
sionnent parfois des surprises . Les laboratoires de la National Gallery
(London) ont dcrit rcemment (68) le cas du peintre George Stubbs (1724 -
1808) dont le liant contient une matire grasse non siccative et de bas
point de fusion, et qui rend ses tableaux trs sensibles aux solvant s .
E n cas de problme, n'hsitez pas faire appel au laboratoire, si
vous en avez la possibilit.
I I I . EXEMPLES
1. Elimination des souillures superficielles
a ) Peintures
Les tableaux qui ont t exposs dans une atmosphre pollue prsen
tent des souillures contenant surtout des matires grasses, de la nico
tine, et toutes sortes de poussires de nature minrale. Pour les li
miner, la salive, le jus de pomme de terre, d'oignons ou autres lgumes
ont t fort utiliss et conservent encore des partisans.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
115.
Il faut bien avouer que l'effet de la salive est rel mais pose
quand mme un problme d'ensemencement de microorganismes ! On r e m
placera donc cette "secrtion glandulaire" par de l'eau dminralise
additionne d ' une trs faible quantit (1 goutte par 1 ) de dtergent
non ionique. Le nettoyage sera suivi d ' un traitement l'eau pure e t
l'on veillera tamponner soigneusement la surface d u tableau avec de
l'ouate sche de manire rduire autant que possible l'humidit r
sidue11e.
Un rsultat quivalent peut souvent tre obtenu avec du white-spi
rit ou de l'isooctane. Il faut galement terminer l'opration par un
polissage avec de l'ouate sche pour viter les b lanchiments, particu
lirement en atmosphre humide.
Un autre type de souillures et auroles souvent trs gnantes peut
tre provoqu par des coules d'eau accidentelles. Dans ces cas, il
faut d'habitude utiliser des solvants base d'eau pour remettre en
mouvement les matires que l'eau a dplaces.
Un carton pour fresques de P. Puvis de Chavanne reprsentant la "L
gende de Ste Genevive" (Bruxelles, Muses royaux d'Art et d ' Histoire)
nous a pos ce problme. De longues tranes d ' auroles dues l'eau
ont pu tre limines en posant sur celles-ci des compresses d'une ar
gile trs adsorbante : l'attapulgite.
mthylthylctone ( 3 1)
()
attapulgite mouille
0
------- attapulgite sche
aurole
On imprgne cette argile avec un mlange eau + mthylthylctone
( 3 : 1) de manire moui11er la surface de l ' aurole, mais en veillant
laisser un pourtour d ' argile sche. La souillure migre par capilla
rit et adsorption dans l ' argile. Cette dernire est finalement limi
ne par aspiration quand elle est compltement sche.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
116 .
Un autre systme a d tre utilis pour supprimer des auroles sur u n
" Pauba " appartenant a u "Ethnologisch Museum Antwerpen". Le mme sol
vant a t appliqu avec un petit pinceau dur (soies de porc 4 mm) et
l'excs de liant, une colle protique gonflable l ' eau, accumul en au
role a pu tre redistribu.
Lorsque les coules d ' eau se produisent sur des vernis base de r
sines naturelles, elles y provoquent gnralement des tranes blanch
tres (19). Le remde consiste rendre au vernis sa surface plane, car
cet effet optique est caus e n grande partie par la diffusion de la lu
mire sur les microasprits et les microfissures qui se sont formes.
Il faut donc redissoudre le vernis en surface pour lui permettre de s ' u
niformiser . L'vaporation du solvant doit tre suffisamment lente pour
que cette opration soit russie.
Nous avons eu de bons rsultats en appliquant au pinceau sur les tra
nes le mlange isopropanol + 2,4-pentanedione (2 : 1 ) . Nous avons ac
tuellement renonc utiliser ce solvant, car nous avons constat sa f
cheuse tendance jaunir et sa orte rtention. Il est avantageusement
remplaable par la mthylisobutylctone.
b) SculEtures
Les souillures accumules sur les sculptures qui ont sjourn l'ex
trieur crent parfois des problmes . Ainsi, un Christ assis au Calvai
re, pierre polychrome du 16e s. appartenant au Centre public d'Aide so
ciale de Bruges, prsentait une paisse et dure souillure noirtre. Les
solvants devaient tre choisis de manire respecter la dernire cou
che de peinture que l'on avait dcid de conserver. Le meilleur rsul
tat a t obtenu l'aide du mlange trichlorothane + p . xylne ( 1 : 1 )
Par contre, une "Marie-Madeleine" du 17e s . (Bruxelles, Muses royaux
d'Art et d'Histoire), de style espagnol, qui disparaissait sous une som
bre souillure grasse, a t nettoye l'aide d'eau dminralise addi
tionne de dtergent neutre et applique en compresses de carboxymthyl
cellulose pendant 5 minutes. Notons ce propos l'intrt frquent
qu'il y a de travailler en compresses pour viter l'abrasion, surtout
si la surface prsente des crtes accuses. Ce procd prsente nan
moins le grand dsavantage d'empcher la surveillance directe. Il est
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
117.
donc indispensable d'ajuster parfaitement le choix du solvant et la du
re de son application. Il est prudent aussi de limiter la s urface
des premires compresses.
Avant d'utiliser un solvant aqueux sur une s culpture polychrome, il
faut absolument faire des tests de s urface trs rduite mais en pas
sant en revue tous les matriaux que l'on doit nettoyer. La couche
picturale (azurite), les feuilles mtalliques, la prparation, prsen
tent trs souvent des liants ou des adhsifs trs s ensibles l'eau,
au point qu'ils interdisent son utilisation.
c) Peintures_murales_-_eaeiers_eeints_-_cuirs
Le dcrassage des peintures murales pose souvent des restrictions
de toxicit des solvants, vu l'ampleur des s urfaces traiter. Fort
heureusement, des rs ultats trs satisfaisants peuvent souvent tre
obtenus par l'emploi d ' eau additionne de dtergent non ionique en
trs faible quantit (0,25 % ) . Il faut videmment veiller au rinage
et au schage pour liminer autant que possible toute trace de dter
gent et d ' eau sur la peinture. Cette mthode peut servir aussi au
nettoyage des cuirs peints ( "cuirs de Malines"), aprs essai, bien en
tendu.
Parfois, la sensibilit de la peinture n ' autorise pas l ' emploi de
l'eau. Il faut alors recourir des solvants non hydrophiles les
moins toxiques possible, par exemple, le white-spirit.
Pour les papiers peints, les gommes de diverses durets peuvent ren
dre de grands services.
d) Matriaux_eierreux
Une tude dtaille sur le nettoyage des matriaux p ierreux a t
publie rcemment (65 - 66).
Les auteurs distinguent deux types de saliss ures : l'encrassement,
dpt superficiel de matire non incrust dans le s upport et ne modi
fiant pas le matriau proprement dit (suie, terre, . . . ) et la souillu
' matire trangre qui pntre plus ou moins fortement dans le ma
triau et n ' en modifie que l'aspect (huile, goudron, rouille, . . . ) .
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
ll8.
D'autres modifications d e surface particulires aux matriaux pierreux
sont aussi envisages, entre autres les efflorescences, les patines,
etc.
Notre exprience dans ce domaine est limite. Outre le cas des pein
tures murales cit plus haut, il s'agissait le plus souvent de nettoya
ge de sculptures en pierre "souilles".
Le recours aux dtergents peut tre nocif pour des matriaux trs po
reux o ils fixeront ultrieurement poussires et autres salissures. On
ne les utilisera donc qu'en trs faible concentration et en veillant
les liminer par de nombreux rinages. La prfrence sera accorde aux
dtergents neutres non ioniques.
L'usage de compresses peut aider l'limination de souillures gras
ses, par exemple : attapulgite + p. xylne.
Rcemment, une trs belle sculpture en albtre reprsentant Saint
Martin (Halle, St-Martinuskerk) a t nettoye l'aide d ' un mlange
isooctane + isopropanol ( 1 : 1). A certains endroits trs souills, on
a d utiliser un rnlange thanol - eau (9 : 1), ce qui exige des prcau
tions accrues, vu la sensibilit de l ' albtre l'eau.
2. Elimination des vernis
---------
a) Peintures
Les vernis base de rsines naturelles s'enlvent avec les solvants
suivants, par ordre d'action croissante
isooctane + isopropanol ( 1 : 1)
tolune + isopropanol ( 1 : 1)
isooctane + thanol + ther (80 20 : 10) ou (55 : 30 : 15)
Ces solvants respectent normalement les glacis anciens ( j usqu ' au 18e
sicle) mais cela doit toujours faire l'objet d'un test (surtout les
bruns, verts et rouges) .
Ainsi, un vernis ancien trs jauni o nous avons identifi un mlan
ge de rsine de Pinus, de mastic et d'huile, masquait une "Adoration
des bergers" du 16e s., de l'cole de Lambert Lombard, appartenant
l ' glise St-Denis Lige. Le solvant slectionn fut le mlange
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
119.
isooctane + thanol + ther (80 20 10) .
Un autre exemple intressant est le cas du dvernissage d'une "Cru
cifixion" du 16e sicle provenant d'une chapelle prive Gingelom.
Le mlange tolune + isopropanol ( 1 : 1 ) limina aisment le vernis
mais laissa subsister des tranes brunes insolubles. Ce phnomne
est trs frquent. Ce sont sans doute des traces de vernis plus an
ciens pigs dans les creux de la surface. Comme nous y identifions
souvent de l'huile, il pourrait s ' agir soit d'anciens vernis gras, soit
de rsidus de polissage l'huile. Dans le cas dcrit ici, nous avons
pu solubiliser ces tranes l'aide du mlange tolune + dimthylfor
manide ( 3 : 1), un solvant que nous utilisons normalement pour les sur
peints l'huile (cf. plus loin).
Les vernis base de polycyclohexanone (AW2, Keton N) prsentent des
solubilits trs diffrentes selon les conditions climatiques qui ont
rgn au cours du vieillissement. Un tableau de Permeke, "Le pcheur
et sa femme" (coll. du Crdit Communal ) a pu tre dverni avec le m
lange isooctane / isopropanol ( 1 : 1 ) . Par contre, un vernis appliqu
peu prs en mme temps sur un tableau de D. Bouts, "L'preuve du feu"
(Muse des Beaux-Arts de Bruxelles) n'tait plus soluble que dans un
mlange "dcapant" (voir p. 107 ) contenant de l' ammoniaque (isopropa
nol, ammoniaque, eau) (50 : 25 : 25).
Il semble bien que les vernis trs pais , que l ' on trouve souvent
sur les tableaux d'Amrique centrale ou d'Amrique du Sud prsentent
une solubilit trs rduite que l ' on pourrait expliquer par un vieil
lissement accentu d au climat. Ainsi, nous avons t forcs d'uti
liser un solvant d ' habitude rserv aux surpeints l ' huile, le mlan
ge actate d'thyle + dimthylformamide, pour liminer le vernis d'un
"Christ des tremblements de terre" de l'cole de Cuzco ( 1 7e sicle) .
Citons enfin un cas tout fait exceptionnel o nous avons employ
le mlange trs pntrant mthanol + dichlorothane en compresses,
pour liminer l'pais vernis qui dnaturai t une dtrempe ("Tuchleim") ,
attribue D. Bouts. La grande fragilit de la couche picturale
n ' autorisait en effet aucun frottement mcanique (60).
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
120.
b) Sculptures
Les vernis prsentent d 'habitude les mmes problmes que dans le cas
des peintures.
Nous avons rencontr nanmoins quelques cas trs particuliers. Si
gnalons une couche de nature protique trs souille que nous ?vons
trouve reprises diverses sur des feuilles d ' or ou d'argent. Peut
tre servait-elle mater le mtal ? Quoi qu'il en soit, dans son
tat de souillure actuel, elle dnature l'expression originale. Pour
l'liminer, il faut hydrolyser les protines par un acide. Nous utili
sons dans ce cas le mlange azotropique dichloromthane + formiate d'
thyle + acide formique (50 : 50 : 2 ) . L ' action est trs superficielle,
vu la grande volatilit de ce mlange . Cela rduit le danger, car l'ac
tion est parfaitement contrlable.
Un autre problme particulier nous fut pos par l'limination d ' une
couche de gomme laque trs sombre que l ' on avait utilise pour isoler
certains moules en pltre des statuettes de la chsse de Ste Gertrude
de Nivelles. Fort heureusement, la gomme laque tait encore gonflable
par une action prolonge (30 minutes) de compresses imbibes de mtha
nol. Une fois gonfle par le solvant, l a couche de vernis se laissait
peler aisment . Rappelons ce propos, l'article de S.P. Koob ( 6 1 ) qui
prconise la pyridine pour liminer des collages la gomme laque. Nous
prfrons si possible viter ce solvant extrmement toxique -et d'odeur
trs dsagrable. S'il faut faire appel des produits basiques, nous
choisissons plutt l ' ammoniaque plus ou moins dilu que des bases orga
niques ( amines) nettement plus dangereuses (cf. p . 91 ) .
3 . Enlvement des surpeints
L ' limination d ' un surpeint exige au pralable une srieuse justifi
cation des points de vue esthtique et historique, une valuation conomi
que du travail de retouche et une minutieuse mise au point des solvants.
Il faut en effet faire appel des "dcapants", c' est--dire des substan
ces qui attaquent le liant d'une peinture. Il est donc essentiel de s ' as
surer q u ' ils respecteront le liant de l'original. Ceci est bien souvent
une gageure : l ' original est frquemment plus fragile que le surpeint .
Cette fragilit peut provenir d ' un dfaut d'adhsion de la couche pictura
le son support, source de soulvements, cloches et lchages. Il faut
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
121.
alors fixer la peinture avant toute autre opration.
L'tat de surface de la couche picturale originale peut aussi tre
la cause de difficults. Ce fut le cas pour un "Intrieur de ferme" d ' un
peintre anonyme du 19e s. (coll. ligeoise ) . Un pais surpeint brun re
couvrait une couche bleue trs granuleuse. Le surpeint tait profondment
ancr dans les creux de la couche originale qui prsentait malheureusement
une solubilit quasi identique celle du surpeint. Dans ce cas, il vaut
mieux s ' abstenir de toute intervention.
Fort heureusement, ce type de problme n'est pas toujours insoluble.
Quand la couche picturale est beaucoup plus ancienne que le surpeint on
peut avoir recours des compresses pour ramollir les rsidus pigs dans
les creux. Il est alors souvent ncessaire de termi ner leur limination
au scalpel, pour viter l'usure des crtes.
Il arrive aussi que le surpeint soit moins soluble que l'original :
c ' est souven le cas pour des peintures des 19e et 20e sicles. La seule
possibilit est alors de trouver un solvant trs volatil qui permette de
limiter l'action en profondeur (voir plus loin ) . Cette opration reste
nanmoins toujours prilleuse et ne peut tre tente que par un restaura
teur chevronn.
Surpeints huileux. Nous prconisons deux types de mlanges, les uns
volatils et d ' action brve, les autres action lente et pntrante.
Les mlanges du premier type contiennent de l'ammoniaque :
isopropanol + ammoniaque + eau (90 10 : 10) - (50 : 25 : 2 5 ) .
Les mlanges du second type contiennent du diactonealcool ou d u dimthyl
formamide :
tolune + DMF (75 : 25)
trichlorothane + diactonealcool (75 25)
trichlorothane + DMF (50 : 50)
actate d'thyle + DMF (50 : 50).
Surpeints protiques. Ces surpeints sont d'habitude sensibles aux
solvants acides
dichloromthane + formiate d ' thyle + acide formique (50 50 2) .
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
122.
---------
a) Peintures
Le m.lange contenant de 1'ammoniaque (90 : 10 : 10) est utilis fr
quemment. Citons entre autres le dgagement d 'un surpeint sur un "St
Blaise", tableau anonyme du 15e sicle (Muse de Neuchtel).
Un cas trs rcent, le "Tryptique de la Crucifixion" de Pieter Aert
sen, 16e s. (Centre public d'Aide sociale, Anvers), ncessita l'utili
sation du mlange trichlorothane + diactone alcool (75 : 25) sur un
des volets et le mlange acide, dichloromthane + formiate d'thyle +
acide formique (50 : 50 : 2) sur le panneau central.
b) Sculetures
Les polychromies surpeintes des sculptures sont souvent en couches
paisses, nombreuses et difficilement solubles.
Dans de nombreux cas, la solubilisation, voire le ramollissement des
surpeints exigent des solvants si dangereux qu'il vaut mieux avoir re
cours au scalpel, du moins partir des couches proches du niveau s
lectionn.
Il n'est pas rare de rencontrer des peintures particulirement dures,
trs probablement base de casine. Ainsi, il fallut faire appel un
mlange exceptionnel qui n'est pas repris au tableau gnral (p. 112) :
1, 1, 1-trichlorothane + dimthylformamide + NH40H (25 % NIB ) ( 1 3 : 1)
pour ramolli- r une couche extrmement dure sur une "Ste Hlne" du 16e s .
de l'glise de Zoutleeuw (Lau ) .
4 . Divers
-----------------
a) Taches de bitumes
Les bitumes sont des substances qui prsentent une extraordinaire
facult de migration dans les corps poreux (19) . I l faut les liminer
compltement, sous peine de voir rapparatre en surface aprs quelque
temps les rsidus oublis dans les couches profondes. Le phnomne est
lent mais inexorable.
Un vandale endormnagea il y a quelques annes une peinture murale de
J . Folon "Magic City" dans une station du mtro bruxellois. Cette
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
123 .
peinture liant acrylique est extrmement mince, fragile et sa surfa
ce est mate. Bien que le bitume des taches tait trs aisment s o l u
ble dans l'isooctane, s o n extraction entranait la mise nu de la
prparation et donc un important travail de retouche.
Le mme problme se pose quand un peintre a eu la fcheuse ide
d'employer des bitumes comme pi gments. C'est le cas notamment de
Mellery dont plusieurs toiles sont actuellement envahies par un jus
bruntre qui les rend tout fait illisibles. Toutes nos tentatives
d'extraction ont t vaines. La grande sensibilit de la peinture
rend d'ailleurs l'opration trs prilleuse.
b) Taches_d'acide_sulfurique
Un autre cas de vandalisme fut commis sur une peinture murale
l'huile de P . Delvaux, "Le voyage lgendaire" (Casino de Chaudfontai
ne) . A notre arrive, la peinture, qui avait t dj abondamment rin
ce l'eau, prsentait de longues tranes mates. L'acide avait atta
qu plusieurs pigments, surtout les bleus, les verts et les gris. Des
taches brunes apparaissaient au bout des coules et ces endroits ,
l'altration pntrait profondment dans la peinture. Des taches humi
des s ubsistaient et leur pH tait encore nettement acide (pH 5 ) . Nous
avons donc, aprs essai, prconis une neutralisation l' aide d'une
solution sature de bicarbonate de sodium suivie de rina&e l'eau
distille et schage. On dcida alors d'liminer les parties brunes de
la couche picturale endommage, car elles transparaissaient dans les
retouches : le mlange isooctane + isopropanol (1 : 1 ) suffit pour dis
soudre cette peinture rcente et de plus, dgrade.
c) Elimination_de_colles
La colle animale se solubilise gnralement dans des mlanges conte
nant des acides : dichloromthane + formiate d'thyle + acide formique
(50 : 50 : 2), ou acide actique + eau ( 5 : 95). Nous avons nanmoins
d recourir un autre procd pour liminer un mauvais mastic trs
dur sur un tableau de M. Seghers, une "Nature morte" de l'glise St-Ni
colas de Perk. C'est un enzyme, la papane, qui donna le meilleur r
sultat : nous l ' avons dissout raison de 50 mg dans 50 ml de tampon
phtalate (pH 5.0).
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
124.
I l faut veiller ce que la solution d'enzyme n'atteigne pas la pr
paration base de colle animale, car cela provoquerait des caillages.
Des taches de colles cellulosiques. Les anciennes colles cellulosi
ques utilises sur des papiers ont souvent jauni et provoqu des taches
trs perturbantes.
Un dessin la plume de P . Delvaux reprsentant une "Descente de
Croix'' (collection prive) a pu tre dbarrass de ses taches par ap
plication rpte de mthanol et extraction l ' aide de papiers absor
bants placs des deux cts de la feuille .
L ' emploi de mauvais papiers collants provoquent des souillures enco
re plus frquentes. Elles s'liminent d'habitude au xylne ou l ' ac
tate d ' thyle.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
125
IV. RECHERCHES RECENTES
Ces dernires annes, des recherches ont t consacres l ' tude de
l ' effet des solvants sur les couches picturales.
S . Schmitt ( 7 3 ) a montr l ' effet dsastreux du baume de copaiva utilis par
Pettenkofer pour "rgnrer" les peintures prsentant des blanchiments. Le
baume a compltement ramolli les huiles et les rsines et l ' on constate des
migrations et des formations de bulles spectaculaires qui bouleversent
toute la matire picturale, depuis le vernis jusqu ' la prparation.
S . Michalski (74) essait de raliser un modle physique pour la pntration
du solvant dans les couches picturales. I l examine les phnomnes de
diffusion, de capillarit et d ' adsorption. Il montre entre autre que le
solvant adsorb par les pigments peut causer une rupture du lien avec le
liant, ce qui expliquerait certains blanchiments et virages de couleur.
Depuis quelques annes, des recherches inities par R . Wolbers ( 7 2 ) ont
t consacres au remplacement des solvants traditionnels jugs trop
toxiques.
R . Wolbers propose des mulsions contenant de l ' eau , par exemple
- 60 ml de xylne + 12 ml de Triton X-100 (dtergent neutre) + 30 ml de
trithanolamine ( 1 % dans l ' eau, pH 8 ) : pour liminer un vernis damar ag.
- 2% de savon rsineux (trithanolamine abitate) ou de savon stroidique
( trithanolamine d o x yc h o l a t e ) + l % Triton X-100 + 2%
d hydroxypropylmthylcellul.ose ( + alcool benzylique) :
le mlange dilu l ' eau est utilis sous forme de gel pour enlever un
vernis rsineux.
- 1 g de lipase ( enzyme) Type VII { Sigma) + l ml Triton X-100 + 1, 5 g
Hydroxypropylmethylcellulose + 6 g tampon Tris-HCl (pH 8 . 6 ) + 100 ml d ' eau
: pour enlever un surpeint huileux.
Ces mlanges prsentent des dangers non ngligeables pour les couches
picturales. Ils sont alcalins ce qui favorise l ' hydrolyse des huiles et
des rsines et peut altrer certains pigments { 7 1 ) .
Le Triton X-100 est un agent tensioactif trs peu volatil, qui a
tendance se fixer aux interfaces. A . Burnstock et R . White ont montr ( 7 8 )
que mme aprs des rinages abondants l ' eau e t au white-spirit, les
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
126
surfaces trait. es en retiennent encore des rsidus. De plus, il forme par
autoxydation des composs radicalaires qui provoqueront, la longue, la
destruction des rsines et des huiles mme ages prsentes.
Ces mmes auteurs, J. Koller (77) et R . Wolbers lui-mme (79) ont
constat que les savons rsineux et stroidiques laissaient eux aussi des
rsidus impossible liminer.
Bien pire, selon KOLLER, le savon doxycholate attaque surtout les huiles
et pratiquement pas les rsines des vernis.
La lipase n est pas volatile non plus et il peut tre difficile de
1 ' liminer compltement avant qu' elle ne s ' attaque l ' huile des couches
picturales sous-jacentes au surpeint.
L ' eau est sans doute moins toxique les autres solvants pour les
restaurateurs mais elle est loin d ' tre inoffensive pour les oeuvres d ' art.
Elle est dangereuse pour tous les cas o l ' on a utilis- des colles ou des
liants aqueux les dorures polies, les prparations la colle, les
aquarelles, les gouaches et certaines mulsions modernes. Elle peut
galement causer des blanchiments irrversibles dans des couches huileuses
ou rsineuses. G . HEDLEY et coll. ont montr rcemment (76) que l ' eau
influenait aussi, comme d ' autres solvants, les proprits mcaniques des
films de peinture l ' huile.
L ' emploi des gels est intressant pour dlimiter la surface traite
mais nous manquons de donnes concernant la quantit des matires qui
pntrent dans la couche picturale en fonction du temps.
En conclusion, il est recommander de n utiliser ces mthodes que
pour des cas bien spcifiques o l ' on a pu s ' assurer qu ' il n ' y a pas
d ' e ffets secondaires indsirables. Le dgagement des couches de surpeints
superficiels sur les sculptures pourrait par exemple constituer un domaine
d ' application intressant.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
127
BIBLIOGRAPHIE
(1) P . BOUSQUIE, "Texture et porosit des roches calcaires" .
Thse prsente l ' Universit P . et M . Curie -
Paris VI (l979 ) .
(2) S . MARTINUZ Z I , "Cours de physique" , Ediscience, Paris (197 3 ) .
(3) L . MASSCHELEIN-KLEINER et J . DENEYER, "Contribution l ' tude des
solvants utiliss en conservation". ICOM Committee for
Conservation 6e. Triennial meeting, Ottawa ( 1981 ) .
(4) C . A . JOUENNE , "Cramique gnrale, notions de physico-chimie " ,
Gauthier-Villars, Paris ( 1960) I I , p . 144 .
(5) H . SCHOELLER, "Les eaux souterraines", Masson et Cie,
Paris ( 1962 ) , p. 145
(6) Cf . ( 4 ) , p . 298.
(7) D . HUMMEL, " Identification and analysis o f surface-active agents
by I . R . and chemical method s " , Interscience J . Wiley and Sons,
New York ( 19 62 ) .
(8) C f . ( 4 ) , p. 3 1 6 .
(9) Cf. ( 5 ) , p. 55.
(10) Cf. ( 1 ) , p . 1 1 5 .
(11) D . A . ROSE, "Water movement in unsaturated porous material s " ,
RILEM 2 9 (19 6 5 ) .
( 12 ) L . de BROUCKERE , "Etude des systmes collodaux", Desoer,
Lige (1945 ) , p. 16.
( 13 ) Cf. ( 1 2 ) , p . 3 8 .
( 14 ) C f . ( 2 ) , p . 203 .
( 15 ) L . A . van der MEER-LERK e t M . M . HEERTJES , "Mathematical model of
growth of blisters in varnish films on different substrates",
J.Oil. Col. Chem. Assoc. 62 (1979 ) , 256-63.
( 16 ) L . de BROUCKERE , "Chimie Gnrale " , Desoer, Lige ( 1952 ) .
(17) E . HENRIOT (rdig par L . GROVEN) "Cours de physique gnrale " ,
deuxime partie, Energtique, B-Thermodynamique - Office des
cours U . L . B . ( 1938 ) , 3 2 7 .
(18) W. MASSCHELEIN, "Molcules organiques hydroxyles " , chap. V dans
"Monographies de Chimie Organique", VII, Structures et
Proprits molculaires, Masson, Paris (1970 ) , 329 - 420.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
128
(19) L. MASSCHELEIN-KLEINER, "Liants, vernis et adhsifs anciens",
Cours de conservation 1, IRPA, Bruxelles ( 1 9 7 8 ) 2 7 - 2 9 .
(20) C . D . HODGMAN, "Handbook o f Chemistry and physics" , The Chemical
Rubber Publishing Co, Cleveland USA ( 1 9 6 3 ) 2527-2535 et 3214.
(21) C . M . HANSEN, Official Digest 3 7 ( 1 9 6 5 ) 5 7 .
(22) C . M . HANSEN, " A mathematical description o f film drying b y solvent
evaporation", J . Oil Col. Chem. Assac. , 5 1 (1968) 2 7 - 4 3 .
(23) C . M . HANSEN, "Vinylchloride retention in coatings formed solutions" ,
J . Oil. Col. Chem. Assac. , 60 (1977) 245 - 2 4 8 .
(24) D . J . NEWMAN et C . J . NUNN, "Solvent retention in organic coatings" ,
Progress in Org. coatings, 3 ( 1 9 7 5 ) 2 2 2 - 2 4 3 .
(25) G . M . SLETMOE , "The evaporation o f non hydrogenbonding solvents from
resin films" , J . of Paint Technology 38 ( 1 9 6 6 ) 642 - 6 5 3 .
(26) M . DAUCHOT-DEHON et E . D E WITTE, "Etude du temps d e schage du
vernis Paraloid 872 sur les peintures" , ICOM Committee for
Conservation, Se. runion triennale, Zagreb ( 19 7 8 ) 78/16/2.
(27) M . YASEEN et H . E . ASHTON, " Solvent retention in phenolic varnish
films" , J. Oil. Col. Chem. Assac . , 53 (1970) 9 7 7 - 988.
(28) T . H . DURRANS, revised by E . H . DAVIES, "Solvents" , Chapman and Hall,
Ltd, London ( 197 1 ) .
(29) M, DAUCHOT-DEHON, "Les effets de solvants sur les couches
picturales. 1 . "Alcools et actone " , Bulletin IRPA/KIK,
XIV (1973/74) 89 - 104.
(30) Cf. ( 5 ) , p. 417.
(31) R . L . FELLER, N . STOLOW et E . H . JONES, "On picture varnishes and
their solvents" , The Press of Case Western Reserve
University - Cleveland and London ( 1 97 1 ) .
(32) C f . ( 12 ) , p. 6 .
(33) G . CHAMPETIER et H . RABATE, "Physique des peintures , vernis et
pigments" Tome I I , Dunod, Paris, (1962 ) p. 3 0 1 .
(34 ) K . S . PITZER et L. BREWER, "Thermodynamics" Mc Graw Hill,
New York (19 6 1 ) .
(35) H . BURREL, "Trends in solvent science and technology" dans
R . W . TESS " Solvents, theory and practice " , Advances in
Chemistry series, Amer. Chem. Soc . , Washington D . C . ( 1 9 73 ) .
(36) W . J . ROFF et J . R . SCOTT, "Fibres, films, plastics and rubbers"
Butterworths, London ( 1 9 7 1 ) p. 509.
(37) J . H . HILDEBRAND et R . L . SCOTT, "The solubility o f non-electrolytes" ,
Reinhold, New York (1950 ) .
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
129
(38) J . O . CROWLEY , G . S . TEAGUE et J . W . LOWE, "A three dimensional
approach to solubility", J . of Paint Techn. 38 ( 19 6 6 )
269 - 280.
(39) C . M . HANSEN, "The three dimensional solubility parameter, key
to paint component affinities " , J . of Paint Techn. 39 (1967)
104 - 117
(40) J . P . TEAS, "Graphie analysis o f resin solubilities " ,
J. of Paint Techn. 40 ( 1968) 19 - 2 5 .
(41) J. DAYANTIS, "Le paramtre de Hildebrand, solubilit des polymres" ,
Plastiques modernes et lastomres 2 9 ( 19 7 7 ) 58 - 6 2 .
(42) R . FELLER, "The relative power needed t o remove various aged
solvent-type-coatings, Conserv. Restor. Pict. Art,
(1976) 158 - 6 1 .
(43) G . TORRACA , "Solubility and solvents for conservation problems " .
ICCROM ( 1 9 75 ) .
(44) L . S . MORA, P . MORA et P . PHILIPPOT, "Le nettoyage des peintures
murales " , Bulletin IRPA/KIK, XV ( 1 9 7 5 ) 240 - 261.
(45) H . AHMAD et M . YASEEN, "Estimation of the solubility parameters o f
low molecular weight compounds by a chemical group
contribution technique " . J . Oil. Chem. Assoc . , 60 ( 19 7 7 )
9 9 - 103 et 488 - 4 9 4 .
(46) c . REICHARDT, "Effets d e solvants en chimie organique. . .
Flammarion Science, Paris ( 1 9 7 1 ) .
(47) M. JULIA, "Mcanismes lectroniques e n chimie organique " ,
Gauthier-Villars, Paris ( 1961) .
(48) C . MARSDEN et S . MANN, "Solvents guide " . Cleaver-Hume Press Ltd,
London (1962 ) .
(49) V . GRIGNARD, "Trait d e Chimie Organique I I I . Hydrocarbures
aliphatiques et cycliques, IV. Hydrocarbures cycliques,
V. Combinaisons organomtalliques alcools, thers" .
Masson, Paris (1949 ) .
(50) D . J . CRAM et G . S . HAMMOND, "Organic Chemistry " . M c Graw Hill,
New York ( 1964 ) .
(51) R. LAUWERYS , "Prcis de toxicologie industrielle et des
intoxications professionnelles " . Duculot, Gembloux ( 19 72 ) .
(52) DEUTSCHE FORSCHUNGSGEMEINSCHAFT, "Maximum concentrations et the
workplace" . Report n XV. Commission for investigation of
health hazards of Chemical Compounds in the Work Area,
Bonn ( 1 97 9 ) .
( 53) A. I . VOGEL, '0A textbook of pratical organic chemistry" .
Longmans, London ( 19 5 7 ) .
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
130
(54) P . G . STECHER, "The Merck Index " , Merck and Co, Rahway ( 1 9 68 ) .
(55) L . MASSCHELEIN-KLEINER, J . HEYLEN et F. TRICOT- MARCKX,
"Contribution l ' analyse des liants , adhsifs et vernis
anciens " , Studies in Conserv 14 ( 1 9 6 9 ) 75 - 8 2 .
(56) T . H . DURRANS, "Solvent s " , Chapman and Hall, London ( 1 9 71 ) .
(57) C . D . HODGMANS, "Handbook of Chemistry and Phyaics", The Chemical
Rubber Publ. Co, 44e d. (1963 ) , Cleveland USA.
(58) P . MAITTE, "Ethers" dans ( 4 9 ) p . 837.
(59) G . VERA e t L . MASSCHELEIN, Rapport de stage (1970 - 7 1 ) .
Non publi.
(60) L . MASSCHELEIN-KLEINER, N . GOETGHEBEUR, L . KOCKAERT, J. VYNCKIER
et R . GHYS, "Examen et traitement d ' une dtrempe sur toile
attribue Thierry Bouts, La Crucifixion de Bruxelles,
Bulletin IRPA/KIK, XVII ( 1978 - 7 9 ) 5 - 2 1 .
(61) S . P . KOOB, "The removal o f aged shellac adhesive from ceramics",
Studies in Conservation 24 (1979) 134 - 1 3 5 .
. ( 62) E . H . JONES , " Investigations o n the removal of agea varnish Coatings"
in ( 3 1 ) pp. 171 - 191.
(63) E . H . JONES, "The effect of aging and Re-forming on the ease of
solubility of certain resins" .
Recent Advances in conservation, London (1963) 7 9 - 8 3 .
(64) K . RAFT, " A n examination of the value of the re-forming technique
in pract ice", Studies in Conservation 25 (1980) 137 - 140.
( 65 ) P . de HENAU, R. GERARD, E. MEERT et A. PIEN, "Renovation, nettoyage
et asschement des btiments anciens " . Centre Scientifique
et Technique de la Construction (CSTC ) , Colloque ODEMA,
Bruxelles, 7 - 10 octobre 1980.
(66) ANONYME, "Ravalement des faades, choix des mthodes de nettoyage".
CSTC, note d ' information technique 1 2 1 ( 1 9 78 ) .
(67) H . LANK et V . PEMBERTON-PIGOTT, "The use of dimethylformanide
vapor in reforming blanched oil paintings" dans N. BROMMELLE
et P . SMITH (eds ) , "Conservation and restoration of pictorial
art " . Butterworths, London ( 1 9 7 6 ) 103 - 109.
(68) R. WHITE, A. ROY, J . MILLS et J . PLESTERS , "George Stubb ' s Lady and
Gentleman in a Carriage", a preliminary note on the
technique. National Gallery Technical Bulletin 4 (1980) 64.
(69) H . RUHEMAN , "The cleaning of Paintings" , Praeger, N . Y . ( 1968) .
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
131
(70) L . MASSCHELEIN-KLEINER et J. DENEYER, "Contribution l'tude
des solvants utiliss en conservation" , ICOM, Comit pour
(71) L . MASSCHELEIN-KLEINER, "Remarques sur l'utilisation des
solvants en conservation", Bulletin IRPA/KIK (1982-83)
95 - 104.
(72) R . C . WOLBERS, "Aspects o f the examination and cleaning o f two
portraits by Richard and William Jennys " , A . I . C. sixteenth
annual meeting, New Orleans (1988) 245 - 260.
(73) S . SCHMITT, "Examination of paintings treated by Pettenkofer s
proces s " , dans J . S . MILLS et P . SMITH (eds), "Cleaning,
retouching and coatings " , 13e runion internationale r . r . c. ,
Bruxelles ( 1990) 81 - 84.
(74) S . M ICHALSKI , "A physical model of varnish removal from oil paint"
Congrs I . I . C . , Bruxelles (1990) 85 - 9 2 .
(75) D . ERHARDT et J . S . TSANG, "The extractable components of oil paint
films " , Congrs I . I . C . , Bruxelles ( 1990) 93 - 9 7 .
(76) G . HEDLEY, M . ODLYHA, A . BURNSTOCK, J.TILLINGHAST et C . HUSBAND,
"A study of mechanical and surface properties of oil paint
films treated with organic solvents and w!,ter" ,
Congrs I . I . C . , Bruxelles (1990) 98 - 105.
(77) J . KOLLER, "Cleaning o f a nineteenth-century painting with
deoxycholate soap: "mechanism and residues studies " ,
Congrs I . I . C . , Bruxelles (1990) 106 - 110.
(78) A . BURNSTOCK et R . WHITE, "The effect o f selected solvents and soaps
on a simulated canvas painting " , Congrs I . I . C . , Bruxelles
(1990) 111 - 118.
(79) R . C . WOLBERS, "A radio-isotopie assay for the direct measurement of
residual cleaning materials on a paint film", Congrs r . I .c. ,
Bruxelles (1990) 119 - 125.
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
D/1991/0613-1
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
KIK-IRPA, Brussels (Belgium) [www.kikirpa.be]
También podría gustarte
- Centre Pompidou Guide Du ConvoyeurDocumento32 páginasCentre Pompidou Guide Du ConvoyeurbkajjiAún no hay calificaciones
- Béton Déchet MarbreDocumento6 páginasBéton Déchet MarbreMongi Ben OuezdouAún no hay calificaciones
- TP Chim LavageDocumento3 páginasTP Chim LavageAzabou MariamAún no hay calificaciones
- Polissage ÉlectrolytiqueDocumento4 páginasPolissage ÉlectrolytiqueYassine Koot100% (1)
- La TeintureDocumento3 páginasLa Teinturechiraz montanariAún no hay calificaciones
- Paper 36 - Roche - FrenchDocumento15 páginasPaper 36 - Roche - FrencheledebelAún no hay calificaciones
- Poly CoursDocumento87 páginasPoly Courssoso---1767% (3)
- These Presentee A L Universite Bordeaux IDocumento145 páginasThese Presentee A L Universite Bordeaux INisrine AkayabAún no hay calificaciones
- Polycopie Chimie Organique IIDocumento124 páginasPolycopie Chimie Organique IIboudj2603Aún no hay calificaciones
- Classifications Des AquiferesDocumento170 páginasClassifications Des Aquifereskarim NedjarAún no hay calificaciones
- Ddoc T 2015 0020 Pacini PetitjeanDocumento401 páginasDdoc T 2015 0020 Pacini PetitjeanMomha Jean-AlainAún no hay calificaciones
- TFE Miraucourt David Final 2Documento103 páginasTFE Miraucourt David Final 2Hadjer BouzeribaAún no hay calificaciones
- These Benjamin NOTTELETDocumento185 páginasThese Benjamin NOTTELETعبد القادر ولد براهاميAún no hay calificaciones
- Chromato Liquide 2007Documento98 páginasChromato Liquide 2007Hakim Bil100% (9)
- ViolleauDocumento130 páginasViolleaukaltoumAún no hay calificaciones
- Etude Comparative Entre Coagulation - Floculation Et Electrocoagulation-ElectroflottationDocumento105 páginasEtude Comparative Entre Coagulation - Floculation Et Electrocoagulation-ElectroflottationAllaa BoukhelfAún no hay calificaciones
- HadjSalah Nadjet 2012 ArchivageDocumento175 páginasHadjSalah Nadjet 2012 ArchivagekaltoumAún no hay calificaciones
- Jean Louis CUQ Chromatographie Liquide HPLCDocumento101 páginasJean Louis CUQ Chromatographie Liquide HPLCsndqjwkkwcsdAún no hay calificaciones
- 2e32 PDFDocumento123 páginas2e32 PDFHicham BendjaouaneAún no hay calificaciones
- Inhibition de La CorrosionDocumento80 páginasInhibition de La Corrosionass mohAún no hay calificaciones
- Notions Sur Les Processus de Rayonnement Et de Diagnostics Spectroscopiquesen AstrophysiqueDocumento148 páginasNotions Sur Les Processus de Rayonnement Et de Diagnostics Spectroscopiquesen Astrophysiquefrancy3Aún no hay calificaciones
- KUHN Philippe 2011 PDFDocumento143 páginasKUHN Philippe 2011 PDFHalima MostefaiAún no hay calificaciones
- LATRECHE-ZERROUKI PfeDocumento70 páginasLATRECHE-ZERROUKI Pfeelk hajourraAún no hay calificaciones
- Etude de Faisabilite D'un Climatiseur Solaire Adapte A La Region de BiskraDocumento97 páginasEtude de Faisabilite D'un Climatiseur Solaire Adapte A La Region de Biskramohamed belhafsiAún no hay calificaciones
- Manuel Opérateur Production1Documento89 páginasManuel Opérateur Production1ChesterAún no hay calificaciones
- Inpl T 1992 Roch F PDFDocumento179 páginasInpl T 1992 Roch F PDFMohamed LaliouiAún no hay calificaciones
- Analyse Des Processus D'Adsorption A L'Interface Solide - Gaz Par L'Etude Du Phenomene de PolarisationDocumento221 páginasAnalyse Des Processus D'Adsorption A L'Interface Solide - Gaz Par L'Etude Du Phenomene de PolarisationAbde TamAún no hay calificaciones
- Cours c233 Bcg-s3Documento136 páginasCours c233 Bcg-s3SoufianeAún no hay calificaciones
- Guinot 1979 Thesis Donneesnouvellessurlaphylogeneseetlataxonomiedes Crustaces Decapod 1Documento358 páginasGuinot 1979 Thesis Donneesnouvellessurlaphylogeneseetlataxonomiedes Crustaces Decapod 1Elver Jimenez CastilloAún no hay calificaciones
- Écologie Générale M'silaDocumento51 páginasÉcologie Générale M'silaMima YasmineAún no hay calificaciones
- Etude de La Synthèse de Composites Liquides Organiques Géopolymère en Vue Du Conditionnement de Déchets NucléairesDocumento185 páginasEtude de La Synthèse de Composites Liquides Organiques Géopolymère en Vue Du Conditionnement de Déchets NucléairesJasson StathamAún no hay calificaciones
- PCHI03Documento81 páginasPCHI03Norel HoudaAún no hay calificaciones
- Cours DR LHAHMAR HICHAM Catalyse Et Application M2 Chimie Des MatériauxDocumento59 páginasCours DR LHAHMAR HICHAM Catalyse Et Application M2 Chimie Des MatériauxSarah sarah100% (2)
- TheseDocumento272 páginasTheseRuby_Warren_UTsBAún no hay calificaciones
- ChapSA 4 PrecipitationDocumento22 páginasChapSA 4 PrecipitationOumar CamaraAún no hay calificaciones
- Polycopie Ammi 29.02.2020Documento96 páginasPolycopie Ammi 29.02.2020Minou MakhloufAún no hay calificaciones
- MINÉRALOGIEDocumento51 páginasMINÉRALOGIEJean PeutpuAún no hay calificaciones
- Les Caoutchoucs - Identification Et DegradationDocumento186 páginasLes Caoutchoucs - Identification Et DegradationRazvyAún no hay calificaciones
- THESE1Documento181 páginasTHESE1abdellah faqdaniAún no hay calificaciones
- RR 39140 FRDocumento64 páginasRR 39140 FROmar BennajiAún no hay calificaciones
- 07AEP08Documento76 páginas07AEP08NdjeumiAún no hay calificaciones
- CoursDocumento79 páginasCoursRedOne DerrouazinAún no hay calificaciones
- Wcms 218645Documento480 páginasWcms 218645gloirekibwe775Aún no hay calificaciones
- Chimie Organique Partie II Stratégie de SynthèseDocumento114 páginasChimie Organique Partie II Stratégie de SynthèseEtienne jeoffreyAún no hay calificaciones
- ArrisDocumento200 páginasArrisNina NoniAún no hay calificaciones
- Universite Du QuebecDocumento106 páginasUniversite Du QuebecMouctar CamaraAún no hay calificaciones
- Tunisie: Recherche Et D'irrigation Avec Des Eaux SaléesDocumento396 páginasTunisie: Recherche Et D'irrigation Avec Des Eaux SaléesmakramAún no hay calificaciones
- Les Eaux Usees UrbainesDocumento99 páginasLes Eaux Usees UrbainesStaneAún no hay calificaciones
- Polycopié Organique HabilitationDocumento183 páginasPolycopié Organique HabilitationOnes JemaiAún no hay calificaciones
- Chimie Organique Partie I Analyse Structurale Et QuantitativeDocumento141 páginasChimie Organique Partie I Analyse Structurale Et QuantitativeEtienne jeoffreyAún no hay calificaciones
- Cours - HADDADI GUEMGHAR Hayate - Méthodes SéparativesDocumento78 páginasCours - HADDADI GUEMGHAR Hayate - Méthodes SéparativesAl moukhtar BaAún no hay calificaciones
- Polycopie HALLOUCHE BACHIR Intitule Hydraulique SouterraineDocumento80 páginasPolycopie HALLOUCHE BACHIR Intitule Hydraulique Souterrainebaayou yahyaAún no hay calificaciones
- Formation Continue Chromatographie D'exclusion StériqueDocumento1 páginaFormation Continue Chromatographie D'exclusion StériqueAtomer FormationAún no hay calificaciones
- 1986 Torraca Materiaux Poreux Fre 38263 LightDocumento164 páginas1986 Torraca Materiaux Poreux Fre 38263 LightJose BritesAún no hay calificaciones
- Cs SamDocumento103 páginasCs SamZahk LbatlAún no hay calificaciones
- Oxydation Du Cyclohexane Par Complexe de RutheniumDocumento87 páginasOxydation Du Cyclohexane Par Complexe de Rutheniumnouhaila benzemzamAún no hay calificaciones
- These Karine ChastaingDocumento220 páginasThese Karine Chastaingsalah a9aAún no hay calificaciones
- Phénomène D'entartrage Et Techniques de Traitement - Saad-Eddine EL YARTAOUIDocumento35 páginasPhénomène D'entartrage Et Techniques de Traitement - Saad-Eddine EL YARTAOUIAMIAN DidierAún no hay calificaciones
- Hydrogeologie PDFDocumento354 páginasHydrogeologie PDFKaterina Houdkova67% (3)
- Gestion Globale Des Ressources Marines Et Des Risques Dans Les Espaces CôtiersDocumento145 páginasGestion Globale Des Ressources Marines Et Des Risques Dans Les Espaces CôtierserraiouiAún no hay calificaciones
- Wa0001Documento2 páginasWa0001Frex MartiniAún no hay calificaciones
- DesenfumageDocumento8 páginasDesenfumageGabrielSimoesAún no hay calificaciones
- 1 - Compartiments LiquidiensDocumento30 páginas1 - Compartiments LiquidiensImen Benmalek33% (3)
- Protocole Activateur de Sol IDEE-BIODocumento10 páginasProtocole Activateur de Sol IDEE-BIONANTOUMÉ SAún no hay calificaciones
- TH7655Documento128 páginasTH7655athena7redAún no hay calificaciones
- Polycopié Exercices Corrigés Chimie Des Solutions Aqueuses Chimie 03 - 2ème Année - CompressedDocumento84 páginasPolycopié Exercices Corrigés Chimie Des Solutions Aqueuses Chimie 03 - 2ème Année - CompressedAbdoul SawadogoAún no hay calificaciones
- Alliages Ferreux. Symbolisation Des Traitements: EB01.05.205 /A Norme ExécutoireDocumento4 páginasAlliages Ferreux. Symbolisation Des Traitements: EB01.05.205 /A Norme ExécutoireIna IoanaAún no hay calificaciones
- Cycle Du CalciumDocumento9 páginasCycle Du CalciumNative Emerick Kokea TielaAún no hay calificaciones
- Physiologie RenaleDocumento10 páginasPhysiologie RenaleAbdo AichaAún no hay calificaciones
- Exo PR 7dDocumento2 páginasExo PR 7dNiangAún no hay calificaciones
- Brochure 2015Documento108 páginasBrochure 2015Soufiane Sani HarounaAún no hay calificaciones
- Résumé Cycle de L'azoteDocumento3 páginasRésumé Cycle de L'azotejaizoz100% (6)
- MMS-Le Remède FacileDocumento108 páginasMMS-Le Remède FacileChristian F100% (1)
- Technique D'analyse S6Documento39 páginasTechnique D'analyse S6SiremAún no hay calificaciones
- Les Produits de Nettoyage Et DésinfectionDocumento3 páginasLes Produits de Nettoyage Et DésinfectioncabeaureyAún no hay calificaciones
- 20TL 2016 08 FKRS-EU DE FRDocumento39 páginas20TL 2016 08 FKRS-EU DE FRJero MilAún no hay calificaciones
- Escalier BADocumento1 páginaEscalier BAModou MbayeAún no hay calificaciones
- NutrisurveyDocumento2 páginasNutrisurveyMohammad RizkiAún no hay calificaciones
- Model F/FC: ManualDocumento9 páginasModel F/FC: ManualKia McAún no hay calificaciones
- L'ONSSA Au Service de La Production de La Santé Du Consomateur Et Du Patrimoine National, Animal Et Végétal - EL BEKHARI RidaDocumento36 páginasL'ONSSA Au Service de La Production de La Santé Du Consomateur Et Du Patrimoine National, Animal Et Végétal - EL BEKHARI RidaYassine HaouariAún no hay calificaciones
- Corrosion Par Les Gaz ChaudsDocumento10 páginasCorrosion Par Les Gaz ChaudsFlorian HonfinAún no hay calificaciones
- Devoir Physique 3 BacetplusDocumento7 páginasDevoir Physique 3 BacetplusMed BriniAún no hay calificaciones
- Schaeffler PHDocumento1 páginaSchaeffler PHCan ERTANAún no hay calificaciones
- Tec Cedeao Partie 4Documento141 páginasTec Cedeao Partie 4EliasseAún no hay calificaciones
- Porcelaines Spéciales PDFDocumento8 páginasPorcelaines Spéciales PDFCharles Betuel MvumbiAún no hay calificaciones
- Master Academique: ThèmeDocumento80 páginasMaster Academique: ThèmeCrocus AdelyseAún no hay calificaciones
- Chapitre II Risques Industriels Et Catastrophes NaturellesDocumento33 páginasChapitre II Risques Industriels Et Catastrophes Naturellesrraouf asAún no hay calificaciones
- Echantillonnage en LaboratoireDocumento6 páginasEchantillonnage en Laboratoiredjhqsfj100% (1)
- Development Lenght of FRP Straight RebarsDocumento8 páginasDevelopment Lenght of FRP Straight RebarsVictor Calvet RodriguezAún no hay calificaciones
- Pfe GC 0083Documento187 páginasPfe GC 0083tarik erragganiAún no hay calificaciones