Documentos de Académico
Documentos de Profesional
Documentos de Cultura
05 Agua
Cargado por
Ana MezaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
05 Agua
Cargado por
Ana MezaCopyright:
Formatos disponibles
1
Dr. Ricardo Remes Ruiz.
A G U A.
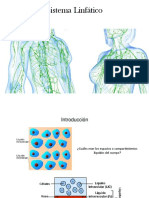
El agua es, con mucho, el mayor componente del cuerpo
constituyendo aproximadamente el 70% del peso total del cuerpo
(llegando a 90% en los nios).
En el organismo se mantiene una relacin constante de 70% de agua,
20% de protenas y poco menos de 10% de lpidos.
Una prdida del 10% del contenido total de agua en el hombre
ocasiona enfermedad y del 20% muerte.
El agua est distribuida en dos grandes compartimientos:
INTRACELULAR 50%
EXTRACELULAR 20%. (15% intersticial y 5% intravascular)
El agua contiene solutos como son: protenas, iones, etc. Ms del 95%
del sodio corporal es extracelular y es el principal soluto del lquido
extracelular.
FUENTES Y REQUERIMIENTOS DE AGUA.
INGRESOS NORMALES:
AGUA DE BEBIDAS
1600 ml
AGUA DE ALIMENTOS SLIDOS 700 ml
AGUA DE OXIDACIN
200 ml
PRDIDAS NORMALES:
PRDIDAS INSENSIBLES (PIEL Y PULMONES) 800 ml
VIA RENAL (orina)
VA DIGESTIVA (heces)
1500 ml
200 ml
ENTRADA Y SALIDA DE LQUIDOS DEL ORGANISMO EN
CONDICIONES NORMALES.
ESTRUCTURA DEL AGUA.
La molcula de agua est formada por un tomo de oxgeno y dos de
hidrgeno unidos mediante enlaces covalentes.
El oxigeno est en su forma hbrida sp3. El oxgeno ocupa el centro
de un tetraedro, los tomos de hidrgeno ocupan dos de los vrtices,
en tanto que los electrones no compartidos ocupan los dos vrtices
restantes. El ngulo entre los tomos de hidrgeno es de 104.5.
El tomo de oxgeno atrae fuertemente los electrones, en tanto que los
dos ncleos de los tomos de hidrgeno los atraen dbilmente, lo que
favorece que la molcula de agua se comporte como un dipolo,
elctrico, teniendo carga negativa (delta negativa o -) del lado del
oxgeno y carga positiva (delta positiva o +) del lado de los
hidrgenos.
ORBITALES HBRIDOS.
Los electrones que deberan estar distribuidos en un orbital s y tres
orbitales p, con las caractersticas espaciales que ya conocemos (un
orbital esfricos y tres bilobulados), se distribuyen en cuatro orbitales
nuevos idnticos entre s, y que se llaman HBRIDOS, por haber sido
engendrados por dos tipos de orbitales diferentes, y porque participan
de las caractersticas de sus progenitores
PUENTES DE HIDRGENO
El comportamiento del agua como un DIPOLO hace que la parte + de
uno de los hidrgenos de la molcula se acerque al oxigeno (-) de
otra molcula de agua vecina. Cuando dos molculas de agua se
sitan a una distancia de 2.7 a 3.0 A, se forma un PUENTE DE
HIDRGENO. Una molcula de agua puede interaccionar hasta con
cuatro molculas vecinas.
Los puentes de hidrgeno son mucho ms dbiles que los enlaces
covalentes .La energa necesaria para romper un puente de hidrgeno
es de 4.5 Kcal/mol , en cambio para romper un enlace covalente C-H
se requiere de 100 Kcal/mol
En el agua en estado lquido existen molculas de agua libres y
racimos o redes de molculas de agua unidas mediante puentes de
hidrgeno parecidas a las del hielo. Al aumentar la temperatura se
rompen los puentes de hidrgeno dejando libres la mayora de las
molculas de agua. En cambio, al disminuir la temperatura se forma
hielo debido a que el ngulo entre los tomos de hidrgeno de una
molcula de agua aumenta a 108 y los puentes de hidrgeno forman
redes tridimensionales con gran cantidad de espacios vacos lo que
explica la menor densidad del hielo con respecto al agua lquida.
A y B AGUA LIQUIDA. C AGUA LIQUIDA EN RACIMOS PARPADEANTES.
ESTRUCTURA DEL AGUA LQUIDA.
PROPIEDADES DEL AGUA.
DISOLVENTE UNIVERSAL.- la estructura y polaridad del agua hacen
que sea un disolvente capaz de reducir las fuerzas de atraccin entre
partculas con cargas opuestas o de hacer menor la fuerza de
repulsin entre partculas de cargas semejantes.
Los COMPUESTOS INICOS como el cloruro de sodio (NaCl), se
disuelve fcilmente en el agua, ya que las molculas de agua rodean
tanto al Na+ como al Cl- . La parte positiva de la molcula de agua se
pone en contacto con el Cl- mientras que la negativa con el Na+. El
agua posee una Constante dielctrica muy elevada, que es la
tendencia del disolvente a oponerse a la atraccin electrosttica entre
los iones negativos y positivos. La Constante dielctrica del agua es
de 78.5.
El agua tambin disuelve COMPUESTOS NO INICOS PERO DE
CARCTER POLAR .Esta propiedad se debe a la capacidad del agua
para establecer puentes de hidrgeno con grupos funcionales (OH-,
SH-, NH2-) polares de otras molculas.
Los COMPUESTOS APOLARES O HIDROFBICOS no interaccionan
con el agua, sino que se renen entre s no porque tengan gran
afinidad entre ellos, sino porque las molculas de agua forman una
especie de envoltura alrededor de ellos. La tendencia de las molculas
hidrofbicas a unirse entre s en presencia de agua se denomina unin
o interaccin hidrofbica.
10
El agua tambin solubiliza MOLCULAS ANFIPTICAS, que son
aquellos compuestos que tienen dentro de la misma molcula grupos
polares y grupos no polares. La porcin polar interacciona con el agua
mientras que la porcin no polar o hidrofbica queda encerrada en el
centro .Estos compuestos anfipticos forman MICELAS cuando se
encuentra disueltas en agua. Los compuestos con estas
caractersticas son los fosfolpidos, las protenas y los cidos
nucleicos.
TENSIN SUPERFICIAL.
11
Cuando la superficie del agua est en contacto con el aire se comporta
como si su superficie fuera una membrana elstica, ya que las
molculas de esta zona no estn sujetas fuerzas de atraccin
semejantes en todas direcciones y tienden a aglutinarse ms en esta
parte que en otras zonas del lquido. La tensin superficial del agua es
la ms alta despus del mercurio. Las protenas disueltas en agua
disminuyen la tensin superficial del agua en los capilares y clulas,
facilitando con ello los intercambios entre los tejidos, ya que al
disminuir la tensin superficial junto a la membrana, disminuye la
resistencia a la smosis intercelular.
ELECTROLITO DBIL.
EL agua es un electrolito dbil porque tiende a disociarse
parcialmente .Origina el mismo catin que los cidos ( H+ ) y el mismo
anin (OH-) que las bases , por lo que es una sustancia ANFTERA o
ANFOLITO , es decir, se puede comportar como cido o como base.
CALOR ESPECFICO.
12
Es la capacidad de un material para almacenar energa interna en
forma de calor
Es la cantidad de calor necesaria para aumentar la temperatura de 1
gr. de 14.5C a 15.5C. es el calor que al aplicarse a una sustancia
aumenta su temperatura sin cambiar su estado fsico. Al calor
especfico del agua se le asigna el valor de 1. Esta propiedad es
bsica para estabilizar la temperatura del cuerpo y funciona como un
amortiguador que evita la elevacin de la temperatura corporal.
CALOR LATENTE DE VAPORIZACIN
Es la cantidad de energa necesaria para superar las fuerzas de
atraccin entre las molculas de agua de modo que las molculas
individuales puedan separarse unas de otras y pasar al estado
gaseoso.
El alto calor latente de vaporizacin permite mantener la temperatura
corporal ms baja que la del ambiente al absorberse calor.
El organismo pierde continuamente agua en forma de vapor por la piel
y pulmones; a esto se une la evaporacin del sudor como otra forma
de vaporizacin del agua corporal.
Todo lquido tiene una temperatura a la que comienza a evaporase.
Cuando se entrega energa en forma de calor al lquido, sta energa
se utiliza para aumentar la temperatura del mismo. Cuando alcanza la
temperatura de vaporizacin, la energa se utiliza para el cambio de
estado de lquido a gaseoso, porque es la energa que se utiliza para
romper enlaces o puentes de hidrgeno entre molculas de agua, sin
que continu elevndose la temperatura. Por ejemplo si se calienta
agua, cuando sta llega a 100 C comienza a evaporarse, aunque
sigamos entregando calor, ste va a hacer que el agua se evapore por
completo, pero la temperatura se mantendr siempre a 100C, cuando
se haya evaporado toda el agua y si seguimos calentando, recin ah
comenzar de nuevo a subir la temperatura.
La energa entregada desde que el agua lleg a 100C hasta que
comienza de nuevo a subir la temperatura, dividido la masa de agua
sera el calor latente de vaporizacin
13
PUNTO DE FUSIN
La temperatura en la que al agua pasa del estado slido al lquido y es
de 0C.
PUNTO DE EBULLICIN.
Es la temperatura en la que al agua lquida se convierte en vapor y es
de l00C.
Tanto el punto de fusin como el de ebullicin se alteran cuando se
agregan solutos al agua. El punto de ebullicin aumenta y el de fusin
disminuye.
PRESIN OSMTICA.
En una solucin en la que hay agua y solutos, las molculas de soluto
ejercen una presin sobre las paredes del recipiente que las contiene,
que es medible y se llama presin osmtica.
OSMOSIS: Difusin del agua de la zona de menor concentracin
de solutos a la de mayor concentracin.
La concentracin de una solucin depende de la cantidad de
partculas de soluto que existen en ella y no de su tamao. Por
ejemplo una molcula de albmina que tiene un peso molecular de
70,000 tiene el mismo efecto osmtico que una molcula de glucosa
con peso de 180.
El nmero total de partculas de una solucin se mide en OSMOLES.
14
PRESIN OSMTICA.
OSMOL (osm)
Es igual a un MOL de partculas del soluto.
As una solucin que tiene un mol de glucosa /l. Tiene una
concentracin de un osmol/l. de glucosa.
Si la molcula se disocia en dos iones (dos partculas) como el NaCl.
(iones de Cl- y Na+), entonces la solucin que contiene un osm/l. Tiene
una concentracin osmtica de 2 osm/l.
.
El trmino osmol se refiere AL NMERO
de partculas
osmticamente activas.
Miliosmol = 1/1000 osmoles.
15
OSMOLARIDAD: PLASMA INTERSTICIO
281 mOm/l
282 mOm/l.
INTRACELULAR
281 mOm/l.
PRESION OSMTICA.
Es la presin necesaria que se necesita aplicar para evitar el
movimiento neto del agua desde una solucin a otra, cuando ambas
soluciones estn separadas por una membrana permeable solo al
agua.
Cuanto mayor es la presin osmtica de una solucin, menor es la
concentracin de agua, pero mayor es la concentracin de solutos de
esa solucin.
La presin osmtica es directamente proporcional a la concentracin
de partculas osmticamente activas que existen en la solucin
(independientemente de su tamao).
La presin osmtica solo es ejercida por las partculas que no pasan a
travs de una membrana semipermeable.
La OSMOLARIDAD DEL LQUIDO EXTRACELULAR se debe a la
concentracin de SODIO.
La OSMOLARIDAD DEL LIQUIDO INTRAVASCULAR o PLASMA se
debe a las PROTEINAS.
La pequea diferencia que hay entre la osmolaridad del plasma y el
lquido intersticial se debe a las protenas del plasma lo que hace que
haya unos 20 mmHg. Mas de presin en los capilares que en el
intersticio.
PRESIN COLOIDOSMTICA U ONCTICA
Es la presin osmtica del plasma producida por la concentracin de
protenas
La concentracin de protenas plasmticas es de 7.5 gr./%.
La concentracin de protenas del intersticio es de 2 gr./%
EFECTO DE LA OSMOLARIDAD DEL LQUIDO EXTRACELULAS
SOBRE LAS CLULAS.
16
17
SOLUCIONES ISOTNICAS:
Solucin glucosada al 5%.
Solucin salina al 0.9%.
Sol. Hartmann.
Clculo de OSMOLARIDAD:
2(Na+.) + 2(K+.) + (Urea) + (Glucosa)
2.8
18
18
CONTROL DEL METABOLISMO DEL AGUA.
La ingestin de agua est controlada por la S E D.
Cuando aumenta la osmolaridad del plasma , se activa el centro de la
SED en el HIPOTLAMO y se produce un pptido llamado HORMONA
ANTIDIURTICA (H.A.D) O VASOPRESINA que se acumula en la
hipfisis posterior de donde es secretada a la sangre.
La H.A.D. aumenta la permeabilidad del tbulo contorneado distal de
la nefrona reabsorbindose pasivamente agua, lo que diluye el plasma
y disminuye la osmolaridad.
Cambios de la osmolaridad plasmtica de 2% o ms son detectados
por los osmorreceptores hipotalmicos (muy sensibles a la
concentracin de glucosa y sodio plasmticos.)
DISTRIBUCIN DE LOS ELECTROLITOS EN EL ORGANISMO.
LQUIDO EXTRACELULAR: Catin ms abundante: Na+; Anin ms
abundante Cl-.
LQUIDO INTRACELULAR; Catin ms abundante: K+; Aniones ms
abundante: protenas y fosfatos (HPO 42-)
19
FORMULARIO DE AGUA Y ELECTROLITOS.
ELEMENTO
ClK+
Na+
Ca++
Mg++
S
SO4
PESO ATOMICO
35.4
39.0
23.0
40.0
24.3
32.0
96.0
VALENCIA.
1
1
1
2
2
2
2
Conversin de mg. a Meq.
Miligramos X valencia
= Meq.
Peso atmico
AGUA CORPORAL TOTAL (A.C.T.)
OSMOLARIDAD.
2 (Na+ + K+) + Urea + Glucosa
2.8
18
DEFICT DE SODIO.
(Sodio ideal sodio real) X agua corporal total (ACT).
DEFICIT DE POTASIO
(Valor mnimo de potasio normal potasio del paciente) X 70.
20
CONCENTRACIN DE IONES EN LOS LQUIDOS CORPORALES.
21
MICROCIRCULACION INTERCAMBIO TRANSCAPILAR
El cloruro de sodio y el bicarbonato de sodio son los
principales responsables de la presin osmtica en el plasma.
En el LEC encontramos:
K+ = 4-5 meq/L
Na+ = 144
Cl - = 103
En el LIC la osmolaridad est dada por potasio, proteinatos y
fosfatos.
Dentro y fuera hay 300 meq/L o miliosmoles. En el LEC, 247
meq corresponden al cloruro de sodio. (el suero fisiolgico es
fundamentalmente cloruro de sodio).
Efecto osmtico solo ejercen los elementos impermeables a la
membrana, porque hacen que cambien los flujos de agua; si
es permeable, no ejerce efecto osmtico porque se equilibra
adentro y afuera de la clula.
INTERCAMBIO A TRAVS DEL CAPILAR.
22
El capilar es el nico lugar donde se produce intercambio con
las clulas. Un capilar tiene una sola capa de clulas
endoteliales;
El capilar no tiene tono, no tiene msculo liso ni est
inervado, por lo que el intercambio depende de lo que ocurra
a nivel de las arteriolas y de las vnulas. Los vasos
arteriolares tienen msculo liso en abundancia, lo que les da
un tono y son de alta resistencia. Las vnulas son ms
anchas, no tienen tejido elstico y son vasos de capacitancia,
solamente contienen sangre.
Si aumenta la presin arteriolar, no sale ms lquido
intersticial porque las arteriolas disminuyen su lumen. Si
aumenta la presin venosa (insuficiencia cardaca) se va a
producir un edema porque el intersticio comienza a aumentar
su volumen.
Fuerzas que participan en el intercambio entre la
sangre y el lquido intersticial.
23
La nica sustancia que no atraviesa la membrana capilar y
que, por tanto, ejercen presin osmtica, son las protenas, lo
que se conoce como presin coloidosmtica u onctica.
La presin hidrosttica capilar (PHC) es la presin que ejerce
la sangre sobre el capilar y que produce filtracin de la sangre
al LIS (lquido intersticial).
Fuerzas que participan en el intercambio entre la
sangre y el lquido intersticial.
La presin onctica plasmtica (POP) produce reabsorcin de
lquido hacia el interior del capilar.
La presin hidrosttica capilar es mayor en el lado arteriolar y
menor en el venoso (35 y 15). La presin onctica es la misma
a lo largo del capilar (25 mmHg).
Hay una presin hidrosttica intersticial (PHI), que es de cero;
y una presin onctica intersticial (POI) que es prcticamente
de cero porque las protenas no pasan, y si pasan las capta el
sistema linftico
FILTRACIN
Coeficiente de filtracin = K
Presin hidrosttica capilar = Phc
Presin hidrosttica intersticial = Phi
Presin osmtica del plasma = Op
Presin osmtica intersticial = Oi
F = K(Pc+Oi-Pi-Op)
Extremo arterial
Phc = 35
Op = 25
Egreso neto = 10
Phi = 0
Oi = 0
Extremo venoso
Flujo
Phc = 15
Op = 25
Ingreso neto = 10
Phi = 0
Oi = 0
24
MICROCIRCULACION - INTERCAMBIO
TRANSCAPILAR.
Aumento de la presin hidrosttica capilar, puede ser
producto de:
1. Aumento de la presin arterial
2. Aumento de la resistencia venosa
3. Disminucin de la resistencia arteriolar
4. Aumento de la presin venosa.
Disminucin de la presin onctica plasmtica por un
dficit en la ingesta, disminucin de la sntesis o aumento de
excrecin de protenas por el rin.
Bloqueo linftico
Aumento permeabilidad capilar: txicos de araas,
quemaduras extensas.
También podría gustarte
- El Edema y La OsmolaridadDocumento4 páginasEl Edema y La OsmolaridadJuleides De LeonAún no hay calificaciones
- TP #4. Farmacologia - Calculo de Dosis - Factor GoteoDocumento14 páginasTP #4. Farmacologia - Calculo de Dosis - Factor GoteoAlexander MaximilianoAún no hay calificaciones
- Funciones de Los Capilares Sanguimeos y LinfaticosDocumento3 páginasFunciones de Los Capilares Sanguimeos y Linfaticosingjuanc1971Aún no hay calificaciones
- CirculaciónDocumento3 páginasCirculaciónRoinel PerezAún no hay calificaciones
- BonaccorsiDocumento8 páginasBonaccorsiSir-SaenzAún no hay calificaciones
- Leccion 2 Bio PDocumento10 páginasLeccion 2 Bio PEstefania TorresAún no hay calificaciones
- Revisión del edema pulmonar no cardiogénico (EPNCDocumento9 páginasRevisión del edema pulmonar no cardiogénico (EPNCGabriel RamirezAún no hay calificaciones
- Sistema Cardiovascular FinalDocumento29 páginasSistema Cardiovascular FinalAnuar AlejandroAún no hay calificaciones
- Fichas de LecturaDocumento7 páginasFichas de LecturaFernando Taboada LozanoAún no hay calificaciones
- Análisis bioquímicos de líquidos biológicosDocumento81 páginasAnálisis bioquímicos de líquidos biológicosRobert Caballero BardalesAún no hay calificaciones
- Datos KwashiorkorDocumento5 páginasDatos KwashiorkorAlejandra GutiérrezAún no hay calificaciones
- Clase Sistema LinfáticoDocumento18 páginasClase Sistema LinfáticoCOMPUS GUERREROAún no hay calificaciones
- Filtrado Glomerular, Mapa ConceptualDocumento1 páginaFiltrado Glomerular, Mapa ConceptualFlor HernandezAún no hay calificaciones
- Síndrome de fuga capilar: causas y tratamientoDocumento3 páginasSíndrome de fuga capilar: causas y tratamientodoidocrazy9268Aún no hay calificaciones
- Homeostasis y Medio InternoDocumento89 páginasHomeostasis y Medio InternoMiguel PincayAún no hay calificaciones
- Fisiologia y Metabolismo ElectroliticoDocumento34 páginasFisiologia y Metabolismo ElectroliticoLisseth BendezuAún no hay calificaciones
- ABP Miercoles EdemaDocumento10 páginasABP Miercoles EdemaJoan QuishpeAún no hay calificaciones
- Grupal 5 Sistema CardiovascularDocumento30 páginasGrupal 5 Sistema CardiovascularAnuar AlejandroAún no hay calificaciones
- Presión Osmotica - Presión OncoticaDocumento1 páginaPresión Osmotica - Presión OncoticaferAún no hay calificaciones
- Bases Fisicas de La CirculaciónDocumento76 páginasBases Fisicas de La CirculaciónJose Marco Muñoz BocanegraAún no hay calificaciones
- Homeostasis LEC, Eje Hipotalamo Hipofisis Renal Sodio RAAS 2018 PDFDocumento39 páginasHomeostasis LEC, Eje Hipotalamo Hipofisis Renal Sodio RAAS 2018 PDFAnonymous JLg5WIoHAún no hay calificaciones
- Primer Parcial UC11 2021 Turno 2 Original Con RespuestasDocumento8 páginasPrimer Parcial UC11 2021 Turno 2 Original Con RespuestasLuciana SosaAún no hay calificaciones
- MicocirculaciónDocumento6 páginasMicocirculaciónAnonymous alzR2b1pqAún no hay calificaciones
- Homeostasis y Medio InternoDocumento93 páginasHomeostasis y Medio InternocaritoAún no hay calificaciones
- Equilibrio de StarlingDocumento9 páginasEquilibrio de StarlingJaviera AriasAún no hay calificaciones
- Circulación sanguínea: transporte de oxígeno y nutrientesDocumento7 páginasCirculación sanguínea: transporte de oxígeno y nutrientesGuadalupe Arenas RosasAún no hay calificaciones
- Capitulo 25 - GuytonDocumento21 páginasCapitulo 25 - Guytondiana paola moraAún no hay calificaciones
- Regulación agua corporal y concentración plasmática sodioDocumento10 páginasRegulación agua corporal y concentración plasmática sodioCesar Cedeño CarpioAún no hay calificaciones
- ATP6Documento5 páginasATP6Natalia Salazar CamposAún no hay calificaciones
- Filtración GlomerularDocumento18 páginasFiltración Glomerularkaren velasquezAún no hay calificaciones