Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Practica Nº4, PH, Sol Reguladoras
Cargado por
Dam_TTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Practica Nº4, PH, Sol Reguladoras
Cargado por
Dam_TCopyright:
Formatos disponibles
Prctica No. 4.
pH, soluciones reguladoras e indicadores
Prctica N 4
pH,
soluciones
indicadores.
reguladoras
Propsito:
Demostrar experimentalmente mediante el uso del medidor de pH, el
comportamiento de los electrolitos fuertes y dbiles. Comprobar el
amortiguamiento de una solucin reguladora de pH.
PARTE 1. MARCO TERICO.
1. Principios bsicos de cidos y bases.
En esta seccin se revisarn algunos principios bsicos de la qumica de
los cidos y bases, los cuales permitirn la comprensin del concepto de
pH. Entre stos se tiene:
1.1. Electrolito.
Es una sustancia cuya disociacin o ionizacin en solucin los hace
capaces de conducir la corriente elctrica.
La disociacin, es la separacin de los iones, ya presentes en un
compuesto inico, a medida que sus cristales se dividen durante el
proceso de disolucin. Por ejemplo:
NaCl
(s)
H O
2 Na
NaOH(s)
Na2SO4
(ac)
Cl
(ac)
H O
2 Na(ac)
OH(ac)
H O
2 2 Na(ac)
SO24 (ac)
La ionizacin, es la formacin de iones por medio de una reaccin
qumica de un compuesto molecular con el disolvente. Por ejemplo:
HCl(g)
Clorurode
Hidrgeno
NH3 (g)
Amonaco
H2O (l)
H2O
H(ac)
Cl(ac)
AcidoClorhdric
o
(l)
NH
OH(ac)
4 (ac)
Hidrxidode Amonio
1.2. Clasificacin de los electrolitos.
Los electrolitos se pueden clasificar en:
Electrolitos fuertes, aquellos que en disolucin, se encuentran
totalmente disociados, es decir, existen solamente como iones.
55
Prctica No. 4. pH, soluciones reguladoras e indicadores
Ejemplos; cidos como el cido clorhdrico, HCl, el cido sulfrico,
H2SO4, etc. Bases como el hidrxido de sodio, NaOH, el hidrxido
de potasio, KOH, etc, y sales como el cloruro de sodio, NaCl y el
sulfato de sodio, Na2SO4, entre otras.
Electrolitos dbiles, aquellos que en disolucin, se encuentran
parcialmente disociados en sus iones, es decir, existen como
molculas y iones. Ejemplos; cidos como el cido carbnico,
H2CO3, el cido actico, CH3COOH. Bases como el hidrxido de
amonio, NH4OH, entre otros.
1.3. Los cidos, bases y sales como electrolitos.
Los cidos segn Brnsted y Lowry, son donadores de protones y las
bases son receptoras de protones. Los cidos se pueden clasificar como:
- cidos fuertes: dentro de los que se pueden mencionar, a manera
de ejemplo:
HO
cido clorhdrico:
HCl(g) 2 H (ac)
Cl (ac)
cido ntrico:
cido sulfrico:
-
HNO3
(l)
H2SO4(l)
(ac)
NO
H2O
2 H (ac)
SO4
3 (ac)
2
(ac)
cidos dbiles: se mencionan algunas a manera de ejemplo:
cido actico: CH3COOH
cido carbnico:
HO
2 H
H+(ac) + CH3 COO-(ac)
(l)
H2CO3
H+(ac) + HCO3- (ac)
(l)
Las bases se pueden clasificar como:
- Bases fuertes: dentro de los que se pueden mencionar, a manera
de ejemplo:
HO
KOH 2 K OH
Hidrxido de potasio:
(s)
(ac)
(ac)
Hidrxido de sodio:
Hidrxido de calcio:
-
NaOH(s)
Ca(OH)2
(s)
H2O
Na (ac)
OH (ac)
HO
2 Ca 2(ac)
2( OH (ac)
)
Bases dbiles: se mencionan algunas a manera de ejemplo:
56
Prctica No. 4. pH, soluciones reguladoras e indicadores
Hidrxido de amonio: NH4OH
NH4+(ac) + OH-(ac)
Para los cidos y bases fuertes, la concentracin de los mismos coincide
con la de los iones hidrgeno o iones hidroxilos, respectivamente. As,
por ejemplo, una solucin de cido clorhdrico, HCl, 10 3 M, teniendo en
cuenta la disociacin del cido clorhdrico, HCl H+ + Cl-, origina una
concentracin molar de protones [H+] = 103 M.
Segn el grado de disociacin, los cidos y bases dbiles, sern ms o
menos fuertes; as, sern ms fuertes cuanto mayor sea su disociacin.
Esta disociacin viene regida por la denominada constante de
disociacin o ionizacin del cido o de la base, representadas, por lo
general, como Ka o Kb.
Para los sistemas, como el del cido actico (CH 3COOH) y el cido
carbnico (H2CO3), por ser cidos dbiles, se cumple:
Ka
CH COO
3
CH3COOH
(4.1)
Ka
HCO
H2CO3
(4.2)
y para la base dbil, como el caso del hidrxido de amonio, se cumple:
NH
4
Kb
OH
NH4OH
(4.3)
Estos conceptos permitirn, ms adelante, calcular el pH de un cido o
una base dbil.
Para el caso de las sales, se tiene que stas son compuestos
inicos cuyos cationes (iones positivos) son cualquiera, excepto el
in de hidrgeno H+, y cuyos aniones (iones negativos) son
cualquiera, a excepcin del in oxidrilo OH-. Por ejemplo:
HO
Cloruro de sodio:
NaCl(s) 2 Na (ac)
Cl (ac)
Sulfato de potasio:
K 2SO4(s)
2
H2O
2 K (ac)
SO4(ac)
57
Prctica No. 4. pH, soluciones reguladoras e indicadores
Tambin, las sales se definen como, la combinacin de un cido y una
base, por ejemplo, el bicarbonato de sodio (NaHCO 3) o el carbonato de
sodio (Na2CO3):
H2CO3 NaOH
H2CO3 2 NaOH
NaHCO3 H2O
Na2CO3 2 H2O
Las sales se pueden clasificar en: sales neutras, como el cloruro de sodio
(NaCl) o el sulfato de sodio (Na 2SO4), sales cidas, como el bisulfato de
sodio (NaHSO4) o el cloruro de amonio (NH4Cl), y en sales alcalinas,
como el carbonato de sodio (Na 2CO3) o el bicarbonato de sodio
(NaHCO3). Es importante sealar que, todas las sales son electrolitos
fuertes.
1.4. Actividad de electrolitos.
La actividad de electrolitos se define como la capacidad que tienen los
iones de desplazarse o moverse libremente, es decir, su capacidad para
funcionar como in, la cual vara con la concentracin de los iones
circundantes. Es razonable suponer que, un in rodeado de otros iones,
con carga igual u opuesta a la suya, y sometido a sus atracciones y
repulsiones, poseer distintas actividades conforme a las variaciones en
la concentracin de los iones circundantes.
La actividad de electrolitos (A) se calcula mediante la siguiente
expresin:
A=.C
(4.4)
donde; es el coeficiente de actividad y C es la concentracin molal.
En las soluciones muy concentradas de electrolitos, los aniones y
cationes no se desplazan con completa independencia y forman
enjambres de iones.
Por ello disminuye el nmero de partculas
libremente desplazables, y la concentracin activa o actividad de la
solucin es menor que la concentracin real.
En el caso de soluciones relativamente diluidas (0,1 M) de electrolitos
dbiles, en que las concentraciones inicas son bajas, los coeficientes de
actividad de iones presentes estn muy cerca de la unidad, es decir, la
actividad se iguala a la concentracin, A = C.
1.5. Ionizacin del agua.
Uno de los equilibrios ms importantes en la naturaleza, es la auto
ionizacin del agua. El agua, qumicamente pura, est constituida por
58
Prctica No. 4. pH, soluciones reguladoras e indicadores
una mezcla de especies: agua (H 2O), protones hidratados
hidrogeniones (H3O+ o H+) y aniones hidroxilo u oxidrilo (OH-).
La expresin de su equilibrio es:
OH- (ac)
H2O
(l)
+ H2 O
(l)
H3O+ (ac) +
Si se considera la actividad de estos iones, se tiene:
aH3O+ (ac) + aOH- (ac)
aH2O (l) + aH2O (l)
Esta ionizacin puede expresarse en la siguiente frmula qumica
equivalente:
H2O (l)
aH2O (l)
H+ (ac) + OH- (ac)
aH+ (ac) + aOH- (ac)
Aplicando la ley de equilibrio para este sistema se cumple que:
K eq
OH
H2O
(4.5)
Keq H2O = H+ OH-
(4.6)
que en trminos de la actividad equivale a:
a
a
H OH
K eq
(4.7)
aH2O
Keq aH2O = aH+ aOH-
(4.8)
La concentracin
g
997,07L
g
18 mol
molar por litro, del agua pura, es alrededor de
= 55,3 M. Adems, en el agua pura a 25C el 1,8 x 10-7% de sus
molculas se encuentran disociadas en H+ y OH-. Por tanto, se tiene que
la concentracin molar del agua es igual a 55,3 M, la concentracin
molar de protones ser 55,3 x 1,8 x 10-7% = 0.995 x 10-7 M y lo mismo
ocurre con los iones hidroxilos.
59
Prctica No. 4. pH, soluciones reguladoras e indicadores
Las concentraciones molares de H + y OH-, son extraordinariamente
pequeas, del orden aproximado de 1 x 10 -7 M, para cada uno de estos
iones a la temperatura de 25C.
Sustituyendo el valor de la concentracin molar del agua en la ecuacin
de equilibrio (4.8) se tiene:
K x [55,3] = [1x10-7] [1x10-7]
Entonces, el producto de una constante por otra constante es igual a
otra constante que se denomina producto inico del agua, y se
representa por Kw y equivale a 1 x 10 -14 M2, a 25 C. La conclusin de
ste planteamiento es que se puede calcular las concentraciones H + y
OH- en agua pura a partir de los valores de Kw.
Cuando H+ es igual a OH-, se tiene:
Kw = [H+] x [OH-] = [H+]
(4.9)
= [OH-]
y , por lo tanto [OH-]= [H+] = K w
(4.10)
Cabe destacar que, la actividad del agua (aH2O) pura puede considerarse
la unidad, su disociacin es despreciable y la actividad tanto de los iones
de hidrgeno (aH+) y de los iones oxidrilos (a OH-) se pueden confundir con
su concentracin. Por tanto, sustituyendo en la ecuacin (4.6), se
obtiene:
Keq x (1)= [H+] x [OH-]
Kw = [H+] x [OH-]
(4.11)
1.6. Relacin de H+ y OH- en soluciones.
La ecuacin KW = K [HOH] = [H+] [OH-] = 1 x 10-14 M2 a 25 C, no solo se
aplica al agua pura, sino tambin, a soluciones acuosas, en las cuales
[H+] y [OH-] pueden ser muy diferentes. As, enunciamos que, en
soluciones acuosas el producto de la concentracin molar del in
hidrgeno y del in hidroxilo es una constante, a la temperatura
ordinaria del laboratorio de 25 C, es 1 x 10-14 M2. Si se conoce [H+] u
[OH-] se puede calcular la concentracin desconocida utilizando la
ecuacin (4.11) como sigue:
60
Prctica No. 4. pH, soluciones reguladoras e indicadores
H
OH
Kw
OH
Kw
1 x 1014 M2
OH
1 x 1014 M2
Como es lgico, en el agua pura las concentraciones molares de iones
hidrogeniones y hidroxilos son iguales, [H +]= [OH-]= 1 x 10-7 M. Estos
valores son los que corresponden a una solucin neutra. Si al agua pura
se le aade cido, la concentracin molar de protones aumenta con
respecto a la de OH-, de forma que para una solucin cida la
concentracin de H+ > 1 x 10-7 M y OH- < 1 x 10-7 M. De forma anloga,
la adicin de una base determina que la concentracin de H + < 1 x 10-7
M y OH- > 1 x 10-7 M, condiciones que se producen en el caso de una
solucin bsica.
Debido al orden de magnitud tan nfimo de las concentraciones molares
de H+ y OH- que hace engorroso el trabajo rutinario, un bioqumico
dans de nombre Sreh Peter Srensen, estableci la denominada
escala de pH (abreviatura de potencial de hidrgeno), ya que el pH vara
proporcionalmente al potencial de un electrodo de hidrgeno introducido
en la solucin.
El pH se define como el logaritmo decimal de la actividad (a) de
protones, de iones hidrgeno, hidrogeniones o iones hidronio, con el
signo cambiado.
pH log a
H O
3
log
aH O
3
(4.12)
Pero, para concentraciones inferiores a 1 x 10 -2 M de iones de hidrgeno
la actividad puede sustituirse por la concentracin, caso ste, tpico de
las concentraciones usadas en el laboratorio, por tanto, se puede
calcular el pH mediante la siguiente expresin:
pH log H log
(4.13)
De la cual se puede obtener,
pH
1 x 10
(4.14)
donde H+ es el equivalente del protn hidratado, H3O+.
61
Prctica No. 4. pH, soluciones reguladoras e indicadores
Anlogamente, se pueden definir, pOH, pKa, pKb, pKw, pkind, etc.
De acuerdo al concepto de pH, matemticamente, se puede elaborar
una escala de pH que partira desde un valor mnimo de cero a un valor
mximo de catorce. La acidez o alcalinidad de una solucin estn
determinadas por las proporciones de iones H+ y OH- presentes en ellas.
El pH de una solucin 1 Molar de H+ es cero, y el de una solucin 1
Molar de OH- es catorce. La escala de pH que expresa la relacin entre
un cido fuerte 1 Molar se extiende de cero a catorce.
Aunque son posibles valores de pH por debajo de cero (negativos) y por
encima de catorce, la escala de cero a catorce cubre las fluctuaciones
prcticas de acidez y alcalinidad de las soluciones comunes.
En funcin del pH, la soluciones pueden clasificarse en: Neutra (pH=7),
cida (pH<7) y bsica (pH>7). Como se muestra en la tabla No.1:
[H+],
mol/L
1x100
1x10-1
1x10-2
1x10-3
1x10-4
1x10-5
1x10-6
1x10-7
1x10-8
1x10-9
1x10-10
1x10-11
1x10-12
1x10-13
1x10-14
Log [H+]
pH
0
-1
-2
-3
-4
-5
-6
-7
-8
-9
-10
-11
-12
-13
-14
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
Neutro
Alcalinidad creciente
[OH-],
mol/L
1x10-14
1x10-13
1x10-12
1x10-11
1x10-10
1x10-9
1x10-8
1x10-7
1x10-6
1x10-5
1x10-4
1x10-3
1x10-2
1x10-1
1x100
Acidez creciente
Tabla No.1. pH para diversas concentraciones de protones y hidroxilos.
Fuente: Estimaciones y clculos propios.
1.7. Frmulas para calcular el pH aproximado de soluciones:
Para cidos fuertes: Empleando la ecuacin (4.13)
pH log H log
H
62
Prctica No. 4. pH, soluciones reguladoras e indicadores
Para cidos dbiles:
pH
1
1
pKa
logC
2
2
(4.15)
es decir, se debe conocer el pKa y la concentracin (C) del cido dbil.
Para bases fuertes:
pH pOH 14
(4.16)
pH 14 pOH
(4.17)
pOH log OH log
(4.18)
Para bases dbiles:
pOH
OH
1
1
pKb
logC
2
2
(4.19)
es decir, se debe conocer el pK b y la concentracin (C) de la base
dbil.
En este caso, es preferible calcular el pOH, y posteriormente el pH. La
frmula es ms fcil de recordar y se parece a la de un cido dbil. Es
empleando las ecuaciones (4.16) y (4.17).
pH + pOH = 14
pH = 14 - pOH
Para sales de un cido dbil y una base fuerte:
pH
(4.20)
pH 7
(4.21)
1
1
1
pK W
pK a
log C
2
2
2
1
1
pK a
log C
2
2
1.8.
Soluciones
reguladoras
del
pH
(tampones,
buffers
o
amortiguadores).
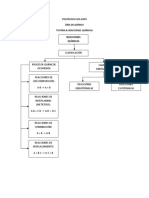
Son todas aquellas soluciones que impiden cambios bruscos de pH
cuando se le aaden cantidades adecuadas de cidos o bases. Son
soluciones formadas por:
63
Prctica No. 4. pH, soluciones reguladoras e indicadores
Un cido dbil y la sal de su base conjugada; por ejemplo, cido
actico/acetato de sodio, que son las ms comunes.
Una base dbil y la sal de su cido conjugado; por ejemplo,
amonaco/cloruro amonio.
Su importancia radica en el hecho que estas soluciones permiten la
calibracin de los medidores de pH, y adems, permite entender el
efecto amortiguador del in bicarbonato.
El mecanismo de accin de estas soluciones se presenta a continuacin:
Adicin de cidos fuertes: cuando se aade un cido fuerte a una
solucin tampn los protones provenientes del cido se unen con los
aniones de la sal formndose el respectivo cido dbil, esto implica que
la concentracin de la sal disminuye y la concentracin del cido dbil
aumenta, como se muestra en las siguientes reacciones qumicas:
CH3COOH
H+ + CH3COOH + (cido fuerte
Tampn
aadido)
CH3COONa
Na+ + CH3COOCl-
Adicin de bases fuertes: cuando se adiciona una base fuerte a una
solucin tampn los oxhidrilos o hidroxilos se unen con los protones del
cido dbil formndose agua, esto implica que la concentracin del
cido disminuye y la concentracin de la sal aumenta, sus reacciones
qumicas se muestran a continuacin:
OH- (base fuerte aadida)
CH3COOH
Na+
H + CH3COO+
Tampn
CH3COONa
Na+ + CH3COO-
Ecuacin para calcular el pH de una solucin tampn. Se utiliza la
ecuacin de Henderson-Hasselbalch, cuya deduccin se presenta en el
anexo de sta prctica.
64
Prctica No. 4. pH, soluciones reguladoras e indicadores
pH pKa log
pH pKa log
Anin
Acido
(4.22)
Aceptorde protones
Donadorde protones
(4.23)
Comnmente se utiliza la siguiente expresin;
pH pKa log
Sal
Acido
(4.24)
y si se cumple que [Sal] = [cido], la ecuacin (4.24) queda como:
pH = pKa
Para el caso de aadir una base fuerte, se cumple en la ecuacin de
Henderson-Hasselbalch (4.22), lo siguiente:
pH pKa log
(4.25)
Sal Base aadida
Acido Base aadida
Adicin cidos fuertes. Para el caso de aadir un cido fuerte, se cumple
en la ecuacin de Henderson-Hasselbalch (4.22), lo siguiente:
pH pKa log
Sal Acido aadido
Acido Acido aadido
(4.26)
1.9. Algunas recomendaciones para la preparacin de soluciones
amortiguadoras.
- Todas las sustancias qumicas empleadas deben ser de buena
calidad.
65
Prctica No. 4. pH, soluciones reguladoras e indicadores
Toda el agua debe ser destilada o privada de iones. Para buffer
diludos se debe hervir y enfriar el agua antes del uso para eliminar el
CO2 disuelto.
En los amortiguadores que contienen un cido fuerte, por ejemplo el
HCl, la solucin cida se debe estandarizar cuidadosamente por
titulacin hasta la molaridad deseada.
Todas las pesadas se deben hacer en balanza analtica.
La verificacin del pH de un amortiguador debe hacerse con un
potencimetro estandarizado con una solucin amortiguadora de pH
conocido cercano a la solucin amortiguadora a preparar. Existen en
el comercio soluciones patrones de amortiguadores.
En general, las soluciones amortiguadoras concentradas se conservan
mejor que las diluidas, y presentan menos desarrollos de hongos. Se
aconseja conservarlas en frascos de polipropileno cerca de 4 grados
Celsius.
1.10. Indicadores.
Son colorantes orgnicos de estructura compleja la cual se altera,
cuando se pierden o ganan hidrgenos, es decir, se comportan como
cido o base.
Generalmente, se consideran como cidos o bases dbiles cuya forma
disociada tiene un color diferente al de la forma no disociada. Si se
representa un indicador cido como Ind H, se tiene:
Ind H + H2O
Color cido
H3O+ + IndColor alcalino
Cuando se aade cierta cantidad de cido a una solucin del indicador,
se aumenta la concentracin de los iones hidronio (H 3O+) del segundo
miembro de la ecuacin, el equilibrio se desplaza hacia la izquierda de la
ecuacin, quedando reprimida la liberacin de los iones hidrgenos del
indicador. El indicador se encontrar, predominantemente, en la forma
no disociada (Ind H), tomando el color cido.
Si se aade una base a una solucin del indicador, disminuye la
concentracin de iones hidronio (H3O+), por la reaccin del cido con la
base, el equilibrio se desplaza a la derecha de la ecuacin, formndose
ms indicador ionizado Ind-, y predominando el color bsico.
66
Prctica No. 4. pH, soluciones reguladoras e indicadores
Calculando la constante del indicador se tiene:
K Ind
H3O
Ind
Ind H
(4.27)
KInd [Ind H] = [H3O+] [Ind-]
(4.28)
Ind
Ind H
K Ind
H O
(4.29)
Segn lo anterior, el color de la solucin depende de la relacin:
Ind
Ind H
Cuando la relacin
K
y del valor:
Base
o
1,
Ind H cido
Ind
Ind
H O
un indicador exhibe un color
medio (neutro).
Las formas, disociada, aninica y la no disociada o molecular, del
indicador estn en igual proporcin.
Si el valor de la relacin es grande, predomina la forma aninica sobre la
molecular, el color ser el color alcalino (forma disociada). De lo
contrario, si el valor de la relacin es pequeo, predomina la forma
molecular no disociada sobre la forma aninica disociada, en este caso
el color ser el color cido del indicador (forma no disociada).
Para un cierto intervalo de pH las dos formas coexisten en cantidades
apreciables y la solucin muestra un color intermedio al correspondiente
a cada una de ellas. De igual forma, se puede decir que el color de la
solucin del indicador cambia con el pH.
Es importante sealar que, cuando un indicador ha sido titulado hasta la
mitad, el 50% del indicador esta presente como base y el otro 50% como
cido, y la razn entre la base del indicador y el cido del indicador es 1,
por consiguiente, el pH de la solucin del indicador en este momento es
igual al pKInd entonces el indicador presenta un color intermedio.
67
Prctica No. 4. pH, soluciones reguladoras e indicadores
Para los indicadores bsicos se puede deducir una relacin entre el color
y el pH, anloga a la que es valida para los indicadores cidos, como se
presenta a continuacin.
Ind+ + OH-
Ind OH
Para este caso, en solucin acuosa predomina el color de las molculas
de Ind OH, pero la adicin de un cido aumenta la concentracin del in
Ind+, desplazando el equilibrio a la derecha de la ecuacin originando un
nuevo color.
1.11. Ecuacin del pH de la solucin de indicadores.
Aplicndole logaritmos a la expresin (4.27):
H3O Ind
Ind
Ind H
y despejando el pH, se obtiene,
Ind
pH pKInd log
HInd
pH pKInd log
(4.30)
Base
Acido
As, como en una solucin reguladora de pH presentaba su mxima
capacidad cuando pH=pKa,, un indicador presenta un color medio
(neutro) cuando pH=pKInd.
El intervalo ms eficiente del indicador, que equivale al intervalo de
actividad de un tampn es, aproximadamente, de dos unidades de pH,
pKInd 1. Se sabe, por experiencia, que no se puede apreciar el cambio
del color cido al color de la sal o base conjugada, hasta que la razn
(base / cido) sea, aproximadamente 1/10. Es decir, ha de haber, al
menos una parte del color bsico por diez partes del color cido, antes
de que se pueda apreciar el cambio de color cido-bsico en forma
visual. Esto se explica sustituyendo los valores en la ecuacin (4.30).
pH pKInd log
1
pKInd 1
10
Recprocamente, el ojo humano no puede distinguir el cambio de color
alcalino a color cido hasta que la razn (base / cido) no sea diez veces
68
Prctica No. 4. pH, soluciones reguladoras e indicadores
la concentracin de la base por una del cido. Como se observa
utilizando la ecuacin (4.30).
pH pKInd log
10
pKInd 1
1
A continuacin se presenta, en forma tabulada, algunos de los
indicadores de uso ms frecuente.
Tabla No. 2. Indicadores de uso frecuente
Indicador
Azul de timol
cido
Rojo
Anaranjado
metilo
Rojo de metilo
de Rojo
Azul
bromotimol
Rojo de cresol
de Amarillo
Fenolftalena
Amarillo
alizarina
Azul de timol
Incoloro
de Amarillo
Rojo
Amarillo
Amarillo
Color
Neutro
Anaranjad
o
Anaranjad
o
Anaranjad
o
Verde
Interval
Alcalino o de pH
Amarillo
1,2 - 2,8
pKInd
Amarillo
3,1 - 4,4
3,40
Amarillo
4,4 - 6,2
4,95
Azul
6,2 - 7,6
7,1
Anaranjad Rojo
o
Rosado
Rojo
-----Lila
7,2 - 8,8
8,2
Verde
Azul
1,65
8,0 - 10,0 9,4
10,0 11,16
12,0
8,0 - 9,6
8,9
Fuente: Manual de qumica, John A. Dean.
En la tabla No. 2 se indica, por ejemplo, que para el indicador
anaranjado de metilo el intervalo del viraje ocurre entre el pH de 3,1
(color rojo) y el pH de 4,4 (color amarillo), esto significa que el viraje
pronunciado ocurre entre estos dos valores de pH. Es decir, cuando se
aade cido, teniendo en la solucin el indicador de anaranjado de
metilo, presenta color rojo (color cido) alrededor de pH=3. Cuando se
aade una base, su color ser el alcalino, es decir amarillo, siempre y
cuando el pH sea aproximadamente de 4. Mientras que, en el intervalo
entre 3,1 a 4,4, su color ser el neutro, es decir, anaranjado.
1.12. Determinacin del pH mediante el mtodo electromtrico o
potenciomtrico.
Las mediciones exactas del pH se realizan mediante la utilizacin de un
potencimetro o medidor de pH, que mide la diferencia de potencial
entre un electrodo indicador y un electrodo de referencia, produciendo
una lectura en unidades de pH.
Los electrodos comnmente usados para medir el pH son el electrodo de
vidrio, Ev, electrodo indicador, que desarrolla un potencial a travs de su
69
Prctica No. 4. pH, soluciones reguladoras e indicadores
membrana semipermeable de vidrio como una funcin de la actividad de
protones, y el potencial del electrodo de Calomel (electrodo de
referencia), que tiene un potencial fijo independiente de la actividad de
los protones.
El electrodo de vidrio consiste en una delgada membrana de vidrio
especial que contiene un alambre de Ag-AgCl y una solucin patrn de
referencia ( HCl 0,1 M u otra concentracin).
El electrodo de referencia est formado por cloruro de mercurio slido
(Hg2Cl2, calomelano) sobre mercurio metlico.
La fuerza electromotriz de la pila formada por estos electrodos, E, viene
dada por la ecuacin:
E 0,06log H
(4.31)
donde E = Ev Eref, es decir, la diferencia de potencial entre los dos
electrodos. Por consiguiente, se tiene:
pH
Ev Eref
0,06
(4.32)
PARTE 2. MARCO EXPERIMENTAL.
1. Materiales y equipos.
Medidor de pH.
Aparato para la destilacin de agua.
Balanza.
Pipetas volumtricas y graduadas.
Vasos de precipitado.
Agitador magntico.
Matraces Erlenmeyer o fiolas.
2. Reactivos.
Solucin
Solucin
Solucin
Solucin
Solucin
de
de
de
de
de
cido actico (CH3COOH), 0,1 M.
cido clorhdrico (HCl), 0,1 M.
hidrxido de amonio (NH4OH), 0,1 M.
hidrxido de sodio (NaOH), 0,1 M.
acetato de sodio (CH3COONa), 0,1 M.
3. Experimentos
3.1. Experimento N 1.
70
Prctica No. 4. pH, soluciones reguladoras e indicadores
Comparar el pH del agua cuando se adicionan un cido dbil, un cido
fuerte, una base dbil y una base fuerte.
Procedimiento:
1. Tomar y enumerar cuatro vasos de precipitado de capacidad
adecuada, colocar 49 mL de agua destilada en cada uno.
2. Agregar a cada vaso de precipitado las cantidades de reactivos
sealados en el cuadro siguiente:
Vaso de
precipitado
N
Agua destilada
(mL)
CH3COOH
0,1 M
(mL)
HCl
0,1 M
(mL)
NH4OH
0,1 M
(mL)
NaOH
0,1 M
(mL)
1
2
3
4
49
49
49
49
1
-
1
-
1
-
3. Determinar potenciomtricamente el pH de cada uno.
4. Determinar tericamente el pH la las soluciones de los vasos N
1,2, 3 y4.
5. Discutir los resultados obtenidos.
3.2. Experimento N 2.
Demostracin del comportamiento de una solucin Tampn, Buffer o
amortiguadora.
Procedimiento:
1. Preparar una solucin tampn cido actico-acetato mezclando en
un vaso de precipitado 40 mL de cido actico 0,1 M con 40 mL de
acetato de sodio 0,1 M.
2. Determinar el pH de la solucin potenciomtricamente o calcular
el pH aproximadamente segn la ecuacin Henderson
Hasselbalch, (4.22).
3. Seleccionar y enumerar dos vasos de precipitado.
4. Al vaso N 1 colocar 39 mL del tampn y agregar un mL de cido
clorhdrico (HCl) 0,01 M, agtelo.
5. Medir el nuevo pH de la solucin.
6. Repitir el mismo procedimiento con el vaso N 2, pero agregndole
un mL de hidrxido de sodio (NaOH) 0,01 M.
7. Discutir los resultados obtenidos.
Tabla No. 3. Constantes de disociacin de cidos dbiles
Compuesto Qumico
cido oxlico
cido fosfrico
Frmula
(COOH)2
H3PO4
Ka
3,80 x 10-2
7,50 x 10-3
pKa
1,42
2,12
71
Prctica No. 4. pH, soluciones reguladoras e indicadores
cido cloroactico
ClCH2CO2H
cido frmico
HCO2H
cido actico
CH3CO2H
Ftalato cido de potasio
KHC8H4O4
cido carbnico
H2CO3
Fosfato dicido
de
KH2PO4
potasio
cido brico
H3BO3
Bicarbonato de sodio
NaHCO3
Fosfato monocido de
K2HPO4
potasio
Hidrxido de amonio
NH4OH
1,40 x 10-3
1,80 x 10-4
1,75 x 10-5
3,90 x 10-6
3,5 x 10-7
6,23 x 10-8
2,85
3,74
4,76
5,41
6,46
7,19
5,8 x 10-10
9,23
5,59 x 10-11 10,25
1,70 x 10-12 11,77
pKb
4,76
Fuente: Qumica orgnica. Francis A. Carey.
PARTE 3. CUESTIONARIO.
1. Calcular tericamente el pH aproximado de una solucin de cido
clorhdrico (HCl) 0,1 M.
2. Calcular el pH de una solucin de cido actico (CH 3COOH) 0,1 M,
conocido el pKa = 4,76.
3. Calcular el pH de una solucin de hidrxido de sodio (NaOH) 0,1 M.
4. Calcular el pH de una solucin hidrxido de amonio (NH 4OH) 0,1
M, pKb=4,76.
5. Calcular el pH de una solucin de cido sulfrico (H2SO4) 0,1 M.
2
H2SO4(l) H2O(l) 2 H (ac)
SO4(ac)
por lo tanto la concentracin molar de protones es dos veces la
concentracin molar de la solucin. [H+] = 0,2 M
6. Calcular el pH de una solucin de hidrxido de calcio, Ca(OH) 2, 0,1
M.
7. Si la concentracin molar de protones, H +, es igual a 2,3 x 10-3,
Cul es el valor del pH?, mentalmente usted debe tener una idea
del resultado antes de realizar el clculo.
8. Calcular el pH de 50, 100 y 500 mL de agua al agregarle a cada
uno de estos volmenes 0,020 moles de cido clorhdrico, HCl.
72
Prctica No. 4. pH, soluciones reguladoras e indicadores
9. Calcular el pH de 50, 100 y 500 mL de agua al agregarle a cada
uno de estos volmenes 0,020 moles de hidrxido de sodio, NaOH.
10.
Se encontr que el pH de una muestra de agua es de 4,5
Cual es su
concentracin molar de protones?
11.
Calcule el pH de una solucin de bicarbonato de sodio,
NaHCO3, 0,04 molar (pka1 = 6,5).
12.
Calcule el pH de una solucin de carbonato sdico, Na 2CO3,
0,04 molar (pKa2=10,2).
13.
Si una solucin tiene un pH de 7,0 y pasa a pH 6,0 Cuantas
veces aument la concentracin molar de protones?
14.
Para una solucin amortiguadora, formada por cido actico
0,18 M y acetato de sodio 0,22 M. Calcular:
a) el pH de la solucin amortiguadora.
b) el pH de la solucin despus de agregarle 1 mL de cido
clorhdrico, HCl, 0,2 N.
c) el pH de una nueva muestra de solucin amortiguadora al
agregarle 1 mL de hidrxido de sodio, NaOH, 0,2 N.
73
Prctica No. 4. pH, soluciones reguladoras e indicadores
REFERENCIAS BIBLIOGRFICAS.
Carey, F. A., Qumica orgnica,3a edicin, McGraw Hill, Interamericana
de Bogot, 1999, p. 115-119, 311, 314-315, 507, 651, 685-689, 797-798
y 871.
Dean, J. A., Manual de Qumica. 13era edicin, Tomo II, McGraw Hill,
Interamericana Editores, S.A. 1985, p. 5-117 y 5-118.
Departamento de Qumica, Facultad de Ciencias, Universidad de
Los Andes, Manual de Laboratorio de Qumica General, Facultad de
Ciencias-Consejo de Publicaciones, Universidad de Los Andes. Mrida,
Venezuela,1984, p. 105-110.
Gray, H. B. y Haight, G. P., Principios Bsicos de Qumica. Editorial
Revert, S.A. Barcelona, Espaa 1969, secciones: 6-5, 16-4 y 16-8.
Kemmer, F. N. Y McCallion, J., Manual del Agua. Nalco Chemical
Company. Tomo I. McGraw Hill, Interamericana de Mxico, S.A., 1989, p.
3-6.
Lynch, J. M., Raphael, S. S., Mellor, L. D., Spare, P. D. y Inwood,
M. J., Mtodos de Laboratorio. Nueva Editorial Interamericana, S.A.,
1972, p. 1447.
Lleonart, M. y Mir, J., Problemas de Qumica General, 2 edicin,
Ediciones Bellaterra, S.A. Barcelona, Espaa, 1979, p. 165-174.
Maham, B. H., Curso Universitario de Qumica.
Interamericano, S.A. 1968. p. 195, 199 y 200.
Fondo Educativo
Phillips, J. S., Strozak, V.S. y Wistrom, Ch., Qumica Conceptos y
Aplicaciones. McGraw Hill, Interamericana Editores, S.A. Enero 2001, p.
516, 525 y 531.
Rengel, M., Anotaciones sobre Prcticas de Laboratorio de Ingeniera
Ambiental, Facultad de Ingeniera, Universidad de Los Andes, Mrida,
Venezuela, 2000.
Sawyer, C. N., McCarty, P. L. y Parkin, G. F., Qumica para Ingeniera
Ambiental,4a edicin, McGraw Hill, Interamericana de Bogot, Octubre
2000, p. 494-499.
74
Prctica No. 4. pH, soluciones reguladoras e indicadores
ANEXOS.
A.1. Deduccin de la ecuacin de Henderson Hasselbalch.
Si se representa un cido dbil AH, la mayor parte del mismo se
encuentra en forma no disociada, con una fraccin muy pequea de
iones A- y H+. Por ello, al aadir la sal correspondiente casi la totalidad
de los aniones (A-) en solucin proceden de la misma. Por tanto, para las
soluciones amortiguadoras diluidas, se puede considerar que la
concentracin del cido no disociado (AH) es igual a la concentracin
total del cido y la concentracin del anin o base conjugada (A -) es
igual a la concentracin total de la sal.
Aplicando la ley de accin de masas al siguiente equilibrio, se consigue:
H+ + A-
AH
Ka
H A
AH
despejando H+, se obtiene,
ka
A H
A
Al aplicar logaritmo a ambos lados:
log H
A H
logK a log
A
log H logK a log A H log A
multiplicando por (-1) la ecuacin, se tiene:
log H logK a log A H log A
considerando las definiciones de pH y pKa, se tiene que:
pH pK a log
A
A H
o lo que es igual;
75
Prctica No. 4. pH, soluciones reguladoras e indicadores
pH pKa log
Aceptorde protones
Donadorde protones
Usualmente, se utiliza la siguiente expresin:
pH pKa log
Sal
Acido
A.2. Preparacin amortiguador de fosfato(lmites de pH 5,7 a 8,0).
1. Solucin A: Preprese un litro de solucin 0,2 M de fosfato
dicido de sodio monohidratado (NaH2PO4.H2O), masa molecular =
138 g/mol.
2. Solucin B: Preprese un litro de solucin 0,2 M de fosfato
monocido de sodio (Na2HPO4), masa molecular = 142 g/mol.
3. Se mezclan los volmenes de las soluciones A y B segn la
tabla anexa, y se afora a 200 mL para obtener los valores
correspondientes de pH;
Tabla No. 4. Preparacin amortiguador de fosfatos.
Solucin A
(mL)
93,5
92,0
90,0
87,7
85,0
81,5
77,5
73,5
68,5
62,5
56,5
51,0
45,0
39,0
33,0
28,0
23,0
19,0
16,0
13,0
10,5
Solucin B (mL)
pH
6,5
8,0
10,0
12,3
15,0
18,5
22,5
26,5
31,5
37,5
43,5
49,0
55,0
61,0
67,0
72,0
77,0
81,0
84,0
87,0
90,5
5,7
5,8
5,9
6,0
6,1
6,2
6,3
6,4
6,5
6,6
6,7
6,8
6,9
7,0
7,1
7,2
7,3
7,4
7,5
7,6
7,7
76
Prctica No. 4. pH, soluciones reguladoras e indicadores
8,5
7,0
5,3
91,5
93,0
94,7
7,8
7,9
8,0
Fuente: Mtodos de laboratorio, Lynch J. M., et. al.
77
También podría gustarte
- Quimica I Clase 1 y LaboratorioDocumento42 páginasQuimica I Clase 1 y Laboratorioannthony sebastianAún no hay calificaciones
- Acidos y Bases Poliproticos Final Ahora SiDocumento18 páginasAcidos y Bases Poliproticos Final Ahora SiIvan Cuauhtemoc Nuñez RamirezAún no hay calificaciones
- 4.-Introduccion Al Equilibrio Acido-BaseDocumento25 páginas4.-Introduccion Al Equilibrio Acido-Basemehow94461Aún no hay calificaciones
- Ácidos y bases: Preparación de un buffer de fosfatosDocumento6 páginasÁcidos y bases: Preparación de un buffer de fosfatosOrnella BrogliaAún no hay calificaciones
- Ácidos y bases: titulación y propiedadesDocumento9 páginasÁcidos y bases: titulación y propiedadesingrossAún no hay calificaciones
- Acidos y Bases BronstedDocumento4 páginasAcidos y Bases BronstedmorenomAún no hay calificaciones
- Capitulo 1 - Ecuaciones IonicasDocumento7 páginasCapitulo 1 - Ecuaciones IonicasWendy Torres GonzalezAún no hay calificaciones
- Guía IV Medio Segunda Parte Ácidos Bases Química. LabDocumento4 páginasGuía IV Medio Segunda Parte Ácidos Bases Química. LabLiceo Andrés Bello-ComunicacionesAún no hay calificaciones
- Mod 4 P3 Equilibrio Acido Base 2021Documento13 páginasMod 4 P3 Equilibrio Acido Base 2021Nico BarriosAún no hay calificaciones
- Disoluciones iónicas y reacciones de precipitaciónDocumento32 páginasDisoluciones iónicas y reacciones de precipitaciónNivelo SaidAún no hay calificaciones
- HidrlisisDocumento11 páginasHidrlisisMatías N. AndiónAún no hay calificaciones
- Unidad 10 Uba XxiDocumento6 páginasUnidad 10 Uba XxiPaulaAún no hay calificaciones
- Ácidos y bases: pH, electrolitos y equilibrio químicoDocumento44 páginasÁcidos y bases: pH, electrolitos y equilibrio químicoversion3Aún no hay calificaciones
- U 10 Ácidos y BasesDocumento6 páginasU 10 Ácidos y BasesAgusBovedaAún no hay calificaciones
- ElectrolitosDocumento8 páginasElectrolitoslcgaAún no hay calificaciones
- Cap 10 PDFDocumento11 páginasCap 10 PDFOscar Eduardo Venegas BastíasAún no hay calificaciones
- Equilibrio Iónico y pHDocumento30 páginasEquilibrio Iónico y pHJorge Esteban Rojas GonzalezAún no hay calificaciones
- Equilibrio IonicoDocumento8 páginasEquilibrio IonicoNatalia Zeballos de RomeraAún no hay calificaciones
- Practica de Laboratorio, Acidos y BasesDocumento15 páginasPractica de Laboratorio, Acidos y BasesAdrian Jose Cabrera ReyesAún no hay calificaciones
- Equilibrio iónicoDocumento17 páginasEquilibrio iónicozavieirAún no hay calificaciones
- Determinación de la acidez de un producto comercial mediante valoración ácido-baseDocumento16 páginasDeterminación de la acidez de un producto comercial mediante valoración ácido-baseSantiago Ahumada TobarAún no hay calificaciones
- Informe N°02 - BioquímicaDocumento10 páginasInforme N°02 - BioquímicaMiharu Romero100% (1)
- 5.exposicion Equilibrio Ionico e Hidrolisis de Sales (Blanco y Negro)Documento48 páginas5.exposicion Equilibrio Ionico e Hidrolisis de Sales (Blanco y Negro)Alfredo CruzAún no hay calificaciones
- Reacciones en Disolución AcuosaDocumento31 páginasReacciones en Disolución AcuosaManuel Llano Martinez100% (9)
- Reacciones en disolución acuosaDocumento3 páginasReacciones en disolución acuosaandrea jimenezAún no hay calificaciones
- GUIA 2016-Ácidos y BasesDocumento63 páginasGUIA 2016-Ácidos y BasesDianaAún no hay calificaciones
- Ácidos y bases: Introducción a sus propiedades químicasDocumento17 páginasÁcidos y bases: Introducción a sus propiedades químicasMelisa Llantoy TelloAún no hay calificaciones
- Química ácido-baseDocumento18 páginasQuímica ácido-baseSvetlana BetAún no hay calificaciones
- Equilibrio Ácido BaseDocumento17 páginasEquilibrio Ácido Basejosefaaa100% (1)
- 5.exposicion Equilibrio Ionico e Hidrolisis de SalesDocumento48 páginas5.exposicion Equilibrio Ionico e Hidrolisis de SalesRenso Ramos LopezAún no hay calificaciones
- QuimGen II Lab8 InformeDocumento17 páginasQuimGen II Lab8 InformeNatalia ValenciaAún no hay calificaciones
- Marco TeóricoDocumento6 páginasMarco TeóricoAnderson Guerrero AldanaAún no hay calificaciones
- Equilibrio IonicoDocumento49 páginasEquilibrio IonicoCarol Celeste Villegas GomezAún no hay calificaciones
- Ácido BaseDocumento38 páginasÁcido BaseFederico Yapu Sanchez YapuAún no hay calificaciones
- 2do Parcial-Hidrólisis de SalesDocumento29 páginas2do Parcial-Hidrólisis de SalesPetronila MedHerrAún no hay calificaciones
- Guía Labotatorio 8-Titulaciones Acido Base y Mediciones Del PHDocumento11 páginasGuía Labotatorio 8-Titulaciones Acido Base y Mediciones Del PHPaula Nicole Aguilar FuqueneAún no hay calificaciones
- Electrolitos y PHDocumento35 páginasElectrolitos y PHDoc KhemAún no hay calificaciones
- Ejercicios de Quimica Con RespuestaDocumento4 páginasEjercicios de Quimica Con RespuestaEddy Arreola100% (1)
- Cápitulo 4 Raymond ChangDocumento6 páginasCápitulo 4 Raymond Changyazmin azulAún no hay calificaciones
- Teoría 3 - Hidrólisis y BuffersDocumento5 páginasTeoría 3 - Hidrólisis y BuffersSimón OsésAún no hay calificaciones
- Yorgelis Perez Tarea M2 PDFDocumento13 páginasYorgelis Perez Tarea M2 PDFYorgelis P BritoAún no hay calificaciones
- Equilibrio IonicoDocumento48 páginasEquilibrio Ionicoperu210% (1)
- P. 2 - PH y BufferDocumento11 páginasP. 2 - PH y Bufferfernanda jelvesAún no hay calificaciones
- Practica 02Documento8 páginasPractica 02Lupita MarAún no hay calificaciones
- Cap 10 - TEMA 25 ACIDOS BASESDocumento34 páginasCap 10 - TEMA 25 ACIDOS BASESRetter Darwin ColqueAún no hay calificaciones
- Quimica BiologicaDocumento24 páginasQuimica Biologicamatias961100% (1)
- Acidos y BASES - Pedro de ValdiviaDocumento20 páginasAcidos y BASES - Pedro de ValdiviaMaría Consuelo BravoAún no hay calificaciones
- Hidrólisis de Sales de Ácidos y BasesDocumento29 páginasHidrólisis de Sales de Ácidos y BasesPetronila MedHerrAún no hay calificaciones
- Ácidos y bases: Teorías y clasificaciónDocumento4 páginasÁcidos y bases: Teorías y clasificaciónJohano756Aún no hay calificaciones
- Acidos y Bases 2Documento38 páginasAcidos y Bases 2Julian Escalante OrtizAún no hay calificaciones
- Electrolitos y PH QGDocumento46 páginasElectrolitos y PH QGanon_1383319930% (1)
- Neutralizacion de Soluciones Valoraciones AcidoDocumento14 páginasNeutralizacion de Soluciones Valoraciones AcidoalbringthAún no hay calificaciones
- Conceptos Básicos de Ácidos y BasesDocumento2 páginasConceptos Básicos de Ácidos y BasesNOLBERTO JAVIER VERA ROJASAún no hay calificaciones
- Reacciones orgánicas, tipos de ácidos y basesDocumento26 páginasReacciones orgánicas, tipos de ácidos y basesAbraham Juarez LuisAún no hay calificaciones
- 04 - Clases de Reacciones. SILBERBERGDocumento87 páginas04 - Clases de Reacciones. SILBERBERGBrayan ChopraAún no hay calificaciones
- Reacciones Quc3admicasDocumento4 páginasReacciones Quc3admicasDulce María Ruiz LoraAún no hay calificaciones
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 5 de 5 estrellas5/5 (1)
- Practica No1.3 Saneamiento AmbientalDocumento11 páginasPractica No1.3 Saneamiento AmbientalDam_TAún no hay calificaciones
- Tema 2. Segunda Ley de Newton. Parte 1Documento10 páginasTema 2. Segunda Ley de Newton. Parte 1Dam_TAún no hay calificaciones
- PracticaNº9 NMPDocumento20 páginasPracticaNº9 NMPDam_TAún no hay calificaciones
- Tema N1 Introducción y QuímicaDocumento29 páginasTema N1 Introducción y QuímicaDam_TAún no hay calificaciones
- GuíaDocumento59 páginasGuíaDam_TAún no hay calificaciones
- Tema No2 MicrobiologiaDocumento46 páginasTema No2 MicrobiologiaDam_TAún no hay calificaciones
- Practica #1.1Documento5 páginasPractica #1.1Dam_TAún no hay calificaciones
- Practica Nº6.Analisis Fisico Del AguaDocumento13 páginasPractica Nº6.Analisis Fisico Del AguaDam_TAún no hay calificaciones
- Curso de PascalDocumento310 páginasCurso de PascalNacho Cabanes100% (1)
- Tema N1 Introducción y QuímicaDocumento29 páginasTema N1 Introducción y QuímicaDam_TAún no hay calificaciones
- Tema N4.Nociones de Calidad de AguaDocumento79 páginasTema N4.Nociones de Calidad de AguaDam_TAún no hay calificaciones
- Curso de PascalDocumento310 páginasCurso de PascalNacho Cabanes100% (1)
- Tema #3.epidemiologiaDocumento42 páginasTema #3.epidemiologiaDam_T100% (1)
- Capitulo 01-Elementos Geometria y TrigoDocumento50 páginasCapitulo 01-Elementos Geometria y TrigofecarixxAún no hay calificaciones
- Curvas Parametricas ResumenDocumento6 páginasCurvas Parametricas ResumenDam_TAún no hay calificaciones
- Jung Carl - SincronicidadDocumento138 páginasJung Carl - SincronicidadSome98% (49)
- Liz G SaturnoDocumento130 páginasLiz G SaturnoIemanja100% (1)
- Estequiometria ResueltosDocumento54 páginasEstequiometria ResueltosJorge Canales Niño-deGuzmán100% (8)
- Mecanica Vectorial para Ingenieros, Dinamica PDFDocumento775 páginasMecanica Vectorial para Ingenieros, Dinamica PDFRodrigo Hinojosa Mamani91% (45)
- INTEGRALESDocumento117 páginasINTEGRALESIsaac Maldonado89% (9)
- Formulario FisicaDocumento27 páginasFormulario FisicaPablo Rodas86% (7)
- Formulario 2 de QuimicaDocumento8 páginasFormulario 2 de QuimicaDam_TAún no hay calificaciones
- Los Continentes y Los Oceanos Flotan PDFDocumento30 páginasLos Continentes y Los Oceanos Flotan PDFjundavis3Aún no hay calificaciones
- Proyecto Nacional Simon BolivarDocumento50 páginasProyecto Nacional Simon BolivarLEONARDOGUERRA100% (11)
- Nomenclatura Binarios 2012 (III)Documento6 páginasNomenclatura Binarios 2012 (III)Eddie PospoyAún no hay calificaciones
- Manual Quimica Ust 16Documento109 páginasManual Quimica Ust 16Williams VelasquezAún no hay calificaciones
- La Aerodinámica y El Análisis Estructural de Pala de Turbina EólicaDocumento17 páginasLa Aerodinámica y El Análisis Estructural de Pala de Turbina EólicaSergioAún no hay calificaciones
- Sistemas Estructurales de Transmision de CargaDocumento11 páginasSistemas Estructurales de Transmision de CargaYvenson Guillaume0% (1)
- EVpiDocumento3 páginasEVpiJorge Ortega ArriagadaAún no hay calificaciones
- Trabajo de Laboratorio #02a Diseno Logico VF 1 Actual PDFDocumento32 páginasTrabajo de Laboratorio #02a Diseno Logico VF 1 Actual PDFRoyer Lobo ZapataAún no hay calificaciones
- Proceso para La Obtención de Licor A Partir de SorgoDocumento41 páginasProceso para La Obtención de Licor A Partir de SorgoDiana Rincón ValbuenaAún no hay calificaciones
- Análisis Nodal y Tipos de Flujo en TuberíasDocumento40 páginasAnálisis Nodal y Tipos de Flujo en TuberíasPaola Andrea SanjuanAún no hay calificaciones
- Una Interpretación de Colapso Objetivo para Los Problemas de La Medida y A ClasicalizaciónDocumento143 páginasUna Interpretación de Colapso Objetivo para Los Problemas de La Medida y A ClasicalizaciónEduardo Sotelo BazánAún no hay calificaciones
- Física I Separata 1: Movimiento rectilíneo uniforme y aceleradoDocumento21 páginasFísica I Separata 1: Movimiento rectilíneo uniforme y aceleradoMario YupanquiAún no hay calificaciones
- Torque y tensión recomendada para pernos estructurales ASTM A325 y A490Documento1 páginaTorque y tensión recomendada para pernos estructurales ASTM A325 y A4900 OAún no hay calificaciones
- Guia 5 Formas de EnergiaDocumento2 páginasGuia 5 Formas de EnergiaLAURA100% (1)
- PracticaDocumento4 páginasPracticaOlga Lucero IllescasAún no hay calificaciones
- Heriberto Cruz - Principios Psicológicos de La SeducciónDocumento25 páginasHeriberto Cruz - Principios Psicológicos de La SeducciónCarlos Toledo100% (1)
- Ar 22 PDFDocumento44 páginasAr 22 PDFXocuaxbassAún no hay calificaciones
- Metodo de Los Elementos Finitos para Analisis EstructuralDocumento284 páginasMetodo de Los Elementos Finitos para Analisis EstructuralAnonymous 3tdhN5GAún no hay calificaciones
- Efecto de La Adicion de Caucho en Las Propiedades Mecanicas Del Hormigon ConvencionalDocumento76 páginasEfecto de La Adicion de Caucho en Las Propiedades Mecanicas Del Hormigon ConvencionalDanielAún no hay calificaciones
- Calendario escolar y evaluación quimestral 2013-2014Documento56 páginasCalendario escolar y evaluación quimestral 2013-2014lumar196770% (10)
- Medición de presión con manómetro de BourdonDocumento12 páginasMedición de presión con manómetro de BourdonLeslyUrbinaAún no hay calificaciones
- Divergente cuestionario películaDocumento2 páginasDivergente cuestionario películaantonAún no hay calificaciones
- Funcionamiento VaporizadorDocumento3 páginasFuncionamiento VaporizadorGermanda IpialAún no hay calificaciones
- Notas de CalculoDocumento80 páginasNotas de CalculoMiguel VilladaAún no hay calificaciones
- Selección de 3RW44 para Arranque PesadoDocumento8 páginasSelección de 3RW44 para Arranque PesadobajarlibroselectroAún no hay calificaciones
- Promoción de la Industria Responsable y Compromiso ClimáticoDocumento24 páginasPromoción de la Industria Responsable y Compromiso ClimáticoAndre TovarAún no hay calificaciones
- Une en 13183-2-2002Documento3 páginasUne en 13183-2-2002Juan SotoAún no hay calificaciones
- Diseño de Zapatas ContinuasDocumento3 páginasDiseño de Zapatas ContinuasArteaga Rey Euler100% (1)
- Estabilizadores TermicosDocumento3 páginasEstabilizadores TermicosAlejandra SanchezAún no hay calificaciones
- Materiales Resistentes A La CorrosionDocumento3 páginasMateriales Resistentes A La CorrosionEvelyn Villarroel100% (8)
- Tema 7 Variable Aleatoria Esperanza y VarianzaDocumento7 páginasTema 7 Variable Aleatoria Esperanza y VarianzanellyAún no hay calificaciones