Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Ciclo de Krebs
Cargado por
Anto VorterixDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Ciclo de Krebs
Cargado por
Anto VorterixCopyright:
Formatos disponibles
Ciclo de Krebs
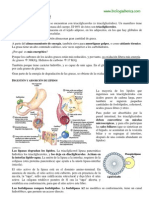
Esquema didctico del ciclo del cido ctrico.
El ciclo de Krebs (tambin llamado ciclo del cido ctrico o ciclo de los cidos
tricarboxlicos) es una ruta metablica, es decir, una sucesin de reacciones qumicas, que
forma parte de la respiracin celular en todas las clulas aerbicas. En clulas eucariotas se
realiza en la mitocondria. En las procariotas, el ciclo de Krebs se realiza en el citoplasma,
especficamente en el citosol.
En organismos aerbicos, el ciclo de Krebs es parte de la va catablica que realiza la
oxidacin de glcidos, cidos grasos y aminocidos hasta producir CO
2
, liberando energa
en forma utilizable (poder reductor y GTP).
El metabolismo oxidativo de glcidos, grasas y protenas frecuentemente se divide en tres
etapas, de las cuales, el ciclo de Krebs supone la segunda. En la primera etapa, los carbonos
de estas macromolculas dan lugar a molculas de acetil-CoA de dos carbonos, e incluye
las vas catablicas de aminocidos (p. ej. desaminacin oxidativa), la beta oxidacin de
cidos grasos y la gluclisis. La tercera etapa es la fosforilacin oxidativa, en la cual el
poder reductor (NADH y FADH
2
) generado se emplea para la sntesis de ATP segn la
teora del acomplamiento quimiosmtico.
El ciclo de Krebs tambin proporciona precursores para muchas biomolculas, como ciertos
aminocidos. Por ello se considera una va anfiblica, es decir, catablica y anablica al
mismo tiempo.
El Ciclo de Krebs fue descubierto el por el alemn Hans Adolf Krebs, quien obtuvo el
Premio Nobel.
Reacciones del ciclo de Krebs
El ciclo de Krebs tiene lugar en la matriz mitocondrial en eucariota
Ciclo de Krebs en la matriz mitocondrial.
El acetil-CoA (Acetil Coenzima A) es el principal precursor del ciclo. El cido ctrico (6
carbonos) o citrato se fusiona en cada ciclo por condensacin de un acetil-CoA (2
carbonos) con una molcula de oxaloacetato (4 carbonos). El citrato produce en cada ciclo
una molcula de oxaloacetato y dos CO
2
, por lo que el balance neto del ciclo es:
Acetil-CoA + 3 NAD
+
+ FAD + GDP + P
i
+ 2 H
2
O CoA-SH + 3 (NADH + H
+
) +
FADH
2
+ GTP + 2 CO
2
Los dos carbonos del Acetil-CoA son oxidados a CO
2
, y la energa que estaba acumulada es
liberada en forma de energa qumica: GTP y poder reductor (electrones de alto potencial):
NADH y FADH
2
. NADH y FADH
2
son coenzimas (molculas que se unen a enzimas)
capaces de acumular la energa en forma de poder reductor para su conversin en energa
qumica en la fosforilacin oxidativa.
El FADH
2
de la succinato deshidrogenasa, al no poder desprenderse de la enzima, debe
oxidarse nuevamente in situ. El FADH
2
cede sus dos hidrgenos a la ubiquinona (coenzima
Q), que se reduce a ubiquinol (QH
2
) y abandona la enzima.
Las reacciones son:
Molcula Enzima Tipo de reaccin
Reactivos/
Coenzimas
Productos/
Coenzima
I. Citrato 1. Aconitasa Deshidratacin
H
2
O
II. cis-Aconitato 2. Aconitasa Hidratacin H
2
O
III. Isocitrato
3. Isocitrato
deshidrogenasa
Oxidacin NAD
+
NADH +
H
+
IV.
Oxalosuccinato
4. Isocitrato
deshidrogenasa
Descarboxilacin
V. -
cetoglutarato
5. -cetoglutarato
deshidrogenasa
Descarboxilacin
oxidativa
NAD
+
+
CoA-SH
NADH +
H
+
+ CO
2
VI. Succinil-CoA
6. Succinil CoA
sintetasa
Hidrlisis
GDP
+ P
i
GTP +
CoA-SH
VII. Succinato
7. Succinato
deshidrogenasa
Oxidacin FAD FADH
2
VIII. Fumarato 8. Fumarato Hidratasa Adicin (H
2
O) H
2
O
IX. L-Malato
9. Malato
deshidrogenasa
Oxidacin NAD
+
NADH +
H
+
X. Oxalacetato 10. Citrato sintasa Condensacin
NOTA: El cis-aconitato es un intermedio de reaccin muy inestable que rpidamente se
transforma en citrato, antes de comenzar la tercera reaccin.
Visin simplificada y rendimiento del proceso
El paso final es la oxidacin del ciclo de Krebs, produciendo un oxaloacetato y dos
CO
2
.
El acetil-CoA reacciona con una molcula de oxaloacetato (4 carbonos) para formar
citrato (6 carbonos), mediante una reaccin de condensacin.
A travs de una serie de reacciones, el citrato se convierte de nuevo en oxaloacetato.
Durante estas reacciones, se substraen 2 tomos de carbono del citrato (6C) para dar
oxalacetato (4C); dichos tomos de carbono se liberan en forma de CO
2
El ciclo consume netamente 1 acetil-CoA y produce 2 CO
2
. Tambin consume 3
NAD
+
y 1 FAD, produciendo 3 NADH + 3 H
+
y 1 FADH
2
.
El rendimiento de un ciclo es (por cada molcula de piruvato): 1 ATP, 3 NADH
+3H
+
, 1 FADH
2
, 2CO
2
.
Cada NADH, cuando se oxide en la cadena respiratoria, originar 2,5 molculas de
ATP (3 x 2,5 = 7,5), mientras que el FADH
2
dar lugar a 1,5 ATP. Por tanto, 7,5 +
1,5 + 1 GTP = 10 ATP por cada acetil-CoA que ingresa en el ciclo de Krebs.
Cada molcula de glucosa produce (va gluclisis) dos molculas de piruvato, que a
su vez producen dos acetil-CoA, por lo que por cada molcula de glucosa en el ciclo
de Krebs se produce: 4CO
2
, 2 GTP, 6 NADH + 6H
+
, 2 FADH
2
; total 32 ATP.
Regulacin
Muchas de las enzimas del ciclo de Krebs son reguladas por retroalimentacin negativa, por
unin alostrica del ATP, que es un producto de la va y un indicador del nivel energtico
de la clula. Entre estas enzimas, se incluye el complejo de la piruvato deshidrogenasa que
sintetiza el acetil-CoA necesario para la primera reaccin del ciclo a partir de piruvato,
procedente de la gluclisis o del catabolismo de aminocidos. Tambin las enzimas citrato
sintasa, isocitrato deshidrogenasa y -cetoglutarato deshidrogenasa, que catalizan las tres
primeras reacciones del ciclo de Krebs, son inhibidas por altas concentraciones de ATP.
Esta regulacin frena este ciclo degradativo cuando el nivel energtico de la clula es
bueno.
Algunas enzimas son tambin reguladas negativamente cuando el nivel de poder reductor
de la clula es elevado. El mecanismo que se realiza es una inhibicin competitiva por
producto (por NADH) de las enzimas que emplean NAD
+
como sustrato. As se regulan,
entre otros, los complejos piruvato deshidrogenasa y citrato sintasa.
Principales vas que convergen en el ciclo de Krebs
El Ciclo de Krebs es una va metablica central en la que convergen otras, tanto anablicas
como catablicas. Ingresan al ciclo por diferentes metabolitos:
Acetil-CoA:
o Glucolisis
o Oxidacin de cidos grasos
Malato:
o Gluconeognesis
Oxalacetato:
o Oxidacin y biosntesis de aminocidos
Fumarato:
o Degradacin de cido asprtico, fenilalanina y tirosina
Succinil-CoA
o Biosntesis de porfirina
o Degradacin de valina isoleucina y metionina
o Oxidacin de cidos grasos
Alfa-cetoglutarato
o Oxidacin y biosntesis de aminocidos
Citrato
o Biosntesis de cidos grasos y colesterol
NADH y FADH
o Fosforilacin oxidativa y cadena de transporte electrnico
Descarboxilacin oxidativa
La descarboxilacin oxidativa es una reaccin de oxidacin en la cual un grupo carboxilo
es eliminado de una molcula, formando un grupo acetilo y liberando dixido de carbono.
Ocurre con frecuencia en sistemas biolgicos. Un ejemplo de ello es la descarboxilacin del
piruvato, adems hay varios ejemplos de descarboxilacin oxidativa en el ciclo de Krebs.
Descarboxilacin oxidativa del piruvato
La descarboxilacin oxidativa del piruvato es la etapa previa al ciclo de Krebs y
posterior a la gluclisis en el proceso de respiracin celular, llevado a cabo en clulas
aerobias y facultativas en presencia de oxgeno. El piruvato (que posee tres tomos de
carbono) generado en la etapa de gluclisis sale del citoplasma y atraviesa la membrana
externa mitocondrial de forma pasiva debido a la alta permeabilidad de la misma.
Posteriormente, ingresa a la matriz mitocondrial mediante un mecanismo de simporte con
protones que le permite atravesar la membrana interna de la mitocondria (utilizando la
fuerza protonmotriz generada por la cadena respiratoria). Dentro de la matriz mitocondrial,
el piruvato sufre una descarboxilacin oxidativa en la que interviene el complejo de tres
enzimas que forman la piruvato deshidrogenasa. Este complejo enzimtico posee varios
cofactores (pirofosfato de tiamina, lipoato, coenzima A, FAD y NAD
+
) y es el encargado
de catalizar la conversin del piruvato a acetil-CoA. Durante el proceso el grupo carboxilo
del piruvato se libera como dixido de carbono (CO
2
). A este proceso de descarboxilacin
lo acompaa un proceso de deshidrogenacin (oxidacin), mediante el cual el resto de la
molcula de piruvato termina conformando el grupo acetilo (de dos tomos de carbono) del
acetil-CoA. El aceptor ltimo de electrones de esta secuencia de reacciones es el NAD
+
,
que se reduce generando NADH y H
+
. Cuando concluye esta etapa, el acetil-CoA ingresa al
ciclo de Krebs.
Reaccin Global
cido pirvico + NAD + HSCoA -----------> Acetil-CoA + NADH + H+ + CO
2
Gluclisis
La gluclisis o
glicolisis (del
griego glycos,
azcar y lysis,
ruptura), es la va
metablica
encargada de
oxidar la glucosa
con la finalidad de
obtener energa
para la clula.
Consiste en 10 reacciones enzimticas consecutivas que convierten a la glucosa en dos
Reaccin global de la gluclisis
1
+
Glucosa + 2NAD
+
+ 2ADP + 2 2Piruvato + 2NADH + 2ATP + 2H
+
+ 2H
2
O
molculas de piruvato, el cual es capaz de seguir otras vas metablicas y as continuar
entregando energa al organismo.
1
El tipo de gluclisis ms comn y ms conocida es la va de Embden-Meyerhof, explicada
inicialmente por Gustav Embden y Otto Meyerhof. El trmino puede incluir vas
alternativas, como la va de Entner-Doudoroff. No obstante, gluclisis se usa con
frecuencia como sinnimo de la va de Embden-Meyerhof. Es la va inicial del catabolismo
(degradacin) de carbohidratos.
Descubrimiento
Los primeros estudios informales de los procesos glucolticos fueron iniciados en 1860,
cuando Louis Pasteur descubri que los microorganismos son los responsables de la
fermentacin,
2
y en 1897 cuando Eduard Buchner encontr que cierto extracto celular
puede causar fermentacin. La siguiente gran contribucin fue de Arthur Harden y William
Young en 1905, quienes determinaron que para que la fermentacin tenga lugar son
necesarias una fraccin celular de masa molecular elevada y termosensible (enzimas) y una
fraccin citoplasmtica de baja masa molecular y termorresistente (ATP, ADP, NAD
+
y
otras coenzimas). Los detalles de la va en s se determinaron en 1940, con un gran avance
de Otto Meyerhoff y algunos aos despus por Luis Leloir. Las mayores dificultades en
determinar lo intrincado de la va fueron la corta vida y las bajas concentraciones de los
intermediarios en las rpidas reacciones glicolticas.
En eucariotas y procariotas, la gluclisis ocurre en el citosol de la clula. En clulas
vegetales, algunas de las reacciones glucolticas se encuentran tambin en el ciclo de
Calvin, que ocurre dentro de los cloroplastos. La amplia conservacin de esta va incluye
los organismos filogenticamente ms antiguos, y por esto se considera una de las vas
metablicas ms antiguas.
3
Visin general
Esquema completo de la gluclisis
Durante la gluclisis se obtiene un rendimiento neto de dos molculas de ATP y dos
molculas de NADH; el ATP puede ser usado como fuente de energa para realizar trabajo
metablico, mientras que el NADH puede tener diferentes destinos. Puede usarse como
fuente de poder reductor en reacciones anablicas; si hay oxgeno, puede oxidarse en la
cadena respiratoria, obtenindose cuatro ATPs (dos por cada NADH); si no hay oxgeno, se
usa para reducir el piruvato a lactato (fermentacin lctica), o a CO
2
y etanol (fermentacin
alcohlica), sin obtencin adicional de energa.
La gluclisis es la forma ms rpida de conseguir energa para una clula y, en el
metabolismo de carbohidratos, generalmente es la primera va a la cual se recurre. Se
encuentra estructurada en 10 reacciones enzimticas que permiten la transformacin de una
molcula de glucosa a dos molculas de piruvato mediante un proceso catablico.
La gluclisis es una de las vas ms estudiadas, y generalmente se encuentra dividida en dos
fases: la primera, de gasto de energa y la segunda fase, de obtencin de energa.
La primera fase consiste en transformar una molcula de glucosa en dos molculas de
gliceraldehdo (una molcula de baja energa) mediante el uso de 2 ATP. Esto permite
duplicar los resultados de la segunda fase de obtencin energtica.
En la segunda fase, el gliceraldehdo se transforma en un compuesto de alta energa, cuya
hidrlisis genera una molcula de ATP, y como se generaron 2 molculas de
gliceraldehdo, se obtienen en realidad dos molculas de ATP. Esta obtencin de energa se
logra mediante el acoplamiento de una reaccin fuertemente exergnica despus de una
levemente endergnica. Este acoplamiento ocurre una vez ms en esta fase, generando dos
molculas de piruvato. De esta manera, en la segunda fase se obtienen 4 molculas de ATP.
Reacciones posteriores
Vanse tambin: Fermentacin y Ciclo de Krebs.
Luego de que una molcula de glucosa se transforme en 2 molculas de piruvato, las
condiciones del medio en que se encuentre determinarn la va metablica a seguir.
En organismos aerbicos, el piruvato seguir oxidndose por la enzima piruvato
deshidrogenasa y el ciclo de Krebs, creando intermediarios como NADH y FADH
2
. Estos
intermediarios no pueden cruzar la membrana mitocondrial, y por lo tanto, utilizan sistemas
de intercambio con otros compuestos llamados lanzaderas (en ingls, shuttles). Los ms
conocidos son la lanzadera malato-aspartato y la lanzadera glicerol-3-fosfato. Los
intermediarios logran entregar sus equivalentes
4
al interior de la membrana mitocondrial, y
que luego pasarn por la cadena de transporte de electrones, que los usar para sintetizar
ATP.
De esta manera, se puede obtener hasta 30 moles de ATP a partir de 1 mol de glucosa como
ganancia neta.
Sin embargo, cuando las clulas no posean mitocondrias (ej: eritrocito) o cuando requieran
de grandes cantidades de ATP (ej.: el msculo al ejercitarse), el piruvato sufre fermentacin
que permite obtener 2 moles de ATP por cada mol de glucosa, por lo que esta va es poco
eficiente respecto a la fase aerbica de la gluclisis.
El tipo de fermentacin vara respecto al tipo de organismos: en levaduras, se produce
fermentacin alcohlica, produciendo etanol y CO
2
como productos finales, mientras que
en msculo, eritrocitos y algunos microorganismos se produce fermentacin lctica, que da
como resultado cido lctico o lactato.
Funciones
Las funciones de la gluclisis son:
La generacin de molculas de alta energa (ATP y NADH) como fuente de energa celular
en procesos de respiracin aerbica (presencia de oxgeno) y fermentacin (ausencia de
oxgeno).
La generacin de piruvato que pasar al ciclo de Krebs, como parte de la respiracin
aerbica.
La produccin de intermediarios de 6 y 3 carbonos que pueden ser utilizados en otros
procesos celulares.
Etapas de la gluclisis
La gluclisis se divide en dos partes principales y diez reacciones enzimticas, que se
describen a continuacin.
Fase de gasto de energa (ATP)
Esta primera fase de la gluclisis consiste en transformar una molcula de glucosa en dos
molculas de gliceraldehdo.
1
er
paso: Hexoquinasa
Vase tambin: Hexoquinasa.
La primera
reaccin de la
gluclisis es la
fosforilacin de la
glucosa, para
activarla
(aumentar su
energa) y as
poder utilizarla en
otros procesos
cuando sea
necesario. Esta
activacin ocurre
por la
transferencia de
un grupo fosfato
del ATP, una
reaccin
catalizada por la
enzima
hexoquinasa,
5
la
cual puede
fosforilar (aadir
un grupo fosfato)
a molculas
similares a la
glucosa, como la
fructosa y manosa.
Las ventajas de
fosforilar la
glucosa son 2: La
primera es hacer
de la glucosa un
Glucosa + ATP Glucosa-6-fosfato + ADP
7
metabolito ms
reactivo,
mencionado
anteriormente, y
la segunda ventaja
es que la glucosa-
6-fosfato no
puede cruzar la
membrana celular
-a diferencia de la
glucosa-ya que en
la clula no existe
un transportador
de G6P. De esta
forma se evita la
prdida de
sustrato
energtico para la
clula.
Tcnicamente
hablando, la
hexoquinasa slo
fosforila las D-
hexosas, y utiliza
de sustrato
MgATP
2+
, ya que
este catin
permite que el
ltimo fosfato del
ATP (fosfato
gamma, -P o P
)
sea un blanco ms
fcil para el
ataque
nucleoflico que
realiza el grupo
hidroxilo (OH) del
sexto carbono de
la glucosa, lo que
es posible debido
al Mg
2+
que
apantalla las
cargas de los otros
dos fosfatos.
1
6
Esta reaccin
posee un G
negativo, y por
tanto se trata de
una reaccin en la
que se pierde
energa en forma
de calor. En
numerosas
bacterias esta
reaccin esta
acoplada a la
ltima reaccin de
la gluclisis (de
fosfoenolpiruvato
a piruvato) para
poder aprovechar
la energa
sobrante de la
reaccin: el
fosfato del
fosfoenolpiruvato
se transfiere de
una a otra
protena de un
sistema de
transporte
fosfotransferasa, y
en ltima
instancia, el
fosfato pasar a
una molcula de
glucosa que es
tomada del
exterior de la
clula y liberada
en forma de G6P
en el interior
celular. Se trata
por tanto de
acoplar la primera
y la ltima
reaccin de esta
va y usar el
excedente de
energa para
realizar un tipo de
transporte a
travs de
membrana
denominado
translocacin de
grupo.
2 paso: Glucosa-6-P isomerasa
Vase tambin: Fosfohexosa isomerasa.
ste es un paso
importante,
puesto que aqu se
define la
geometra
molecular que
afectar los dos
pasos crticos en la
gluclisis: El
prximo paso, que
agregar un grupo
fosfato al
producto de esta
reaccin, y el paso
4, cuando se creen
dos molculas de
gliceraldehido que
finalmente sern
las precursoras del
piruvato.
1
En esta
reaccin, la
glucosa-6-fosfato
se isomeriza a
fructosa-6-fosfato,
mediante la
enzima glucosa-6-
fosfato isomerasa.
La isomerizacin
ocurre en una
reaccin de 4
pasos, que implica
la apertura del
anillo y un
traspaso de
Glucosa-6-fosfato Fructosa-6-fosfato
7
protones a travs
de un
intermediario cis-
enediol
8
Puesto que la
energa libre de
esta reaccin es
igual a +1,7
kJ/mol la
reaccin es no
espontnea y se
debe acoplar.
3
er
paso: Fosfofructoquinasa
Vase tambin: Fosfofructoquinasa-1.
Fosforilacin de la
fructosa 6-fosfato
en el carbono 1,
con gasto de un
ATP, a travs de la
enzima
fosfofructoquinasa
-1 (PFK1). Tambin
este fosfato
tendr una baja
energa de
hidrlisis. Por el
mismo motivo que
en la primera
reaccin, el
proceso es
irreversible. El
nuevo producto se
denominar
fructosa-1,6-
bifosfato. La
irreversibilidad es
importante, ya
que la hace ser el
punto de control
de la gluclisis.
Como hay otros
sustratos aparte
Fructosa-6-fosfato + ATP Fructosa-1,6-bifosfato + ADP
7
de la glucosa que
entran en la
gluclisis, el punto
de control no est
colocado en la
primera reaccin,
sino en sta. La
fosfofructoquinasa
tiene centros
alostricos,
sensibles a las
concentraciones
de intermediarios
como citrato y
cidos grasos.
Liberando una
enzima llamada
fosfructocinasa-2
que fosforila en el
carbono 2 y regula
la reaccin.
4 paso: Aldolasa
Vase tambin: Aldolasa.
La enzima aldolasa
(fructosa-1,6-
bifosfato
aldolasa),
mediante una
condensacin
aldlica reversible,
rompe la fructosa-
1,6-bifosfato en
dos molculas de
tres carbonos
(triosas):
dihidroxiacetona
fosfato y
gliceraldehdo-3-
fosfato. Existen
dos tipos de
aldolasa, que
Fructosa-1,6-bifosfato Dihidroxiacetona-fosfato +
Gliceraldehdo-3-fosfato
difieren tanto en
el tipo de
organismos donde
se expresan, como
en los
intermediarios de
reaccin.
Esta reaccin
tiene una energa
libre (G) entre
20 a 25 kJ/mol,
por lo tanto en
condiciones
estndar no
ocurre de manera
espontnea. Sin
embargo, en
condiciones
intracelulares la
energa libre es
pequea debido a
la baja
concentracin de
los sustratos, lo
que permite que
esta reaccin sea
reversible.
1
7
5 paso: Triosa fosfato isomerasa
Artculo principal: Triosa fosfato isomerasa.
Puesto que slo el
gliceraldehdo-3-
fosfato puede
seguir los pasos
restantes de la
gluclisis, la otra
molcula
generada por la
reaccin anterior
(dihidroxiacetona-
fosfato) es
isomerizada
(convertida) en
gliceraldehdo-3-
fosfato. Esta
reaccin posee
una energa libre
en condiciones
estndar positiva,
lo cual implicara
un proceso no
favorecido, sin
embargo al igual
que para la
reaccin 4,
considerando las
concentraciones
intracelulares
reales del reactivo
y el producto, se
encuentra que la
energa libre total
es negativa, por lo
que la direccin
favorecida es
hacia la formacin
de G3P.
ste es el ltimo
paso de la "fase
de gasto de
energa". Slo
se ha consumido
ATP en el primer
paso
(hexoquinasa) y
el tercer paso
(fosfofructoquina
sa-1). Cabe
recordar que el
4to paso
(aldolasa) genera
una molcula de
gliceraldehdo-3-
fosfato, mientras
que el 5to paso
genera una
segunda
Dihidroxiacetona-fosfato Gliceraldehdo-3-fosfato
7
molcula de ste.
De aqu en
adelante, las
reacciones a
seguir ocurrirn
dos veces,
debido a las 2
molculas de
gliceraldehdo
generadas de esta
fase. Hasta esta
reaccin hay
intervencin de
energa (ATP).
Fase de beneficio energtico (ATP, NADH)
Hasta el momento solo se ha consumido energa (ATP), sin embargo, en la segunda etapa,
el gliceraldehdo es convertido a una molcula de mucha energa, donde finalmente se
obtendr el beneficio final de 4 molculas de ATP.
6 paso: Gliceraldehdo-3-fosfato deshidrogenasa
Artculo principal: Gliceraldehdo-3-fosfato deshidrogenasa.
Esta reaccin
consiste en
oxidar el
gliceraldehdo
-3-fosfato
utilizando
NAD
+
para
aadir un ion
fosfato a la
molcula, la
cual es
realizada por
la enzima
gliceraldehdo
-3-fosfato
deshidrogenas
a o bien, GAP
deshidrogenas
a en 5 pasos, y
de sta
manera
aumentar la
NAD
+
NADH
+ P
i
+ H
+
Gliceraldehdo-3-
fosfato
deshidrogenasa
Gliceraldehdo-
3-fosfato
+ P
i
+ NAD
+
1,3-
Bisfosfoglicerato
+ NADH + H
+
7
energa del
compuesto.
Tcnicament
e, el grupo
aldehdo se
oxida a un
grupo acil-
fosfato, que
es un
derivado de
un carboxilo
fosfatado.
Este
compuesto
posee una
energa de
hidrlisis
sumamente
alta (cercana
a los 50
kJ/mol) por
lo que se da
inicio al
proceso de
reacciones
que
permitirn
recuperar el
ATP ms
adelante.
Mientras el
grupo
aldehdo se
oxida, el
NAD
+
se
reduce, lo
que hace de
esta reaccin
una reaccin
redox. El
NAD
+
se
reduce por la
incorporaci
n de algn
[H
+
] dando
como
resultado una
molcula de
NADH de
carga neutra.
7 paso: Fosfoglicerato quinasa
Vase tambin: Fosfoglicerato quinasa.
En este paso,
la enzima
fosfoglicerato
quinasa
transfiere el
grupo fosfato
de 1,3-
bisfosfoglicera
to a una
molcula de
ADP,
generando as
la primera
molcula de
ATP de la va.
Como la
glucosa se
transform en
2 molculas
de
gliceraldehdo,
en total se
recuperan 2
ATP en esta
etapa. Ntese
que la enzima
fue nombrada
por la reaccin
inversa a la
mostrada, y
que sta
opera en
ambas
direcciones.
Los pasos 6 y
7 de la
ADP ATP
Fosfoglicerato
quinasa
1,3-
Bisfosfoglicerato
+ ADP
3-
Fosfoglicerato
+ ATP
7
gluclisis nos
muestran un
caso de
acoplamiento
de
reacciones,
donde una
reaccin
energticame
nte
desfavorable
(paso 6) es
seguida por
una reaccin
muy
favorable
energticame
nte (paso 7)
que induce la
primera
reaccin. En
otras
palabras,
como la
clula se
mantiene en
equilibrio, el
descenso en
las reservas
de 1,3
bifosfoglicer
ato empuja a
la enzima
GAP
deshidrogena
sa a aumentar
sus reservas.
La
cuantificacio
n de la
energa libre
para el
acople de
ambas
reacciones es
de alrededor
de -12
kJ/mol.
sta manera
de obtener
ATP sin la
necesidad de
O
2
se
denomina
fosforilacin
a nivel de
sustrato.
8 paso: Fosfoglicerato mutasa
Vase tambin: Fosfoglicerato mutasa.
Se isomeriza
el 3-
fosfoglicerato
procedente de
la reaccin
anterior
dando 2-
fosfoglicerato,
la enzima que
cataliza esta
reaccin es la
fosfoglicerato
mutasa. Lo
nico que
ocurre aqu es
el cambio de
posicin del
fosfato del C3
al C2. Son
energas
similares y por
tanto
reversibles,
con una
variacin de
energa libre
cercana a
cero.
Fosfoglicerato
mutasa
3-Fosfoglicerato
2-Fosfoglicerato
7
9 paso: Enolasa
Vase tambin: Enolasa.
La enzima
enolasa
propicia la
formacin de
un doble
enlace en el 2-
fosfoglicerato,
eliminando
una molcula
de agua
formada por
el hidrgeno
del C2 y el OH
del C3. El
resultado es el
fosfoenolpiruv
ato.
enolasa
2-Fosfoglicerato
Fosfoenolpiruvato
+ H
2
O
7
10 paso: Piruvato quinasa
Vase tambin: Piruvato quinasa.
Desfosforilaci
n del
fosfoenolpiruv
ato,
obtenindose
piruvato y
ATP. Reaccin
irreversible
mediada por
la piruvato
quinasa.
ADP ATP
piruvato quinasa
Fosfoenolpiruvato
Piruvato
7
El enzima piruvato quinasa es dependiente de magnesio y potasio. La energa libre es de -
31,4 kJ/mol, por lo tanto la reaccin es favorable e irreversible.
El rendimiento total de la gluclisis de una sola glucosa (6C) es de 2 ATP y no 4 (dos por
cada gliceraldehdo-3-fosfato (3C)), ya que se consumen 2 ATP en la primera fase, y 2
NADH (que dejarn los electrones Nc en la cadena de transporte de electrones para formar
3 ATP por cada electrn). Con la molcula de piruvato, mediante un paso de oxidacin
intermedio llamado descarboxilacin oxidativa, mediante el cual el piruvato pasa al interior
de la mitocondria, perdiendo CO
2
y un electrn que oxida el NAD
+
, que pasa a ser NADH
ms H
+
y ganando un CoA-SH (coenzima A), formndose en acetil-CoA gracias a la
enzima piruvato deshidrogenasa, se puede entrar al ciclo de Krebs (que, junto con la cadena
de transporte de electrones, se denomina respiracin).
Regulacin
El efecto Pasteur
Artculo principal: Efecto Pasteur.
El efecto Pasteur es la visualizacin del poder que posee el O
2
en la fermentacin mediada
por levadura, que fue descubierto por Luis Pasteur al observar la relacin entre la tasa de
fermentacin y la existencia de aire. El determin que stas tenan una relacin inversa, y
adems observ que en condiciones aerbicas, las clulas de levadura aumentaban y la
fermentacin disminua.
De esta manera, el efecto Pasteur fue una de las primeras observaciones que alguien realiz
al proceso de la gluclisis de manera indirecta, pero observando que el metabolismo
primario de glucosa se poda realizar con presencia o ausencia de oxgeno, y que en este
ltimo ocurre la fermentacin alcohlica.
Regulacin del sustrato
Vase tambin: Transportador de glucosa.
La membrana plasmtica de las clulas es impermeable a la glucosa. Para llevarla dentro de
ella utiliza transportadores especiales llamados GLUT, de los cuales hay diferentes tipos y
algunos especializados para cada clula.
Regulacin de la actividad enzimtica
Regulacin glucolisis
La gluclisis se regula enzimticamente en los tres puntos irreversibles de esta ruta, esto es,
en la primera reaccin (G G-6P), por medio de la hexoquinasa; en la tercera reaccin
(F-6P F-1,6-BP) por medio de la PFK1 y en el ltimo paso (PEP Piruvato) por la
piruvato quinasa.
La hexoquinasa es un punto de regulacin poco importante, ya que se inhibe cuando hay
mucho G-6P en msculo. Es un punto poco importante ya que el G-6P se utiliza para otras
vas.
La fosfofructoquinasa-1 es la enzima principal de la regulacin de la gluclisis, acta como
una llave de agua, si est activa cataliza muchas reacciones y se obtiene ms Fructosa 1,6
bisfosfato, lo que permitir a las enzimas siguientes transformar mucho piruvato. Si est
inhibida, se obtienen bajas concentraciones de producto y por lo tanto se obtiene poco
piruvato. Esta enzima es controlada por regulacin alostrica mediante: Por un lado se
activa gracias a niveles energticos elevados de ADP y AMP, inhibiendose en abundancia
de ATP y citrato, y por otro se activa en presencia de un regulador generado por la PFK2
que es la Fructosa-2,6-Bisfosfato (F-2,6-BP), que no es un metabolito ni de la glucolisis ni
de la gluconeognesis, sino un regulador de ambas vas que refleja el nivel de glucagn en
sangre.
La lgica de la inhibicin y activacin son las siguientes:
ATP: inhibe esta enzima pues si hay una alta concentracin de ATP entonces la
clula no necesita generar ms.
Citrato: Si la concentracin de citrato es alta el Ciclo de Krebs va ms despacio de
lo que el sustrato (acetil-CoA) llega para degradarse, y la concentracin de glucosa
ser ms alta. En el Ciclo de Krebs se produce mucho NADH y FADH2, para que
funcionen se han de reoxidar en la cadena de transporte electrnico creando
gradiente de protones, si el gradiente no se gasta los coenzimas no se reoxidan y
el Ciclo de Krebs se para.
AMP, ADP: la alta concentracin de estas molculas implica que hay una carencia
de ATP, por lo que es necesario realizar gluclisis, para generar piruvato y energa.
La piruvatoquinasa se regula distintamente segn el tejido en el que trabaje, pero en
hgado se inhibe en presencia de ATP y Acetil Coenzima-A (Acetil-CoA), y se activa gracias
de nuevo ante la F-1,6-BP y la concentracin de fosfoenolpiruvato.
Regulacin hormonal
Al aumentar la glucosa en la sangre, despus de una comida, las clulas beta del pncreas
estimulan la produccin de insulina, y sta a su vez aumenta la actividad de la glucocinasa
en los hepatocitos.
Las concentraciones altas de glucagon y las bajas de insulina disminuyen la concentracin
intracelular de fructosa 2,6 bisfosfato. Esto trae por consecuencia la disminucin de la
gluclisis y el aumento de la gluconeogensis.
Produccin de glucosa
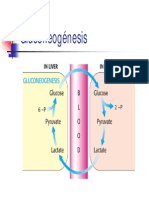
Artculo principal: Gluconeognesis.
La gluconeognesis es la ruta anablica por la que tiene lugar la sntesis de nueva glucosa a
partir de precursores no glucosdicos (lactato, piruvato, glicerol y algunos aminocidos). Se
lleva a cabo principalmente en el hgado, y en menor medida en la corteza renal. Es
estmulada por la hormona glucagn, secretada por las clulas (alfa) de los islotes de
Langerhans del pncreas y es inhibida por su contrarreguladora, la hormona insulina,
secretada por las clulas (beta) de los islotes de Langerhans del pncreas, que estmula la
ruta catablica llamada glucogenlisis para degradar el glucgeno almacenado y
transformarlo en glucosa y as aumentar la glucemia (azcar en sangre).
Desde el punto de vista enzimtico, producir glucosiliosas desde lacticosinidas cuesta ms
de lo que produjo su degradacin fosfrica. La ecuacin extrafundamental es:
2 piruvato + 4 ATP + 2 GTP + 9 NADH + 7 H + 3 H
2
O Glucosa + 4 ADP + 2 GDP + 6 P + 2 NAD+
Gluclisis en plantas
Las plantas tienen la capacidad de realizar la fotosntesis, y entre los subproductos de este
proceso est la glucosa. sta es usada por las plantas, entre muchas cosas, como fuente de
energa en el proceso de respiracin, el cual a diferencia de la fotosntesis es ejecutado
independientemente de la luz. Al respirar las plantas absorben oxgeno del aire y expulsan
dixido de carbono y vapor de agua. El intercambio de sustancias lo realizan las estomas;
aberturas que actan como compuertas en las plantas que adems tienen la caracterstica de
cerrarse ante un descenso excesivo del vapor atmosfrico.
9
Fosforilacin oxidativa
Saltar a: navegacin, bsqueda
Esquema actual del sistema mitocondrial de la fosforilacin oxidativa. Los equivalentes
reducidos que se generan en el metabolismo (NADH, FADH
2
) son oxidados por la cadena
de transporte de electrones. La energa libre generada en esta reaccin se emplea para
bombear protones (puntos rojos) desde la matriz mitocondrial hasta el interior de las crestas
mitocondriales, para dar lugar a la fuerza protn-motriz. Cuando ste se disipa a travs del
retorno a la matriz de los protones a travs de la ATP sintasa, la energa almacenada se
emplea para fosforilar el ADP con un grupo fosfato para formar ATP.
El modelo actual cubre algunos problemas suscitados por el anterior. En primer lugar, todos
los componentes activos de la cadena de transporte de electrones se encuentran
exclusivamente en las crestas mitocondriales y formando supercomplejos, en la imagen
representado por el supercomplejo I
1
III
2
IV
1
. Esto permite canalizar de unos complejos a
otros las molculas de transferencia de electrones. Previamente se pensaba que difundan
libremente. En segundo lugar, la diferencia de pH, uno de los componentes de la fuerza
protn-motriz junto con el potencial de membrana () es de tan slo 0,55 unidades,
equivalente a 32 mV, insuficiente para impulsar la fosforilacin. Sin embargo, existen
circunstancias locales que aumentan este pH en un factor de 2 unidades. En primer lugar, la
ATP sintasa forma dmeros y filas que comban y dan forma a la cresta mitocondrial,
haciendo que el espacio interno tenga tan slo 20 4 nm. El espacio entre la membrana
interna y externa es menor, de 12 2,5 nm, pero cuenta con poros lo suficientemente
grandes como para estar en equilibrio con el citoplasma. Los protones se concentran gracias
al "efecto superficie" y al rpido flujo desde las fuentes de protones a los sumideros.
La fosforilacin oxidativa es un proceso metablico que utiliza energa liberada por la
oxidacin de nutrientes para producir adenosn trifosfato (ATP). Se le llama as para
distinguirla de otras rutas que producen ATP con menor rendimiento, llamadas "a nivel de
sustrato". Se calcula que hasta el 90% de la energa celular en forma de ATP es producida
de esta forma.
1
Consta de dos etapas: en la primera, la energa libre generada mediante reacciones qumicas
redox en varios complejos multiproteicos -conocidos en su conjunto como cadena de
transporte de electrones- se emplea para producir, por diversos procedimientos como
bombeo, ciclos quinona/quinol o bucles redox, un gradiente electroqumico de protones a
travs de una membrana asociada en un proceso llamado quimiosmosis. La cadena
respiratoria est formada por tres complejos de protenas principales (complejo I,III, IV), y
varios complejos "auxiliares", utilizando una variedad de donantes y aceptores de
electrones. Los tres complejos se asocian en supercomplejos para canalizar las molculas
transportadoras de electrones, la coenzima Q y el citocromo c, haciendo ms eficiente el
proceso.
La energa potencial de ese gradiente, llamada fuerza protn-motriz, se libera cuando se
translocan los protones a travs de un canal pasivo, la enzima ATP sintasa, y se utiliza en la
adicin de un grupo fosfato a una molcula de ADP para almacenar parte de esa energa
potencial en los enlaces anhidro "de alta energa" de la molcula de ATP mediante un
mecanismo en el que interviene la rotacin de una parte de la enzima a medida que fluyen
los protones a travs de ella. En vertebrados, y posiblemente en todo el reino animal, se
genera un ATP por cada 2,7 protones translocados. Algunos organismos tienen ATPasas
con un rendimiento menor.
Existen tambin protenas desacopladoras que permiten controlar el flujo de protones y
generar calor desacoplando ambas fases de la fosforilacin oxidativa.
Aunque las diversas formas de vida utilizan una gran variedad de nutrientes, casi todas
realizan la fosforilacin oxidativa para producir ATP, la molcula que provee de energa al
metabolismo. Esta ruta es tan ubicua debido a que es una forma altamente eficaz de
liberacin de energa, en comparacin con los procesos alternativos de fermentacin, como
la gluclisis anaerbica.
Pese a que la fosforilacin oxidativa es una parte vital del metabolismo, produce una
pequea proporcin de especies reactivas del oxgeno tales como superxido y perxido de
hidrgeno, lo que lleva a la propagacin de radicales libres, provocando dao celular,
contribuyendo a enfermedades y, posiblemente, al envejecimiento. Sin embargo, los
radicales tienen un importante papel en la sealizacin celular, y posiblemente en la
formacin de enlaces disulfuro de las propias protenas de la membrana interna
mitocondrial. Las enzimas que llevan a cabo esta ruta metablica son blanco de muchas
drogas y productos txicos que inhiben su actividad.
ndice
1 Historia
2 Transferencia de energa por quimiosmosis
3 Molculas de transferencia de protones y electrones
4 Cadena de transporte de electrones en eucariotas
o 4.1 NADH- ubiquinona oxidorreductasa (complejo I)
4.1.1 Mecanismo cataltico de la reaccin red/ox
4.1.2 Estructura funcional
4.1.3 Regulacin
o 4.2 Complejos auxiliares
4.2.1 Succinato-Q oxidorreductasa (complejo II)
4.2.2 Flavoprotena de transporte de electrones Q oxidorreductasa
4.2.3 Reductasas y oxidasas alternativas
o 4.3 Q-citocromo c oxidorreductasa (complejo III)
o 4.4 Citocromo c oxidasa (complejo IV)
o 4.5 Organizacin de complejos
5 Cadena de transporte de electrones en procariotas
6 ATP sintasa (complejo V)
7 Inhibidores
8 Vase tambin
9 Referencias
10 Lecturas complementarias
11 Enlaces externos
Historia
El bioqumico Arthur Harden.
El estudio de la fosforilacin oxidativa se inici en 1906 con el informe de Arthur Harden
sobre el papel vital del fosfato en la fermentacin celular, aunque inicialmente se pensaba
que solo los azcar-fosfato estaban involucrados.
2
Sin embargo, a principios de los aos
1940, la relacin entre la oxidacin de los azcares y la generacin de ATP fue establecida
de forma definitiva por Herman Kalckar,
3
confirmando el papel central del ATP en la
transferencia de energa, que haba sido propuesto por Fritz Albert Lipmann en 1941.
4
Ms
tarde, en 1949, Friedkin y Morris Albert L. Lehninger demostraron que la coenzima NADH
se encuentra relacionada con vas metablicas tales como el ciclo del cido ctrico y la
sntesis de ATP.
5
Durante otros veinte aos, el mecanismo por el cual se generaba el ATP sigui siendo un
misterio, con cientficos buscando un elusivo "intermediario de alta energa", que enlazara
las reacciones de oxidacin y fosforilacin.
6
El misterio fue resuelto por Peter D. Mitchell
con la publicacin de la teora quimiosmtica en 1961.
7
En un principio la propuesta fue
muy controvertida, pero fue aceptada lentamente y finalmente Mitchell recibi el Premio
Nobel de Qumica en 1978 por su teora.
8
9
La investigacin posterior se centr en la
purificacin y caracterizacin de las enzimas involucradas, con importantes contribuciones
realizadas por David E. Green sobre los complejos de la cadena de transporte de electrones,
as como de Efraim Racker sobre la ATP sintasa.
10
Un paso fundamental hacia la solucin
de los mecanismos de la ATP sintasa fue proporcionada por Paul D. Boyer, con su
desarrollo en 1973 del mecanismo de "cambio de unin", seguido por su radical propuesta
de un sistema de catlisis rotacional en 1982.
11
12
Los trabajos ms recientes incluyen
estudios estructurales de las enzimas involucradas en la fosforilacin oxidativa, llevados a
cabo por John E. Walker, habiendo obtenido Walker y Boyer el Premio Nobel en 1997.
13
Transferencia de energa por quimiosmosis
Modelo molecular del NAD
+
.
Artculo principal: Quimiosmosis.
La fosforilacin oxidativa funciona con dos tipos de reacciones que estn acopladas, una
utiliza reacciones qumicas que liberan energa, mientras que la otra utiliza esa energa para
llevar a cabo sus reacciones.
14
El flujo de electrones a travs de la cadena de transporte de
electrones, desde donantes de electrones como NADH a aceptores de electrones tales como
oxgeno, es un proceso exergnico libera energa, mientras que la sntesis de ATP es un
proceso endergnico, el cual requiere de energa. Tanto la cadena de transporte de
electrones como la ATP sintasa, estn embebidos en la membrana, y la energa es
transferida de la cadena de transporte de electrones a la ATP sintasa por el movimiento de
protones a travs de la membrana, en un proceso llamado quimiosmosis.
15
En la prctica, se
comporta de manera similar a un simple circuito elctrico, con una corriente de protones
siendo transportados desde el lado negativo, lado N de la membrana hacia el lado positivo,
lado P, por las enzimas de la cadena de transporte de electrones que bombean protones.
Estas enzimas son como una batera, ya que realizan trabajo, para llevar corriente a travs
del circuito. El movimiento de protones crea un gradiente electroqumico a travs de la
membrana, el cual es llamado generalmente fuerza protn-motriz. Este gradiente tiene dos
componentes: una diferencia en la concentracin de protones (un gradiente de pH) y una
diferencia en el potencial elctrico, con un lado N, que posee carga negativa. La energa es
almacenada mayormente como la diferencia de potenciales elctricos en la mitocondria,
pero tambin como un gradiente de pH en los cloroplastos.
16
La ATP sintasa libera esta energa almacenada completando el circuito y permitiendo a los
protones fluir a travs del gradiente electroqumico, de nuevo hacia el lado N de la
membrana.
17
Esta enzima se comporta de manera similar a un motor elctrico ya que utiliza
la fuerza protn-motriz para llevar a cabo la rotacin de parte de su estructura y acoplar este
movimiento con la sntesis de ATP.
La cantidad de energa liberada por la fosforilacin oxidativa es elevada, comparada con la
cantidad producida por la fermentacin anaerbica. La gluclisis produce solo 2 molculas
de ATP, en cambio entre 30 y 36 ATPs son producidos por la fosforilacin oxidativa de los
10 NADH y 2 succinato obtenidos a travs de la conversin de una molcula de glucosa en
dixido de carbono y agua.
18
Este resultado de ATP es el mximo terico, ya que en la
prctica algunos protones se filtran a travs de la membrana, disminuyendo as la
produccin de ATP.
19
Molculas de transferencia de protones y electrones
Reduccin de la coenzima Q desde su forma ubiquinona (Q) a la forma reducida de
ubiquinol (QH
2
).
Vase tambin: Cofactor.
La cadena de transporte de electrones transporta tanto protones como electrones,
transfiriendo electrones desde donantes hacia aceptores, y transportando protones a travs
de la membrana. Estos procesos utilizan molculas de transferencia tanto solubles como
unidas a protenas. En la mitocondria, los electrones son transferidos dentro del espacio
intermembranal por la protena de transferencia de electrones solubles en agua, citocromo
c.
20
Esto transporta solamente electrones, y estos son transferidos por la reduccin y
oxidacin de un tomo de hierro que se encuentre en el grupo hemo de la protena. El
citocromo c se encuentra tambin en algunas bacterias, donde se ubica en el espacio
periplasmtico.
21
Dentro de la membrana interna mitocondrial, el transportador de electrones liposoluble, la
coenzima Q10 (Q) transporta tanto electrones como protones a travs de un ciclo redox.
22
Esta pequea molcula de benzoquinona es muy hidrfobica, de modo que difunde
libremente en la membrana. Cuando Q acepta dos electrones o libera dos protones, es
reducida a su forma ubiquinol (QH
2
); cuando QH
2
libera dos electrones o acepta dos
protones, es oxidada a su forma original de ubiquinona (Q). Como resultado, si dos enzimas
estn organizadas de modo que Q es reducida de un lado de la membrana y QH
2
oxidada en
el otro, la ubiquinona se acoplar a estas reacciones y actuar como lanzadera de protones a
travs de la membrana.
23
Algunas cadenas de transporte de electrones bacterianas utilizan
quinonas diferentes, como la menaquinona, aparte de la ubiquinona.
24
Dentro de las protenas, los electrones son transferidos entre cofactores de flavina,
17
25
centros hierro-azufre, y citocromos. Existen varios tipos de centros hierro-azufre; los ms
simples que se encuentran en la cadena de transferencia de electrones consisten en dos
tomos de hierro unidos por dos tomos azufre inorgnico; estos son centros [2Fe2S]. El
segundo tipo, los centros [4Fe4S], contienen un cubo de cuatro tomos de hierro y cuatro
de azufre. Cada tomo de hierro en estos centros es coordinado por un aminocido,
generalmente por el tomo de azufre de la cistena. Los iones metlicos cofactores
atraviesan por reacciones redox sin unir o liberar protones, de modo que en la cadena de
transporte de electrones sirven solamente para el transporte de electrones entre protenas.
Los electrones se desplazan largas distancias a travs de las protenas saltando entre las
cadenas que forman estos cofactores.
26
Esto ocurre por efecto tnel, el cual es rpido sobre
distancias menores a 1,4
9
m.
27
Cadena de transporte de electrones en eucariotas
Artculo principal: Cadena de transporte de electrones.
Muchos procesos bioqumicos catablicos, tales como la gluclisis, el ciclo de Krebs y la
beta oxidacin, producen la coenzima reducida NADH. Esta coenzima contiene electrones
que tiene un elevado potencial de transferencia; es decir, que liberan una gran cantidad de
energa tras su oxidacin. Sin embargo, la clula no libera toda esta energa a la vez, sino
sera una reaccin incontrolable. En vez de ello, los electrones eliminados del NADH y
transferidos al oxgeno a travs de una serie de enzimas cada una de las cuales libera una
pequea cantidad de energa. Este conjunto de enzimas, que consiste en complejos, del I al
IV, llamado cadena de transporte de electrones se encuentra en la membrana de la
mitocondria. El succinato tambin es oxidado por la cadena de transporte de electrones,
pero entra en la va metablica por un punto diferente.
En eucariotas, las enzimas en este sistema de transporte de electrones utilizan la energa
liberada de la oxidacin de NADH para bombear protones a travs de la membrana interna
mitocondrial. Esto provoca una acumulacin de protones en el espacio intermembrana, y
genera un gradiente electroqumico a travs de la membrana. La energa almacenada en este
potencial es luego utilizada por la ATP sintasa para producir ATP. La fosforilacin
oxidativa en las mitocondrias de organismos eucariotas es el ejemplo de este proceso mejor
comprendido. Las mitocondrias estn presentes en casi todos los eucariotas, con la
excepcin de los protozoarios anaerbicos tales como Trichomonas vaginalis que en su
lugar reducen protones a hidrgeno en una reminiscencia de mitocondria llamada
hidrogenosoma.
28
Se ha comprobado que las enzimas de la cadena respiratoria se sitan preferentemente en la
membrana de las crestas mitocondriales. La membrana crestal est enriquecida en los
componentes de estos complejos, aproximadamente en un 70% del total. Se ha sugerido
que esta distribucin asimtrica podra deberse a que las juntas crestales suponen una
barrera dinmica.
29
Enzimas respiratorias y sustratos tpicos de eucariotas.
Enzima respiratoria Par redox
Potencial medio
(Volts)
NADH deshidrogenasa NAD
+
/ NADH 0,32
30
Succinato deshidrogenasa FMN o FAD / FMNH
2
o FADH
2
0,20
30
Complejo del citocromo bc
1
Coenzima Q10
ox
/ Coenzima Q10
red
+0,06
30
Complejo del citocromo bc
1
Citocromo b
ox
/ Citocromo b
red
+0,12
30
Complejo IV Citocromo c
ox
/ Citocromo c
red
+0,22
30
Complejo IV Citocromo a
ox
/ Citocromo a
red
+0,29
30
Complejo IV O
2
/ HO
-
+0,82
30
Condiciones: pH = 7
30
NADH- ubiquinona oxidorreductasa (complejo I)
Artculo principal: NADH deshidrogenasa.
Vase tambin: Anexo:Subunidades de la NADH deshidrogenasa.
Estructura molecular del complejo I por cristalografa de rayos X de Thermus thermophilus.
MMDB ID 82358 .
La NADH-ubiquinona oxidorreductasa, tambin conocida como NADH deshidrogenasa o
complejo I, es el primer complejo proteico en la cadena de transporte de electrones. Es uno
de ensamblajes enzimticos de membrana de mayor tamao, y el mayor de la cadena
respiratoria.
En trminos generales, la reaccin que cataliza es la oxidacin de NADH y la transferencia
de dos electrones a una quinona, normalmente una ubiquinona de entre 8 y 10 isoprenilos,
aunque admite varios sustratos anlogos. Posteriormente utiliza la energa liberada en esta
reaccin para la translocacin de cuatro protones desde la matriz al espacio de
intermembrana. La existencia de complejos I translocadores de Na
+
, aunque ha sido
postulado en procariotas, a da de hoy no se sustenta en la evidencia.
31
En bacterias marinas
y patgenas, como Vibrio cholerae existe una enzima diferente y sin aparente homologa, la
NADH:Ubiquinona oxidoreductasa dependiente de sodio, que bombea un ion Na
+
por
electrn en lugar protones.
32
La ecuacin global de esta reaccin es:
33
Esta reaccin tiene dos componentes termodinmicamente distintos: Uno muy favorable, la
transferencia de dos electrones desde NADH hasta la quinona. Los siguientes parmetros
para las correspondientes semirreacciones pueden variar por las condiciones de solucin, de
membrana y de la posicin de la cabeza de la quinona dentro de ella:
Lo cual nos da un
Mecanismo cataltico de la reaccin red/ox
Ruta de los electrones entre los centros hierro-sulfuro de la NADH deshidrogenasa
La reaccin global de oxidacin de la quinona por NADH tiene lugar a una velocidad
elevadsima (K
cat
500 s
-1
). La cintica y el mecanismo cataltico concreto se infieren de
varios estudios, de tipo estructural a partir de la cristalografa de rayos X del complejo I de
T. termophilus y de estudios de EPR a muy bajas temperaturas, conocida como "freeze
quenching".
34
La longitud que recorren los electrones desde el centro de unin a flavina
hasta el ltimo centro, el N2 es de unos 90 . El primer paso consiste en la transferencia de
dos electrones desde el NADH a la Flavina mononucletido en la subunidad NDFUV1.
Aunque no est probado, parece ser que lo ms probable es que esto suceda mediante
transferencia del hidruro, (o sea, dos electrones y un protn) evitando de esa manera la
formacin del intermediario NAD
.
, que es inestable. Los estudios estructurales en T.
thermophilus avalan esta posibilidad. Para ello, el NADH "apilara" su anillo nicotinamida
sobre el anillo isoaloxazina de la flavina, siendo el carbono C4 el donante de electrones en
el NADH, y el aceptor sera el Carbono C5 de la flavina, separados ambos una distancia de
unos 3,5 . En B.Taurus, a PH=7,8, los potenciales de NAD
+
(-0,35 V) y de la flavina (-
0,38 V)son muy prximos, de modo que este paso es reversible. Su velocidad es muy
elevada: El proceso de unin de NADH, transferencia del hidrido y liberacin de NAD
+
tiene una K
cat
NADH
/K
m
NADH
>1 x 10
7
M
-1
s
-135
Es decir, que tiene lugar en un tiempo menor
de 90 s, lo cual est por debajo de la capacidad de medicin de los instrumentos actuales
ms precisos.
34
El segundo paso es muy importante, porque los dos electrones no son transferidos
simultneamente a la quinona: Uno de ellos pasa a gran velocidad (90s) por toda la
cadena de centros [Fe-S] hacia el ltimo de ellos, el N2, prximo a la quinona, mientras que
el otro es transferido a un centro prximo a la flavina (12 ), el N1a y a la misma
velocidad, por lo que se supone que ambos centros tienen el mximo potencial reductor de
toda la enzima. Una vez oxidados ambos centros, la enzima parece "pararse" 1ms, lo cual
parece indicar que ese es el periodo en el que la enzima an permanece ligada al NAD
+
para evitar la entrada de un nuevo NADH. Dado que el centro ms cercano es el N3, y est
en la va de N2, es muy probable que el primero de los electrones parta hacia este centro,
dejando durante un breve instante a la flavina como un intermediario flavosemiquinona. A
partir de ah, el electrn que entra en N3 parte hacia los centros N1b, N4 y N5. Todos ellos
tienen un potencial redox muy similar, de modo que el electrn estara "equilibrado"
movindose entre ellos . La velocidad a la que tiene lugar la transmisin desde el paso
limitante, es decir, el ms lento (que o bien es la oxidacin del NADH o la reduccin de
FMN) hasta la quinona avala la idea de que esto se produce por efecto tnel, unido a que
todos los centros, salvo el N7 se encuentran por debajo de la distancia limitante de 14 .
36
Lo cierto es que durante el tiempo que la enzima aparentemente permanece unida al
NAD
<+
, no se detectan apenas seales del intermediario ubisemiquinona, lo cual significa
que no es transferido a la semiquinona, y tampoco se detecta una cada significativa de
energa libre. Se han propuesto varias explicaciones: El segundo electrn sera "retenido"
en el centro N1a para evitar que se forme el intermediario flavosemiquinona, que podra
generar radicales superxido, puesto que este centro es fcilmente accesible al oxgeno.
Entre tanto, el segundo electrn generara un cambio conformacional suficiente para que
pueda pasar el segundo y de esa manera ser transferidos casi simultneamente a la quinona.
En este momento se detecta el descenso en la energa libre.
36
El lugar donde se une la
quinona, entre las subunidades hidrofbica e hidroflica parece tener la suficiente holgura
para aceptar una gran variedad de bloqueantes.
37
Este sistema tambin puede producir radicales superxido, pero la cantidad y los lugares
donde se producen, as como los mecanismos y proporciones concretas son objeto de
mucha controversia y problemas de interpretacin; aunque deben ser elevados, se discuten
las cifras de 1-4% del oxgeno respirado para todo el sistema OXPHOS.
38
Estructura funcional
Hasta el momento no se tenan datos completos de cristalografa de rayos X del complejo
con resolucin suficiente, pero recientemente se ha podido lograr un modelo para la
bacteria Thermus thermofilus de entre 3,3-4 , con lo que se estn esclareciendo algunos
detalles del mecanismo cataltico que eran desconocidos.
37
En mitocondrias bovinas es un heteromultmero que consta de 45 subunidades, con una
masa molecular de 969 kilodaltons (kDa).
39
40
41
En procariotas su tamao es menor, y
tpicamente est formada por 14 subunidades y 10 cofactores, con un tamao aproximado
de 550 KDa.
42
Todas ellas cuentan homlogos en la forma mitocondrial, y se cree que
forman la llamada "enzima mnima" o nuclear, ya que se considera que son suficientes para
la transduccin energtica.
43
En plantas y algas el nmero de subunidades totales es 30, y
en hongos, 37.
44
Recientemente un anlisis ha encontrado homlogos de tres de estas
protenas supernumerarias en el complejo I de -proteobacterias, consideradas las
antepasadas de las mitocondrias.
45
El resto de subunidades del complejo I mitocondrial, llamadas "accesorias", o
"supernumerarias", vara en su nmero segn las especies, tienen funciones enzimticas
aparentemente no relacionadas con la transduccin energtica, y su funcin no se
comprende completamente.
46
Las siete subunidades "nucleares" del dominio intrnseco o de
membrana son codificadas por el genoma mitocondrial, mientras que el resto lo son por el
genoma nuclear. El ensamblaje de la enzima es muy complejo y no conocido en su
totalidad, producindose patologas si surgen defectos.
47
El complejo, que tiene forma de "L" consta de dos partes: una hidroflica o extrnseca, que
mira a la matriz o "lado P" de la membrana, y otra embebida en la propia membrana,
llamada porcin hidrofbica o intrnseca. Las siete protenas "nucleares" codificadas por el
genoma mitocondrial se encuentran todas en esta porcin. La enzima bovina, cuando se
purifica en presencia de agentes caotrpicos suaves, puede disociarse en cuatro
subcomplejos segn las condiciones de tratamiento: I que comprende toda la porcin
extrnseca (I) y parte de la intrnseca (I) y la parte I, que comprende casi toda la parte
intrnseca. Funcionalmente consta de tres mdulos: el mdulo N, que une NADH y captura
sus electrones transmitindolos al FMN y contiene los dos grupos prostticos [2Fe-2S], el
mdulo Q, que contiene el resto de centros hierro sulfuro y transfiere esos electrones a la
quinona, y por ltimo el mdulo P, encargado del bombeo de protones.
47
Regulacin
La regulacin de la actividad del complejo I se produce principalmente por tres
mecanismos: Control de la expresin gnica, integracin en supercomplejos
("respirasomas") e interacciones con otras protenas, en especial, modificaciones
postaduccionales.
39
Complejos auxiliares
Los complejos auxiliares de la cadena respiratoria son un grupo de complejos
multiproteicos que realizan la transferencia de electrones sin bombear protones al espacio
de intermembrana. En la mayora de los casos ello es debido a que el potencial de
reduccin de sus sustratos est muy prximo al de las quinonas y es insuficiente para la
translocacin de protones. Tambin se consideran dentro de este grupo las llamadas
"oxidasas alternativas", que transfieren electrones al oxgeno sin pasar por el complejo III y
la citocromo oxidasa (complejo IV).
48
Succinato-Q oxidorreductasa (complejo II)
Complejo II: Succinato-Q oxidorreductasa.
La enzima succinato-Q oxidorreductasa, tambin conocida como complejo II o sucinato
deshidrogenasa, es el segundo punto de entrada en la cadena de transporte de electrones.
49
Es inusual debido a que esta enzima es la nica que forma parte de los procesos del ciclo de
Krebs y de la cadena de transporte de electrones. El complejo II consiste en cuatro
subunidades de protenas y contiene unida como cofactor la flavn adenn dinucletido
(FAD), centros hierro-azufre, y un grupo hemo que no participa en la transferencia de
electrones hacia la coenzima Q, pero que se cree es importante en disminuir la produccin
de especies reactivas del oxgeno.
50
51
Oxida el succinato a fumarato y reduce la
ubiquinona. Debido a que esta reaccin libera menos energa que la oxidacin de NADH, el
complejo II no transporta electrones a travs de la membrana y no contribuye al gradiente
de protones.
En algunos eucariotas, tales como el helminto Ascaris suum, una enzima similar al
complejo II, fumarato reductasa (menaquinol:fumarato oxidorreductasa, o QFR), opera de
forma reversa oxidando ubiquinol y reduciendo fumarato. Esto permite al helminto
sobrevivir en el ambiente anaerbico del intestino grueso, llevando a cabo una fosforilacin
oxidativa anaerbica con fumarato como aceptor de electrones.
52
Otra funcin no
convencional del complejo II es observada en el parsito que provoca la malaria
Plasmodium falciparum. En este caso, la accin invertida del complejo II como oxidasa es
importante para regenerar el ubiquinol, el cual el parsito utiliza como una forma inusual de
biosntesis de pirimidina.
53
Flavoprotena de transporte de electrones Q oxidorreductasa
La flavoprotena de transporte de electrones ubiquinona oxidorreductasa (oxidorreductasa
ETF-Q), tambin conocida como flavoprotena de transporte de electrones
deshidrogenasa, es el tercer punto de entrada a la cadena de transporte de electrones. Es
una enzima que acepta electrones de la flavoprotena de transferencia de electrones en la
matriz mitocondrial, y utiliza estos electrones para reducir ubiquinona.
54
Esta enzima
contiene una flavina y un centro [4Fe4S], pero, a diferencia de otros complejos
respiratorios, se une a la superficie de la membrana y no atraviesa la bicapa lipdica.
55
En mamferos, esta ruta metablica es importante en la beta oxidacin de cidos grasos y el
catabolismo de aminocidos y colinas, al aceptar electrones de mltiples acetil-CoA
deshidrogenasas.
56
57
En plantas, la oxidorreductasa ETF-Q tambin es importante en la
respuesta que permite la supervivencia por extensos periodos de oscuridad.
58
Reductasas y oxidasas alternativas
Muchos organismos eucariotas poseen cadenas de transporte de electrones diferentes a la de
los mamferos, que difieren mucho de las ms estudiadas de estos ltimos (descritas
anteriormente). Por ejemplo, en plantas, existen NADH oxidasas que oxidan el NADH en
el citosol en lugar de la matriz mitocondrial, y transfieren estos electrones a las reservas de
ubiquinona.
59
Estas enzimas no transportan protones, y por ello, reducen ubiquinona sin
alterar el gradiente electroqumico a travs de la membrana interna.
60
Otro ejemplo de cadena de transporte de electrones divergente es la oxidasa alternativa,
que es encontrada en plantas, as como algunos hongos, protistas y posiblemente algunos
animales.
61
62
Esta enzima transfiere electrones directamente del ubiquinol al oxgeno.
63
Las rutas de transporte de electrones producidos por estas oxidasas alternativas de NADH y
ubiquinona tienen un menor rendimiento de ATP que la ruta completa. Las ventajas que se
obtienen por estas rutas ms cortas no son del todo conocidas. Sin embargo, las oxidasas
alternativas son producidas como respuesta a situaciones de estrs ambiental, como el fro,
especies reactivas del oxgeno e infeccin por patgenos, as como otros factores que
inhiben la cadena de transporte de electrones completa.
64
65
Las rutas alternativas podran,
por lo tanto, aumentar la resistencia de los organismos ante daos, reduciendo el estrs
oxidativo.
66
Q-citocromo c oxidorreductasa (complejo III)
Transferencia de electrones en dos pasos, en el complejo III: Q-citocromo c
oxidorreductasa. Luego de cada paso, Q (en la parte superior de la figura) abandona la
enzima.
La Q-citocromo c oxidorreductasa tambin conocida como citocromo c reductasa,
complejo del citocromo bc
1
, o simplemente complejo III.
67
68
En mamferos, esta enzima es
un dmero, con cada subunidad del complejo conteniendo once subunidades de protenas,
un centro hierro-azufre [2Fe-2S] y tres citocromos: un citocromo c
1
y dos citocromos b.
69
Un citocromo es un tipo de protena de transferencia de electrones que contiene al menos
un grupo hemo. Los tomos de hierro dentro del grupo hemo del complejo III alternan entre
sus estados de oxidacin reducido (+2) y oxidado (+3) mientras los electrones son
transferidos a travs de la protena.
La reaccin catalizada por el complejo III es la oxidacin de una molcula de ubiquinol y la
reduccin de dos molculas de citocromo c, una protena hemo libremente asociada con la
mitocondria. A diferencia de la coenzima Q, que transporta dos electrones, el citocromo c
transporta solo uno.
Debido a que solo uno de los electrones puede ser transferido desde el donante QH
2
al
aceptor citocromo c, a la vez, el mecanismo de reaccin del complejo III es ms elaborado
que aquellos de los otros complejos respiratorios, y se da en dos pasos, llamados ciclo Q.
70
En el primer paso, la enzima se une a tres sustratos, primero, QH
2
, el cual es luego oxidado,
siendo un electrn transferido al segundo sustrato, el citocromo c. Los dos protones
liberados de QH
2
pasan al espacio intermembrana. El tercer sustrato es Q, el cual acepta el
segundo electrn de QH
2
y es reducido a Q
.-
, el cual es un radical libre de ubisemiquinona.
Los primeros dos sustratos son liberados, pero este intermediario de ubisemiquinona
permanece unido. En el segundo paso, una segunda molcula de QH
2
es unida y de nuevo
pasa su primer electrn al aceptor citocromo c. El segundo electrn es transferido a la
ubisemiquinona unida, reducindola a QH
2
mientras gana dos protones de la matriz
mitocondrial. Este QH
2
es luego liberado de la enzima.
71
Como la coenzima Q es reducida a ubiquinol en el lado interno de la membrana y oxidado a
ubiquinona en el externo, hay una transferencia neta de electrones a travs de la membrana,
aadidos al gradiente de protones.
17
El mecanismo ms bien complejo de dos pasos por el
cual sucede esto es importante, ya que incrementa la eficiencia de la transferencia de
protones. Si, en lugar del ciclo Q, una molcula de QH
2
fuese utilizada directamente para
reducir dos molculas del citocromo c, la eficiencia se reducira a la mitad, siendo
transferido solo un protn por citocromo c reducido.
17
Citocromo c oxidasa (complejo IV)
Artculo principal: Citocromo c oxidasa.
Complejo IV: citocromo c oxidasa.
La citocromo c oxidasa, tambin conocida como complejo IV, es el complejo final de
protenas en la cadena de transporte de electrones.
72
En mamferos esta enzima posee una
estructura extremadamente compleja y contiene trece subunidades, dos grupos hemo, as
como mltiples iones metlicos como cofactores en todas, tres tomos de cobre, uno de
magnesio y uno de zinc.
73
Esta enzima media la reaccin final en la cadena de transporte de electrones y los transfiere
al oxgeno, mientras bombea protones a travs de la membrana.
74
El aceptor de electrones
final es el oxgeno, llamado tambin aceptor terminal de electrones, el cual es reducido a
agua en este paso. Tanto el bombeo directo de protones y la consumicin de protones de la
matriz en la reduccin de oxgeno contribuyen al gradiente de protones. La reaccin
catalizada es la oxidacin de citocromo c y la reduccin de oxgeno:
Organizacin de complejos
El modelo original sobre como los complejos de la cadena respiratoria estn organizados
era que estos difundan libremente en la membrana mitocondrial.
75
Sin embargo, datos
recientes sugieren que los complejos podran formar estructuras de alto orden llamadas
supercomplejos o "respirasomas."
76
En este modelo varios complejos existen como
conjuntos organizados de enzimas que interaccionan entre ellas.
77
Estas asociaciones
podran permitir la canalizacin de sustratos entre varios complejos de enzimas,
aumentando su tasa y eficiencia en la transferencia de electrones.
78
Dentro de los
supercomplejos presentes en mamferos, algunos componentes estn presentes en mayor
cantidad que otros, con una tasa entre complejos I/II/III/IV y ATP sintasa de
aproximadamente 1:1:3:7:4.
79
Sin embargo, el debate sobre la hiptesis de estos
supercomplejos an no est resuelta, ya que algunos datos no parecen ajustarse a este
modelo.
41
80
Cadena de transporte de electrones en procariotas
Vase tambin: Metabolismo microbiano.
En contraste con la similaridad general en cuanto a estructura y funcin de la cadena de
transporte de electrones en eucariotas, las bacterias y arqueas poseen una gran variedad de
enzimas de transferencia de electrones. Estas utilizan un conjunto igualmente amplio de
sustratos.
81
Al igual que en los eucariotas, la cadena de transporte de electrones de los
procariotas utiliza la energa liberada de la oxidacin de un sustrato para bombear iones a
travs de la membrana y generar un gradiente electroqumico. En bacterias, la fosforilacin
oxidativa en Escherichia coli ha sido estudiada en profundidad, mientras que los sistemas
de arqueas han sido poco estudiados.
82
La principal diferencia entre la fosforilacin oxidativa en procariotas y eucariotas es que
tanto bacterias como arqueas utilizan una gran variedad de donantes y aceptores de
electrones. Esto permite a los procariotas desarrollarse en una amplia variedad de
condiciones ambientales.
83
En E. coli, por ejemplo, la fosforilacin oxidativa puede ser
llevada a cabo por un gran nmero de pares de agentes reductores y oxidantes, los cuales
son listados a continuacin. El potencial medio de un qumico mide cuanta energa es
liberada cuanto este es oxidado o reducido, teniendo los agentes reductores un potencial
negativo y los agentes oxidante un potencial positivo.
Enzimas respiratorias y sustratos en E. coli.
84
Enzima respiratoria Par redox
Potencial
medio
(Volts)
Formiato deshidrogenasa Bicarbonato / Formiato 0,43
Hidrogenasa Protn / Hidrgeno 0,42
NADH deshidrogenasa NAD
+
/ NADH 0,32
Glicerol-3-fosfato
deshidrogenasa
DHAP / Gli-3-P 0,19
Piruvato oxidasa
Acetato + Dixido de carbono /
Piruvato
?
Lactato deshidrogenasa Piruvato / Lactato 0,19
D-aminocido deshidrogenasa
2-oxocido + Amonaco / D-
aminocido
?
Glucosa deshidrogenasa Gluconato / Glucosa 0,14
Succinato deshidrogenasa Fumarato / Succinato +0,03
Ubiquinol oxidasa Oxgeno / Agua +0,82
Nitrato reductasa Nitrato / Nitrito +0,42
Nitrito reductasa Nitrito / Amonaco +0,36
Dimetil sulfxido reductasa DMSO / DMS +0,16
Trimetilamina N-xido
reductasa
TMAO / TMA +0,13
Fumarato reductasa Fumarato / Succinato +0,03
Como se muestra en la tabla anterior, E. coli es capaz de crecer con agentes reductores
como el formiato, hidrgeno, o lactato como donantes de electrones, y nitrato, DMSO, u
oxgeno como aceptores.
83
La mayor diferencia en el potencial entre un agente oxidante y
uno reductor indica una mayor liberacin de energa cuando reaccionan. Dentro de estos
compuestos, el par succinato/fumarato es inusual, ya que su potencial es muy cercano a
cero. El succinato puede ser oxidado a fumarato si se encuentra en presencia de un fuerte
agente oxidante como el oxgeno, y el fumarato puede ser reducido utilizando un fuerte
agente reductor como lo es el formiato. Estas reacciones alternativas son catalizadas por la
succinato deshidrogenasa y la fumarato reductasa, respectivamente.
85
Algunos procariotas utilizan pares redox que poseen una muy pequea diferencia de
potencial. Por ejemplo, las bacterias nitrificantes tales como Nitrobacter oxidan nitrito a
nitrato, donando electrones al oxgeno. La pequea cantidad de energa liberada en esta
reaccin es suficiente como para bombear protones y generar ATP, pero no es suficiente
como para producir NADH o NADPH directamente para su uso en el anabolismo.
86
Este
problema es solucionado utilizando una nitrito oxidorreductasa para producir la suficiente
fuerza protn motriz como para hacer funcionar la cadena de transporte de electrones en
sentido inverso, haciendo que el complejo I genere NADH.
87
88
Los procariotas controlan su uso de donantes y aceptores de electrones variando las
enzimas que producen, en respuesta a condiciones ambientales.
89
Esta flexibilidad es
posible porque diferentes oxidasas y reductasas utilizan las mismas reservas de ubiquinona.
Esto permite que muchas combinaciones de enzimas funcionen en conjunto, unidas por un
intermediario comn de ubiquinol.
84
Por ello es que estas cadenas respiratorias tienen un
diseo modular fcilmente intercambiable con otros conjuntos de enzimas.
Adems de esta diversidad metablica, los procariotas tambin poseen una variedad de
isoenzimas diferentes enzimas que catalizan la misma reaccin. Por ejemplo, en E. coli,
hay dos tipos diferentes de ubiquinol oxidasa utilizando oxgeno como un aceptor de
electrones. Bajo condiciones aerbicas, la clula utiliza una oxidasa con baja afinidad por el
oxgeno que es capaz de transportar dos protones por electrn. Sin embargo, si los niveles
de oxgeno caen, cambian a una oxidasa que transfiere solo un protn por electrn, pero
tiene una elevada afinidad por el oxgeno.
90
ATP sintasa (complejo V)
Artculo principal: ATP sintasa.
ATP sintasa, tambin llamada complejo V, es la enzima final del proceso de la fosforilacin
oxidativa. Esta enzima se encuentra en todas las formas de vida y funciona de la misma
manera tanto en procariotas como en eucariotas.
91
Esta enzima usa la energa almacenada
en un gradiente de protones a travs de la membrana para llevar a cabo la sntesis de ATP
desde ADP y fosfato (P
i
). Las estimaciones del nmero de protones necesarios para
sintetizar una molcula de ATP oscilan entre tres y cuatro,
92
93
y algunos investigadores
sugieren que las clulas pueden variar esta proporcin, para ajustarse a diferentes
condiciones.
94
Esta reaccin de fosforilacin es un equilibrio, que puede ser cambiado alterando la fuerza
protn motriz. En ausencia de una fuerza protn motriz, la reaccin de la ATP sintasa se
desplazar hacia la izquierda, hidrolizando ATP y bombeando protones fuera de la matriz a
travs de la membrana. Sin embargo, cuando la fuerza protn motriz es alta, la reaccin es
forzada a desplazarse en la direccin opuesta; de izquierda a derecha, permitiendo el flujo
de protones en el sentido de su gradiente de concentracin produciendo ADP desde ATP.
91
Es ms, en la cercanamente relacionada protena H+-ATPasa tipo vacuolar, la misma
reaccin es usada para acidificar los compartimentos celulares, bombeando protones e
hidrolizando ATP.
95
La ATP sintasa es un complejo masivo de protenas con forma de hongo. El complejo de
enzimas en mamferos contiene 16 subunidades y posee una masa de aproximadamente 600
kilodaltons.
96
La porcin embebida en la membrana es llamada F
O
y contiene un anillo de
subunidades c y el canal de protones. El pednculo y la parte superior esfrica es llamada
F
1
y es el sitio donde ocurre la sntesis de ATP. La porcin esfrica del extremo de F
1
contiene seis protenas de dos tipos diferentes (tres subunidades y tres subunidades ),
mientras que el "pednculo" consiste solo en una protena: la subunidad , con un extremo
extendindose en la esfera de subunidades y .
97
Ambas subunidades, y se unen a
nucletidos, pero solo la subunidad cataliza la sntesis de ATP. Alcanzando por la base
una porcin de F
1
e introducindose en la membrana se encuentra una larga subunidad en
forma de bastn que ancla las subunidades y en la base de la enzima.
A medida que los protones atraviesan la membrana a travs del canal en la base de la ATP
sintasa, F
O
entra en rotacin.
98
Esta rotacin puede ser provocada por cambios en la
ionizacin de aminocidos en el anillo de subunidades c provocando interacciones
electrostticas que impulsan el anillo de subunidades c a travs del canal de protones.
99
Este
anillo de rotacin provoca la rotacin del eje central (el pednculo de la subunidad )
dentro de las subunidades y . Estas subunidades son incapaces de rotar debido al brazo
lateral que acta como un esttor. Este movimiento del extremo de la subunidad en el
interior de la esfera de subunidades y provee de energa para los sitios activos en las
subunidades para llevar a cabo un ciclo de movimientos que generan y luego liberan
ATP.
100
Mecanismo de la ATP sintasa. El ATP se muestra en rojo, el ADP y fosfato en rosado y la
subunidad rotando, en negro.
La reaccin de sntesis de ATP es llamada "mecanismo de cambio de unin" del ingls
binding change mechanism e involucra el sitio activo de una subunidad en ciclando a
travs de tres estados.
11
En el estado "abierto", el ADP y el fosfato entran en el sitio activo
(mostrado en marrn en el diagrama). La protena luego captura las molculas y se une a
ellas ligeramente (mostrado en rojo). La enzima luego cambia su conformacin nuevamente
y acerca las molculas, con el sitio activo en el estado final (mostrado en rosado) uniendo el
recin formada molcula de ATP con una elevada afinidad. Finalmente, el sitio activo cicla
de nuevo a su estado original abierto, liberando ATP y unindose a ms ADP y fosfato,
preparndose as para el prximo ciclo.
En algunas bacterias y arqueas, la sntesis de ATP es llevada a cabo por el movimiento de
iones sodio a travs de la membrana celular, en lugar del movimiento de protones.
101
102
Arqueas tales como Methanococcus poseen la sintasa A
1
A
o
, una forma de la enzima que
contiene protenas adicionales con muy poca similaridad en cuanto a su secuencia con otras
subunidades de ATP sintasa de bacterias o eucariotas. Es posible que en algunas especies,
la forma A
1
A
o
de la enzima sea una ATP sintasa especializada en el transporte de sodio,
103
pero esto puede que no sea as en todos los casos.
102
Inhibidores
Existen varias drogas y toxinas que inhiben la fosforilacin oxidativa. Aunque estas toxinas
inhiben slo una enzima en la cadena de transporte de electrones, la inhibicin de cualquier
paso detiene el resto del proceso. Por ejemplo, cuando la oligomicina inhibe a la enzima
ATP sintasa, los protones no pueden ser devueltos a la mitocondria.
104
Como resultado, las
bombas de protones son incapaces de operar, y el gradiente se torna demasiado fuerte como
para ser superado. NADH deja de ser oxidado y el ciclo del cido ctrico deja de operar
porque la concentracin de NAD
+
cae por debajo de la concentracin que estas enzimas
pueden utilizar.
Cianuro: El cianuro es un potente veneno que inhibe la cadena de transporte de
electrones y la fosforilacin oxidativa bloqueando el paso de electrones del
citocromo a3 al oxgeno en el complejo IV. Esto bloquea la cadena de transporte de
electrones, lo que conlleva que no se genere el gradiente de protones y por tanto no
se produzca la obtencin de ATP con la consiguiente acumulacin de NADH y
FADH2. Adems el cianuro se une a la hemoglobina impidiendo tambin la
captacin de oxgeno.
Oligomicina: La oligomicina, un antibitico producido por Streptomyces, inhibe a
la ATPasa al unirse a la subunidad Fo e interferir en el transporte de H+ a travs de
Fo, inhibe por lo tanto la sntesis de ATP y como consecuencia de no eliminar el
gradiente de protones se inhibe tambin a la cadena de transporte de electrones. por
lo tanto disminuir el consumo de O2 y se acumular NADH y FADH2.
2,4-Dinitrofenol: El 2,4-dinitrofenol es un agente desacoplante, es decir, desacopla
la cadena de transporte de electrones de la fosforilacin oxidativa. El
desacoplamiento se produce ya que el 2,4-dinitrofenol hace permeable a los
protones la membrana interna mitocondrial deshaciendo la relacin obligada entre la
cadena respiratoria y la fosforilacin oxidativa. El efecto de este veneno por tanto es
la inhibicin de la produccin de ATP al no generarse el gradiente de pH pero si
permite que la cadena de transporte de electrones contine funcionando.
Compuesto Uso Efecto en la fosforilacin oxidativa
Cianuro y
monxido de
carbono
Veneno
Inhiben la cadena de transporte de electrones ya que se unen
ms fuertemente que el oxgeno a los centros FeCu en la
citocromo c oxidasa, y por tanto evitan la reduccin del
oxgeno.
105
Oligomicina Antibitico
Inhibe la ATP sintasa bloqueando el flujo de protones a travs
de la subunidad F
o
.
104
CCCP
2,4-
Dinitrofenol
Veneno
Ionforos que interrumpen el gradiente de protones
transportando estos a travs de la membrana. Este ionoforo
desacopla el bombeo de electrones de la ATP sintasa debido a
que transporta electrones a travs de la membrana mitocondrial
interna.
106
Rotenona Pesticida
Impide la transferencia de electrones del complejo I a la
ubiquinona al bloquear los sitios de unin a la ubiquinona.
107
Malonato y
oxaloacetato
Inhibidores competitivos de la succinato de hidrogenasa
(complejo II).
108
No todos los inhibidores de la fosforilacin oxidativa son toxinas. En el tejido adiposo
marrn, los canales de protones regulados llamados protenas desacopladoras son capaces
de desacoplar la respiracin de la sntesis de ATP.
109
Esta respiracin rpida produce calor,
y es particularmente importante como una va para mantener la temperatura corporal en la
hibernacin de los animales, aunque estas protenas pueden tambin tener una funcin ms
general en la respuesta de las clulas al estrs oxidativo.
110
Ciclo de Krebs invertido
Saltar a: navegacin, bsqueda
Esquema del ciclo de Krebs invertido
El ciclo de Krebs invertido (tambin llamado ciclo del cido tricarbooxlico invertido o
ciclo del cido ctrico invertido) es una ruta metablica utilizada por algunas bacterias
para producir compuestos orgnicos a partir de dixido de carbono y agua.
La reaccin es la opuesta al ciclo de Krebs: mientras que en el ciclo del cido ctrico
biomolculas complejas (glcidos) se oxidan a CO
2
y agua, el ciclo inverso toma CO
2
y
agua para sintetizar compuestos de carbono.
Este proceso es utilizado por ciertas bacterias, en ocasiones utilizando hidrgeno, sulfuro, o
tiosulfato como donantes de electrones.
1
2
La reaccin es una opcin metablica posible en las condiciones prebiticas de la Tierra y,
por tanto, tiene un gran inters en la investigacin del origen de la vida. Se ha observado
que algunos de los pasos del ciclo pueden ser catalizados por minerales.
3
También podría gustarte
- GlucolisisDocumento20 páginasGlucolisisvaleria de leonAún no hay calificaciones
- Ciclo de La UreaDocumento42 páginasCiclo de La UreaSagitario Solitario50% (2)
- Biosíntesis de Ácidos Grasos y TriglicéridosDocumento46 páginasBiosíntesis de Ácidos Grasos y TriglicéridosXimena Véliz DaudAún no hay calificaciones
- Digestión y Absorción de LípidosDocumento20 páginasDigestión y Absorción de LípidosmaitemedranoAún no hay calificaciones
- Gluconeogénesis: Síntesis de glucosa a partir de precursores no carbohidratosDocumento15 páginasGluconeogénesis: Síntesis de glucosa a partir de precursores no carbohidratosdora100% (1)
- Ciclo de KrebsDocumento33 páginasCiclo de KrebsLN Brenda Janeth Beltrán DíazAún no hay calificaciones
- Metabolismo de LípidosDocumento8 páginasMetabolismo de LípidosbiologiaibericaAún no hay calificaciones
- Cadena RespiratoriaDocumento2 páginasCadena RespiratoriaJesus RamirezAún no hay calificaciones
- GlucogenolisisDocumento15 páginasGlucogenolisisTammy Carrillo Recabarren100% (1)
- Ciclo KrebsDocumento45 páginasCiclo Krebsandres100% (5)
- Nucleósidos y NucleótidosDocumento2 páginasNucleósidos y NucleótidosAdriana RodriguezAún no hay calificaciones
- Sintesis de Acidos GrasosDocumento41 páginasSintesis de Acidos GrasosDiego Alejandro Cuevas Lau100% (1)
- LipidosDocumento33 páginasLipidosJunior HernándezAún no hay calificaciones
- AnabolismoDocumento19 páginasAnabolismoCrystal BurrisAún no hay calificaciones
- Síntesis del colesterol: de la acetil-CoA al mevalonatoDocumento2 páginasSíntesis del colesterol: de la acetil-CoA al mevalonatoDvid MedranAún no hay calificaciones
- Anabolismo y CatabolismoDocumento14 páginasAnabolismo y Catabolismocelss100% (2)
- GlucolisisDocumento26 páginasGlucolisisAle JoyaAún no hay calificaciones
- Ciclo de KrebsDocumento16 páginasCiclo de KrebsCarmen Flores100% (4)
- Metabolismo proteínas aminoácidos UNCPDocumento21 páginasMetabolismo proteínas aminoácidos UNCPRonald Astucuri PalaciosAún no hay calificaciones
- MetabolismoLípidosDocumento68 páginasMetabolismoLípidossayhandalAún no hay calificaciones
- Digestion de LipidosDocumento17 páginasDigestion de Lipidosqfb04100% (7)
- Metabolismo de Los LipidosDocumento49 páginasMetabolismo de Los Lipidospseudomedico011Aún no hay calificaciones
- Sesion 3 Sintesis de ProteinasDocumento41 páginasSesion 3 Sintesis de ProteinasAnonymous me3HTbZbh100% (2)
- GluconeogénesisDocumento18 páginasGluconeogénesisSergio Castillo100% (2)
- LipogenesisDocumento17 páginasLipogenesisErick Efren Diaz Rodriguez100% (1)
- El Ciclo de KrebsDocumento16 páginasEl Ciclo de KrebsClemente Peralta Serrano100% (2)
- CarbohidratosDocumento13 páginasCarbohidratosSergio Ferreyra100% (1)
- 7 LipidosDocumento89 páginas7 Lipidosrafael100% (1)
- Metabolismo de LipidosDocumento89 páginasMetabolismo de LipidosDavizasAún no hay calificaciones
- CarbohidratosDocumento28 páginasCarbohidratosAnonimo22100% (2)
- GlucolisisDocumento5 páginasGlucolisisDamaris BustamanteAún no hay calificaciones
- PROTEÍNASDocumento14 páginasPROTEÍNASJose Maravi100% (2)
- LÍPIDOSDocumento10 páginasLÍPIDOSRafael Angel Huiza Trujillo100% (3)
- LIPIDOSDocumento13 páginasLIPIDOSMiguel Angel Flores Gutierrez0% (1)
- Beta OxidaciónDocumento47 páginasBeta OxidaciónSuemi GpeAún no hay calificaciones
- Glucólisis: 10 reacciones para convertir glucosa en piruvato generando ATPDocumento1 páginaGlucólisis: 10 reacciones para convertir glucosa en piruvato generando ATPDavid100% (1)
- Fosforilacion OxidativaDocumento27 páginasFosforilacion Oxidativajosuekstillo100% (4)
- Ciclo de KrebsDocumento14 páginasCiclo de KrebsJhonatan RS100% (1)
- MitocondriaDocumento49 páginasMitocondriarodgam89% (9)
- Lípidos clasificación 40Documento91 páginasLípidos clasificación 40Nadia Torres100% (2)
- Biosintesis de LipidosDocumento24 páginasBiosintesis de LipidosAdrianaJurado100% (1)
- Metabolismo de Hidratos de CarbonoDocumento116 páginasMetabolismo de Hidratos de Carbonoromuzia50% (2)
- Rutas MetabolicasDocumento30 páginasRutas Metabolicasamilcar torresAún no hay calificaciones
- Vía de Las PentosasDocumento36 páginasVía de Las PentosasLuis Rodolfo LópezAún no hay calificaciones
- Proteínas 40Documento22 páginasProteínas 40aideetoledo18100% (2)
- Rutas MetabolicasDocumento33 páginasRutas MetabolicasJamie Jayjay Martinez100% (2)
- Grupos FuncionalesDocumento21 páginasGrupos FuncionalesPaola Saldías100% (2)
- Beta OxidaciónDocumento12 páginasBeta OxidaciónIvi100% (1)
- Las 20 Preguntas de La GlucolisisDocumento13 páginasLas 20 Preguntas de La GlucolisisJiemmy Benites0% (1)
- Síntesis de aminoácidos esenciales y no esenciales: funciones y beneficiosDocumento15 páginasSíntesis de aminoácidos esenciales y no esenciales: funciones y beneficiosmariela100% (1)
- ProteinasDocumento5 páginasProteinasRené Cariño100% (2)
- Rutas MetabolicasDocumento35 páginasRutas MetabolicassamAún no hay calificaciones
- ENZIMASDocumento59 páginasENZIMASÉrÌck PÂrédèsAún no hay calificaciones
- GLUCONEOGENESISDocumento32 páginasGLUCONEOGENESISzatanna66100% (2)
- Ciclo CelularDocumento45 páginasCiclo CelularAngel Bernuy100% (1)
- GlucolisisDocumento15 páginasGlucolisisalejo_1994244644100% (1)
- Bioquimica Glucogenolisis y GluconeogenesisDocumento53 páginasBioquimica Glucogenolisis y GluconeogenesisDaniel JLAún no hay calificaciones
- Herramientas de Gestión AmbientalDocumento5 páginasHerramientas de Gestión AmbientalAnto VorterixAún no hay calificaciones
- Auditoría AmbientalDocumento3 páginasAuditoría AmbientalAnto VorterixAún no hay calificaciones
- Casella Faro - Ingenieria y Derecho (Tomo I y II)Documento286 páginasCasella Faro - Ingenieria y Derecho (Tomo I y II)Anto VorterixAún no hay calificaciones
- Relaciones Entre OrganismosDocumento3 páginasRelaciones Entre OrganismosAnto VorterixAún no hay calificaciones
- Ejercicios Con ÁngulosDocumento1 páginaEjercicios Con ÁngulosAnto VorterixAún no hay calificaciones
- Apuntes LegislacionDocumento110 páginasApuntes LegislacionAnto VorterixAún no hay calificaciones
- Ejercicios de Resolucion de TriangulosDocumento5 páginasEjercicios de Resolucion de TriangulosMack Michelline Astorga PintoAún no hay calificaciones
- Bio 4Documento33 páginasBio 4fernando2674Aún no hay calificaciones
- Areas de Figuras PlanasDocumento13 páginasAreas de Figuras PlanasLuis Fernando100% (2)
- Criterios de DivisibilidadDocumento1 páginaCriterios de DivisibilidadAnto VorterixAún no hay calificaciones
- Resolver Las Ecuaciones de Primer GradoDocumento1 páginaResolver Las Ecuaciones de Primer GradoAnto VorterixAún no hay calificaciones
- Clasificación de AnimalesDocumento1 páginaClasificación de AnimalesAnto VorterixAún no hay calificaciones
- Codigos ASCIIDocumento1 páginaCodigos ASCIIAnto VorterixAún no hay calificaciones
- Criterios de DivisibilidadDocumento1 páginaCriterios de DivisibilidadAnto VorterixAún no hay calificaciones
- Ángulos: Problemas de cálculo y relaciones entre ángulosDocumento2 páginasÁngulos: Problemas de cálculo y relaciones entre ángulosdjkarAún no hay calificaciones
- Autovalores y AutovectoresDocumento12 páginasAutovalores y AutovectoresAntonela CapittiniAún no hay calificaciones
- Ejercicios de Resolucion de TriangulosDocumento5 páginasEjercicios de Resolucion de TriangulosMack Michelline Astorga PintoAún no hay calificaciones
- FPS - Tecnicas de Analisis de ErroresDocumento12 páginasFPS - Tecnicas de Analisis de ErroresAnto VorterixAún no hay calificaciones
- Ejercicios de PoleasDocumento6 páginasEjercicios de PoleasDouglas OrtegaAún no hay calificaciones
- Ejercicios QuímicaDocumento1 páginaEjercicios QuímicaAnto VorterixAún no hay calificaciones
- Clase SistemasDeNumeracionDocumento21 páginasClase SistemasDeNumeracionAnto VorterixAún no hay calificaciones
- 2 1 Limites de FuncionesDocumento6 páginas2 1 Limites de FuncionesmedallitaAún no hay calificaciones
- Fisica 1 ResueltosDocumento19 páginasFisica 1 Resueltosieslajara73% (11)
- Diagnóstico por ImagenDocumento155 páginasDiagnóstico por Imagenpetuso2207100% (3)
- Pasteleria Artesanal Recetas Basicas Secretos 7070 Completo PDFDocumento42 páginasPasteleria Artesanal Recetas Basicas Secretos 7070 Completo PDFZicury Ramírez MartínezAún no hay calificaciones
- 15 TaxonomiaDocumento34 páginas15 TaxonomiaGuillermo Gerardo Rivera GambiniAún no hay calificaciones
- Guía de estudio célulasDocumento3 páginasGuía de estudio célulasFrancisca Olivares100% (2)
- ArchaeopteryxDocumento21 páginasArchaeopteryxduanny123Aún no hay calificaciones
- Actividad de Aprendizaje DinamicaDocumento13 páginasActividad de Aprendizaje DinamicaLópez Vázquez Carlos YaelAún no hay calificaciones
- Completación de pozos en el Campo Lago AgrioDocumento38 páginasCompletación de pozos en el Campo Lago AgrioDarwin Limones Zamora100% (1)
- Presenta Medicina Deportiva A Educacion FisicaDocumento25 páginasPresenta Medicina Deportiva A Educacion FisicaJuan Carlos EspinoAún no hay calificaciones
- Qué es cromatina y cromátidaDocumento2 páginasQué es cromatina y cromátidaEricka Sagñay GuamanAún no hay calificaciones
- La Composición ArquitectónicaDocumento4 páginasLa Composición ArquitectónicaJohann VasquezAún no hay calificaciones
- HV Tobias BedoyaDocumento10 páginasHV Tobias BedoyaKjohana MezaAún no hay calificaciones
- El Alma Pública #9Documento100 páginasEl Alma Pública #9Raquel González LoyolaAún no hay calificaciones
- Estudio experimental de la caída libre y determinación de la gravedad gDocumento11 páginasEstudio experimental de la caída libre y determinación de la gravedad gDavid GarayAún no hay calificaciones
- Levantamiento de Una Poligonal Cerrada TopografiaDocumento16 páginasLevantamiento de Una Poligonal Cerrada TopografiaCristian FonsecaAún no hay calificaciones
- CronológicamenteDocumento19 páginasCronológicamenteyerg_123Aún no hay calificaciones
- Lana de Vidrio Aislanglass propiedadesDocumento6 páginasLana de Vidrio Aislanglass propiedadesEduardo VelasbeAún no hay calificaciones
- Biofísica y Fisiología de Ojo. UABP 9.-1Documento19 páginasBiofísica y Fisiología de Ojo. UABP 9.-1Cami EnglerAún no hay calificaciones
- 1 Asparagales OrchidaceaeDocumento14 páginas1 Asparagales OrchidaceaePlissken EderAún no hay calificaciones
- Glaciar TrabajoDocumento6 páginasGlaciar TrabajoPelao BorquezAún no hay calificaciones
- El Animal Sobre Sus Patas TraserasDocumento8 páginasEl Animal Sobre Sus Patas TraserasCarlos BracamonteAún no hay calificaciones
- Material de Apoyo para El Examen Final de Fundamentos Teoricos de Las CC - Ee (1er Semestre)Documento4 páginasMaterial de Apoyo para El Examen Final de Fundamentos Teoricos de Las CC - Ee (1er Semestre)Jc_garcia_68660% (1)
- El DiamanteDocumento9 páginasEl DiamanteJoseLuisRiveraAlpacaAún no hay calificaciones
- La Hipopede de EudoxoDocumento2 páginasLa Hipopede de EudoxoFernandez CinthyaAún no hay calificaciones
- Características de La Carta ComercialDocumento4 páginasCaracterísticas de La Carta ComercialEdwin AilónAún no hay calificaciones
- Semana 5 Resultante de Un Sistema de FuerzasDocumento6 páginasSemana 5 Resultante de Un Sistema de FuerzasMariaAún no hay calificaciones
- BotanicaDocumento7 páginasBotanicaLenaVillarroel100% (2)
- ANDESITADocumento17 páginasANDESITARicardo DamianAún no hay calificaciones
- Kinovea, Centro de Masa y de Gravedad, Equilibrio y Estabilidad, Valores de Inclinaciones Normales en Las Articulaciones.Documento6 páginasKinovea, Centro de Masa y de Gravedad, Equilibrio y Estabilidad, Valores de Inclinaciones Normales en Las Articulaciones.Carlos Eduardo Guarguati SuarezAún no hay calificaciones
- Ing AmbientalDocumento138 páginasIng AmbientalCarlos VegaAún no hay calificaciones
- Puntos Criticos en La Congelacion y PrecoccionDocumento4 páginasPuntos Criticos en La Congelacion y PrecoccionNatalia RiosAún no hay calificaciones
- Sistemas funcionales cerebrales según LuriaDocumento3 páginasSistemas funcionales cerebrales según LuriaAna Liz GarcíaAún no hay calificaciones
- Rocas MetamorficasDocumento10 páginasRocas MetamorficasMary GabAún no hay calificaciones