Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Anti Bio Grama
Cargado por
mabeluzaccuno0 calificaciones0% encontró este documento útil (0 votos)
6 vistas14 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
6 vistas14 páginasAnti Bio Grama
Cargado por
mabeluzaccunoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 14
El antibiograma es la prueba microbiolgica que se realiza para determinar la susceptibilidad
(sensibilidad o resistencia) de una bacteria a un grupo de antibiticos. Las tcnicas de
antibiograma son las utilizadas en el laboratorio de microbiologa para estudiar la actividad de
los antimicrobianos frente a los microorganismos responsables de las infecciones.
Se considera como antimicrobiano cualquier sustancia con capacidad de matar o al menos de
inhibir el crecimiento de los microorganismos y que sea susceptible de utilizacin como
tratamiento en los pacientes. Pueden ser naturales, sintticos o semisintticos (modificacin
qumica de un compuesto natural). La historia moderna de los antibiticos comienza con el
descubrimiento de sustancias presentes en unos microorganismos capaces de matar a otros
microorganismos. La utilizacin de antibiticos supuso un avance enorme en la esperanza de
vida de las personas que padecan procesos infecciosos, aunque tambin supuso un aumento
en los niveles de resistencia antibitica.
El antibiograma tiene cuatro utilidades principales:
La utilidad bsica del antibiograma es la instauracin de un tratamiento antibitico correcto al
paciente. Es necesario conocer si el microorganismo responsable de la infeccin posee
mecanismos que le confieran inmunidad frente a algn antibitico para no incluirlo como
terapia.
En cuanto al tratamiento el antibiograma no slo es necesario en la instauracin, tambin
resulta til en el seguimiento e incluso en la confirmacin de tratamientos empricos. En
ocasiones la enfermedad infecciosa resulta grave y se comienza el tratamiento antes de
conocer los datos de sensibilidad de la cepa. El antibiograma tiene que confirmar, o en su
caso corregir el tratamiento.
Otra aplicacin de las tcnicas de estudio de resistencia es la epidemiologa. Es necesario
detectar el aumento de los niveles de resistencia en los aislamientos clnicos para tomar
medidas correctoras.
Por otro lado tambin puede tener utilidad diagnstica porque el perfil de resistencia puede en
algn caso orientar en la identificacin bacteriana.
Existen multitud de antimicrobianos en el mercado y el nmero sigue creciendo porque el
desarrollo de ms mecanismos de resistencia por parte de los microorganismos se traduce en
un esfuerzo mayor por fabricar ms y mejores antibiticos. No es necesario contrastar la
eficacia de todos los antibiticos para cada aislamiento bacteriano. Los criterios que se siguen
para seleccionar que antimicrobianos se ensayan respondes a factores de diversa ndole:
Factores microbiolgicos: Tipo de agente infeccioso y mecanismos de resistencia descritos
previamente en su especie.
Factores farmacolgicos: Tipo de antimicrobiano y parmetros de absorcin, distribucin y
eliminacin.
Factores del paciente: Tipo de infeccin. Factores de riesgo y estado general de salud.
Situacin inmunolgica e hipersensibilidad.
Experiencia anterior referente a los patrones de resistencia antibitica mas habituales para
cada especie.
Los antibiticos
Un antibitico ha sido definido como una sustancia qumica producida por un
microorganismo capaz de inhibir el desarrollo de otros microorganismos. Los
antibiticos modificados por manipulaciones qumicas aun se consideran como tales.
Un agente antimicrobiano es activo contra los microorganismos y puede ser producido
en forma natural por microorganismos o sintticamente en el laboratorio. El trmino
agente quimioterpico ha sido empleado para referirse a agentes antimicrobianos
sintticos o no y tambin se refiere a agentes que actan contra clulas humanas
como inmunomoduladores y drogas antitumorales. Los trminos agente antiviral y
agente antimictico son trminos ms especificos, incluidos dentro de la categora ms
general de agentes antimicrobianos.
El aislamiento de un agente infeccioso a partir de un paciente no es con frecuencia
suficiente para establecer la terapia adecuada. Muchas bacterias y algunos hongos
presentan resistencia a los agentes antimicrobianos y algunos virus han desarrollado
resistencia a los agentes antivirales ms actuales. Los patrones de resistencia cambian
en forma constante y no importa lo rpidamente que se introduzcan los nuevos
agentes teraputicos porque los microbios parecen siempre dispuestos a superarlos.
Incluso entre los neumococos, que por dcadas han permanecido invariablemente
susceptibles a niveles de penicilina G menores de 0.04 U/ml , han aparecido cepas que
han desarrollado resistencia a esta droga.
Ya que no se puede predecir la susceptibilidad de las bacterias, hongos y virus a los
agentes antimicrobianos, con frecuencia es necesario estudiar la sensibilidad individual
de cada patgeno a estas drogas, pudindose elegir entonces el agente apropiado (el
ms activo contra el patgeno, el menos txico para el husped, con las caractersticas
farmacolgicas apropiadas y el ms econmico), que proporciona mayores
posibilidades de una evolucin favorable.
Por supuesto, el resultado teraputico final depende de muchas otras variables. La
enfermedad subyacente y condicin clnica del husped, las propiedades
farmacolgicas del agente antimicrobiano, la administracin de otros agentes
teraputicos adicionales y otros factores ejercern una fuerte influencia sobre el
desenlace final. Los microbilogos slo pueden recomendar agentes teraputicos sobre
la base de sus actividades in vitro. El clnico debe tomar la decisin final, teniendo en
cuenta su conocimiento sobre todos los factores pertinentes.
Un concepto importante sobre el que es necesario insistir es que no se pueden realizar
pruebas de sensibilidad in vitro con cultivos mixtos, slo los cultivos puros
proporcionarn resultados vlidos sobre la eficacia de un antibitico.
En la prctica diaria, una buena parte de los tratamientos efectuados tanto a nivel
hospitalario como ambulatorio, se establecen con arreglo a unos criterios derivados del
estudio in vitro del comportamiento de las distintas especies bacterianas frente a un
determinado grupo de antibiticos (tratamiento emprico). Ello se debe a que en
muchas ocasiones, no puede disponerse de la bacteria aislada del proceso infeccioso y
la eleccin teraputica, en esos casos, responde a criterios de empirismo derivados
precisamente del conocimiento del comportamiento de distintos tipos de antibiticos
frente a las bacterias presuntamente responsables de la infeccin.
Por otra parte, cada vez se hace ms necesario contar con un diseo de un programa
de vigilancia de la resistencia a los antimicrobianos, a nivel general, basado
precisamente en el conocimiento que tanto a nivel hospitalario como ambulatorio se
tiene del comportamiento de los distintos aislamientos de bacterias frente a los
antimicrobianos para poder disear las actuaciones que tiendan a superar la
resistencia de las mismas a los antibiticos.
Se hace necesario tambin contar no solamente con criterios de tipo cuantitativo o
cualitativo (sensible, intermedio, resistente), sino que adems los resultados han de
interpretarse adecuadamente para evitar llegar a conclusiones errneas que pueden
derivarse de atender exclusivamente al dato que el sistema de realizacin del
antibiograma nos ofrece ya que existen muchas formas de interrelacin bacteria-
antibitico que deben conocerse para llegar a ese objetivo final que es la eleccin de la
terapia ms adecuada.
En lneas generales y en funcin sobre su forma de actuar sobre los microorganismos,
hablamos de dos grandes grupos de antibiticos
Antibiticos primariamente bactericidas: Ejercen una accin letal e
irreversible sobre el microbio (Fosfomicina Vancomicina. B-Lactmicos
Polimixina. Aminoglucsidos Rifampicina. Acido Nalidxico Quinoleinas.
Nitrofurantoinas)
Antibiticos primariamente bacteriostticos: Inhiben el crecimiento
pero no matan al microorganismo, permitiendo que las propias defensas
del husped pueden eliminar a las bacterias (Tetraciclina Cloranfenicol.
Sulfonamidas Trimetroprim. Lincomicina Clindamicina. Macrlidos)
El antibiograma
Por qu realizar un antibiograma?
El primer objetivo del antibiograma es el de medir la sensibilidad de una cepa
bacteriana que se sospecha es la responsable de una infeccin a uno o varios
antibiticos. En efecto, la sensibilidad in vitro es uno de los requisitos previos para la
eficacia in vivo de un tratamiento antibitico. El antibiograma sirve, en primer lugar,
para orientar las decisiones teraputicas individuales.
El segundo objetivo del antibiograma es el de seguir la evolucin de las resistencias
bacterianas. Gracias a este seguimiento epidemiolgico, a escala de un servicio, un
centro de atencin mdica, una regin o un pas, es como puede adaptarse la
antibioterapia emprica, revisarse regularmente los espectros clnicos de los
antibiticos y adoptarse ciertas decisiones sanitarias, como el establecimiento de
programas de prevencin en los hospitales.
Hay pues un doble inters: Teraputico y epidemiolgico.
Cundo realizar un antibiograma?
Siempre que una toma bacteriolgica de finalidad dagnstica haya permitido el
aislamiento de una bacteria considerada responsable de la infeccin.
Establecer esta responsabilidad exige una colaboracin entre el bacterilogo y el
clnico. En efecto, en ciertas circunstancias, el microbilogo no podr determinar con
certeza que el aislamiento de una bacteria exige un antibiograma, sin los datos clnicos
que le aporta el mdico. Por ejemplo, una bacteria no patgena puede ser responsable
de la infeccin de un enfermo inmunodeprimido o en un lugar determinado del
organismo. La presencia de signos clnicos puede ser tambin determinante para la
realizacin de un antibiograma (por ejemplo: la infeccin urinaria con un nmero
reducido de grmenes).
Sensibilidad bacteriana a los antibiticos
La determinacin de la Concentracin Inhibidora Mnima (CIM) es la base de la medida
de la sensiblidad de una bacteria a un determinado antibitico. La CIM se define como
la menor concentracin de una gama de diluciones de antibitico que provoca una
inhibicin de cualquier crecimiento bacteriano visible. Es el valor fundamental de
referencia que permite establecer una escala de actividad del antibitico frente a
diferentes especies bacterianas.
Hay diferentes tcnicas de laboratorio que permiten medir o calcular de rutina, y de
manera semicuantitativa, las CIM (mtodos manuales y mtodos automatizados o
semiautomatizados). Estos diferentes mtodos de rutina permiten categorizar una
cierta cepa bacteriana en funcin de su sensibilidad frente al antibitico probado. Esta
cepa se denomina Sensible (S), Intermedia (I) o Resistente (R) al antibitco.
Para un determinado antibitico, una cepa bacteriana es, segn la NCCLS:
Sensible, si existe una buena probabilidad de xito teraputico en el
caso de un tratamiento a la doss habitual.
Resistente, si la probabilidad de xito teraputico es nula o muy
reducida. No es de esperar ningn efecto teraputico sea cual fuere el
tipo de tratamiento.
Intermedia, cuando el xito teraputico es imprevisible. Se puede
conseguir efecto teraputico en ciertas condiciones (fuertes
concentraciones locales o aumento de la posologa).
Ciertas molculas son representativas de un grupo de antibiticos. Los resultados (S, I,
R) obtenidos con estas molculas pueden ser ampliados a los antibiticos del grupo,
que en ese caso no es necesario ensayar (Ejemplo: Equivalencia entre la cefalotina que
se ensaya y las restantes cefalosporinas de 1 generacin que no es necesario probar,
ya que el resultado puede deducirse del obtenido en la cefalotina).
Este hecho permite ensayar un nmero reducido de antibiticos, sin limitar por ello las
posibilidades teraputicas.
Interpretacin de un Antibiograma
Certos mecanismos de resistencia se expresan dbilmente in vitro, cuando se
inscriben en el DNA bacteriano. Su expresin en el organsmo, en donde las
condicones en cuanto a medios son diferentes, expondra al riesgo de fracaso
teraputico. Para evitar esto, el antibiograma debe ser interpretado de manera global a
fin de descubrir, a travs de la comparacin de las respuestas para cada antibitico, un
mecanismo de resistencia incluso dbilmente expresado. As, gracias a la
interpretacin, una cepa que aparece como falsamente sensible ser categorizada
como I o R (Ejemplo: Una cepa de Klebsiella pneumoniae productora de BLSE puede
aparecer sensible in vitro a las cefalospornas de 3" generacin. El resultado de
Sensible debe ser corregido a Intermedio o Resistente, ya que la utilizacin de estos
antibiticos correra el riesgo de provocar un fracaso teraputico).
Resistencia bacteriana
Cada antibitico se caracteriza por un espectro natural de actividad antibacteriana.
Este espectro comprende las especies bacterianas que, en su estado natural, sufren
una inhibicin de su crecimiento por concentraciones de su antibitico susceptibles de
ser alcanzadas in vivo. A estas especies bacterianas se les dice naturalmente sensibles
a dicho antibitico. Las especies bacterianas que no se encuentran incluidas dentro de
dicho espectro se denominan naturalmente resistentes.
El antibitico no crea resistencia, pero selecciona las bacterias resistentes eliminando
las sensibles. Es lo que se conoce con el nombre de presin de seleccin. El aumento
de la frecuencia de las cepas resistentes va unido cas siempre al uso intensivo del
antibitico en cuestin.
La resistencia natural es un carcter constante de todas las cepas de una misma
especie bacteriana. El conocimiento de las resistencias naturales permite prever la
inactivdad de la molcula frente a bacterias identificadas (despus del crecimiento) o
sospechosas (en caso de antiboterapia emprica). En ocasiones, constituye una ayuda
para la identificacin, puesto que certas especies se caracterizan por sus resistencias
naturales. Ejemplos: Resistencia natural del Proteus mirabilis a las tetraciclinas y a la
colistina. Resistencia natural de la Klebsiella pneumoniae a las penicilinas (ampicilina,
amoxicilina).
La resistencia adqurida es una caracterstica propia de ciertas cepas, dentro de
una especie bacteriana naturalmente sensible, cuyo patrimonio gentico ha sido
modificado por mutacin o adquisicin de genes. Contrariamente a las resistencias
naturales, las resistencias adquiridas son evolutivas, y su frecuencia depende a
menudo de la utilizacin de los antibiticos. En el caso de numerosas especies
bacterianas, y teniendo en cuenta la evolucin de las resistencias adquiridas, el
espectro natural de actividad no es ya suficente para guiar la eleccin de un
tratamiento antibitico. En ese caso, se hace indispensable el antibiograma.
Una resistencia cruzada es cuando se debe a un mismo mecanismo de resistencia.
En general, afecta a varios antibiticos dentro de una misma familia (Ejemplo: La
resistencia a la oxacilina en los estafilococos se cruza con todas los -lactmicos). En
ciertos casos, puede afectar a antibiticos de familias diferentes (Ejemplo: La
resistencia por impermeabilidad a las ciclinas se cruza con la resistencia al
coloranfenicol y al trimetoprima).
Un resistencia asociada es cuando afecta a varios antibiticos de familias
dferentes. En general, se debe a la. asociacin de varios mecanismos de resistencia
(Ejemplo: La resistencia de los estafiolococos a la oxacilina va frecuentemente
asociada a las quinolonas, aminoglicsidos, macrolidos y ciclinas).
Con el fin de tener en cuenta la evolucin de las resistencias adquiridas y, por
consiguiente, proporcionar a los mdicos datos tiles cuando deben proceder a la
eleccin emprica de una antibioterapia, la nocin de espectro clnico completa la de
espectro natural. Definido para cada antibitico, este espectro clnico se incluye en el
Resumen de las Caractersticas del Producto (RCP). Este espectro integra no solamente
datos bacteriolgicos (espectro natural, frecuenca de las resistencias adquiridas), sino
tambin datos farmacocinticos y clnicos (las especies descritras en el espectro son
aquellas para las que se ha demostrado la actividad clnica del producto). El espectro
clnico se revisa regularmente para tener en cuenta la evolucin de las resistencias
adquiridas.
Evolucin, en general, de algunas
resistencias bacterianas
Evolucin, en hospital, de algunas
resistencias bacterianas
Mecanismos de la resistencia adquirida
El mecanismo gentico de adquisicin de una resistencia puede ser:
- La mutacin de un gen implicado en el modo de accin de un antibitico: Este
mecanismo afecta preferentemente a ciertos antibiticos: quinolonas, rifampicina,
cido fusdico, fosfomicina, antituberculosos y a veces cefalosporinas (Ejemplo: La
resistencia a las quinolonas por modificacin del ADN grasa en las enterobacterias).
- La adquisicin de genes de resistencia transferidos a partir de una cepa perteneciente
a una especie idntica o diferente: Ciertos Antibiticos estn particularmente afectados
por este mecanismo: -lactmicos, aminoglicsidos, tetraciclinas; cloranfenicol,
sulfamidas (Ejemplo: Resistencia a la ampicilina E. coli y del Proteus mirabilis).
El mecanismo bioqumico de la resistencia puede ser:
- una produccin por la bacteria de enzimas que inactivan el antibitico. Ejemplo:
Penicilinasa de los estafilococos, lactamasa de amplio espectro (BLAE) de las
enterobacterias.
- una modificacin del blanco del antibitico. Ejemplo: Modificacin de las Protenas de
Enlace con la Penicilina (PBP) de los estafilicocos resistentes a la oxacilina (llamados
estafilococos "Meti-R"). Neumococos resistentes a la penicilina.
- una impermeabilidad de la pared bacteriana por modificacin o por disminucion
cuantitativa de las porinas. Ejemplo: Pseudomonas aeruginosa resistente a la
imipenem.
- un mecanismo de efusin: expulsin de la molcula por un transporte activo.
Ejemplo: Estafilococos resistentes a las tetraciclinas.
Pruebas de sensibilidad bacteriana in vitro
En la poca posterior al descubrimiento de las sulfonamidas y de la penicilina rara vez
se probaba la sensibilidad de los microorganismos a las drogas. Los pacientes eran
tratados en forma emprica y los microorganismos generalmente eran sensibles. Slo
tras el surgimiento de las cepas resistentes, poco despus de la introduccin de estos
agentes, los microbilogos comenzaron a probar la sensibilidad de un microorganismo
infectante frente a los agentes antimicrobianos.
En un primer momento, el mtodo estndar utilizado para las pruebas in vitro fue el de
dilucin en caldo, que proporcionaba un resultado cuantitativo de la concentracin de
agente antimicrobiano necesaria para inhibir el desarrollo de un organismo dado.
Mtodo base de dilucin en caldo
En los mtodos de dilucin en caldo,
base de casi todos los mtodos
utilizados en la actualidad, se colocan
concentraciones decrecientes del agente
antimicrobiano, generalmente diluciones
1:2, en tubos con un caldo de cultivo
que sostendr el desarrollo del
microorganismo. El caldo ms
comnmente usado para estas pruebas
es el de Mueller-Hinton suplementado con los cationes magnesio y calcio.
Los agentes antimicrobianos se preparan en "soluciones madre" concentradas y luego
se diluyen en caldo hasta obtener las concentraciones apropiadas.
Un tubo de caldo se mantiene sin inocular como control negativo de crecimiento. Luego
de la incubacin adecuada (usualmente de un da para el otro) se observa la turbidez
de los tubos que indicar desarrollo bacteriano. El microorganismo crecer en el tubo
control y en todos los otros que no contengan suficiente agente antimicrobiano como
para inhibir su desarrollo. La concentracin de antibitico que presente ausencia de
crecimiento, detectada por falta de turbidez (igualando al control negativo), se designa
como la Concentracin Mnima Inhibitoria (CMI) (ver esquema ampliado).
Para medir la capacidad de un antimicrobiano para matar a un microorganismo (CMB)
se debe realizar la prueba de actividad bactericida, que emplea el mismo sistema de
dilucin en caldo que para medir la sensibilidad.
Al mismo tiempo que la suspensin inicial del microorganismo es inoculada en los
tubos de caldo, se toma una alcuota del tubo de control de crecimiento,
inmediatamente despus de ser sembrado, y se inocula tambin en una placa de agar
para determinar el nmero real de unidades formadoras de colonias (UFC) del inculo.
Este nmero se obtiene al contar las colonias presentes luego de la incubacin de la
placa de agar hasta el da siguiente y por multiplicacin por el factor de dilucin. Por
ejemplo, usando un asa calibrada de 0,01 ml para sembrar la placa y contando unas
250 colonias, en 1 ml del tubo original habr 250/0,01.
Una vez determinada la CMI, se siembra una cantidad conocida de inculo de cada uno
de los tubos de caldo que no presentaban turbidez en placas de agar (la pequea
cantidad del agente antimicrobiano que es llevada junto con el inculo se elimina por
dilucin en el agar), y el nmero de colonias que crece en estos subcultivos, despus
de incubar durante la noche, se compara con el nmero de UFC/ml del cultivo original.
Dado que incluso las drogas bactericidas no siempre esterilizan totalmente una
poblacin bacteriana, la mnima concentracin del agente antibacteriano que permite
sobrevivir a menos de 0,1 % del inculo original se denomina concentracin
bactericida mnima (CBM) o concentracin letal mnima (CLM).
Las CMI y las CMB de un agente antimicrobiano pueden ser determinadas, con este
mtodo o con alguna variante, para cualquier bacteria que crezca en un medio liquido.
Pero segn se pudo disponer de mayor nmero de agentes antimicrobianos para el
tratamiento de una gran variedad de bacterias, se hicieron aparentes las limitaciones
del macromtodo de dilucin en caldo y se desarrollaron variantes de esta tcnica que
permitieran, por ejemplo, probar simultneamente un gerrnen aislado de un paciente
frente a ms de un agente antimicrobiano.
Actualmente son varios los mtodos que se utilizan para llevar a cabo los estudios de
sensibilidad a los antibiticos y todos ellos se realizan en los laboratorios de
microbiologa bajo condiciones entandarizadas por organismos internacionales. Entre
todos, tres son los que, por su sencillez y fiabilidad, se han impuesto como sistemtica
de rutinaria en la mayora de los laboratorios:
Pruebas de sensibilidad bacteriana in vitro
Mtodo de difusin en agar
Una vez demostradas las grandes ventajas de las tcnicas de dilucin en caldo, el paso
siguiente, pensando sobre todo en poder realizar fcilmente pruebas de sensibilidad de
un microorganismo frente a mltiples antibiticos a la vez, consisti en buscar la
manera de aplicar la idea directamente a las placas de agar.
Las primeras pruebas se realizaron inoculando la superficie de una placa de agar con el
microorganismo en estudio, colocando pequeas cubetas (de metal o vidrio) sobre el
agar y agregando las soluciones de los diferentes antimicrobianos dentro de dichas
cubetas. Los agentes antimicrobianos difundan en el medio en forma radial alrededor
de la cubeta e inhiban el desarrollo del microorganismo en la zona donde su
concentracin era suficientemente alta. Las reas de inhibicin grandes indicaban una
actividad antimicrobiana ms efectiva.
Este mtodo fue modifcado en 1947 por Bondi y col. incorporando el agente
antimicrobiano a discos de papel de filtro. Fue un paso adelante gigantesco ya que el
uso de los discos de papel permita preparar un gran nmero de pruebas idnticas y
almacenarlas para uso futuro.
En 1966, despus de los estudios realizados por Bauer, Kirby, Sherris y Turk,
ensayando diferentes cepas bacterianas, el empleo de los discos de papel de filtro para
las pruebas de sensibilidad fue estandarizado y correlacionado definitivamente con las
CMI correspondientes.
Durante muchos aos, y a pesar de ser una tcnica puramente cualitativa, el mtodo
de difusin por disco (o mtodo Kirby-Bauer), en funcin sobre todo de su comodidad,
economa y fiabilidad, ha sido, y aun es, uno de los ms utilizados en los laboratorios
de todo el mundo.
El microorganismo a investigar se inocula en una o varias placas de agar y sobre su
superficie se disponen los discos correspondientes a varios antibiticos. Se incuban las
placas durante 16-24 horas a 35C y al cabo de este tiempo se estudia el crecimiento
en ellas. Se valora el dimetro de la zona de inhibicin que se forma alrededor de cada
disco y se compara con las referencias oportunas publicadas por el NCCLS. Con esta
referencia podemos informar si el microorganismo es Sensible, Intermedio o Resistente
(S, I, R) a cada uno de los antibiticos ensayados en las placas.
Antibiograma realizado por el mtodo de difusin en agar
En esta fotografa se muestra un ejemplo de antibiograma realizado por el mtodo de
difusin en agar por medio de discos.
En la imagen de la izquierda se muestra una vista general de una placa con
crecimiento bacteriano y con seis discos de antibiticos. La zona de color claro que
ocupa la mayor parte de la placa es el crecimiento bacteriano en las zonas no
inhibidas. Los crculos negros que rodean a cinco de los seis discos marcan las zonas
en que los respectivos antibiticos han inhibido, con mayor o menor eficacia, el
crecimiento del microorganismo a estudio. El sexto disco (AM-10) no tiene a su
alrededor halo de inhibicin lo que indica la resistencia del microorganismo a ese
antibitico.
La foto de la derecha, un plano ms cercano de la mitad superior de la placa, permite
observar con ms detalle lo sealado en el prrafo anterior. Puede verse adems, con
gran claridad, la especial disminucin de la intensidad de crecimiento del
microorganismo en la zona interior del halo de inhibicin del disco de CTX-30, debido
probablemente a la aparicin de mutantes resistentes de dicho microorganismo
capaces de soportar en mayor medida que el resto el efecto inhibitorio del antibitico.
Pruebas de sensibilidad bacteriana in vitro
Mtodo de E-test
Es uno de los mtodos ms recientes que se han presentado en el mercado y resulta
de una curiosa combinacin de caractersticas de los mtodos anteriores. Se trata de
una tcnica cuantitativa en placa que permite obtener una lectura directa de CMI en
g/ml, ya que se emplean tiras plsticas impregnadas en concentraciones crecientes
de antibitico indicadas en una escala graduada sobre la propia tira.
Una de sus grandes ventajas, dadas sus caractersticas, es que resulta un mtodo ideal
para estudiar cualquier tipo de microorganismo, aerobio o anaerobio, incluyendo
aquellos llamados "fastidiosos" o los que tengan requerimientos especiales para crecer.
El microorganismo a investigar se inocula en una placa y sobre ella se deposita la tira
del antibitico (o antibiticos) a ensayar. Tras la incubacin de 16-24 horas a 35C se
observan las placas y se valora la zona de inhibicin, de forma elptica, alrededor de
cada tira. La CMI se lee directamente observando el punto ms bajo de la elipse que
presente crecimiento.
Antibiograma realizado por el mtodo de E-test
En esta fotografa se muestra un ejemplo de antibiograma realizado por el mtodo de
E-test.
En la fotografa de la izquierda se muestra una vista general de una placa con
crecimiento bacteriano y con dos tiras de E-test. La zona de color ms claro que ocupa
la mayor parte de la placa es el crecimiento bacteriano en las zonas no inhibidas. Las
elipses ms oscuras que rodean la parte superior de las tiras E-test marcan las zonas
en que los respectivos antibiticos han inhibido, con mayor o menor eficacia, el
crecimiento del microorganismo a estudio.
La foto de la derecha, un plano ms cercano de la mitad inferior de la placa, permite
observar con ms detalle lo sealado en el prrafo anterior. Se aprecia perfectamente
como el pico de la zona ms estrecha de la elipse en la tira de MZ coincide, en la
escala graduada, con la franja entre las marcas de 1.5 y 2, lo que nos indicara que la
CMI de este antibitico (MZ) para este microorganismo sera de 2 g/ml.
fotografa: Dani Val
Pruebas de sensibilidad bacteriana in vitro
Mtodos automatizados
La mayora de estos novedosos mtodos utilizan sistemas de microdilucin en medio
lquido sobre microplacas con pocillos en "U" e interpretan el crecimiento bacteriano en
los diferentes pocillos por medio de un autoanalizador (mediciones por turbidez o
fluorescencia) o, en el caso de los sistemas ms sencillos, por simple lectura ptica del
tcnico a travs de un visor invertido de espejo.
Su manipulacin suele ser fcil y rpida, generalmente automatizada o
semiautomatizada, lo que los convierte en mtodos ideales para grandes volmenes de
trabajo. Una de sus grandes limitaciones es que slo ofrecen garanta para investigar
microorganismos de crecimiento rpido y que no tengan requerimientos especiales.
Antibiograma realizado por mtodo automtico
En esta fotografa se muestra un ejemplo de antibiograma realizado por un mtodo
automatizado.
En la imagen de la izquierda se muestra una vista general de una microplaca para
autoanalizador que incluye fase de identificacin y fase de antibiograma (panel
microScan). Las tres filas superiores de la microplaca son la zona de "identificacin"
del microorganismo, las cinco filas inferiores son el apartado "antibiograma".
La foto de la derecha, un plano ms cercano de la mitad inferior izquierda de la
microplaca, permite observar con ms detalle algunas filas de pocillos con diluciones
seriadas de algunos antibiticos. La dosificacin de cada antibitico aumenta, en cada
fila, de izquierda a derecha (obsrvese los rtulos bajo cada pocillo: 8-16 ... 1-2-8-16
... 2-8-32). Los pocillos que en la imagen muestran un color verde intenso tienen
crecimiento bacteriano, o sea, el antibitico en cuestin no impide el desarrollo del
microorganismo a estudio. Los pocillos transparentes marcaran los puntos de
inhibicin de cada antibitico.
fotografa: Dani Val
También podría gustarte
- Unidad 3. Actividad 2. Práctica de Laboratorio Configurar El Switch Cisco 2960Documento14 páginasUnidad 3. Actividad 2. Práctica de Laboratorio Configurar El Switch Cisco 2960J Manuel BuenoAún no hay calificaciones
- El Miedo A La Muerte en Los NiñosDocumento6 páginasEl Miedo A La Muerte en Los NiñosangelaAún no hay calificaciones
- Biomaterial EsDocumento6 páginasBiomaterial EsGraci sahori jaen BanchonAún no hay calificaciones
- LEO PRIMERO DOCENTE Lenguaje Tomo 1 PDFDocumento427 páginasLEO PRIMERO DOCENTE Lenguaje Tomo 1 PDFcatalinaAún no hay calificaciones
- Voz y El Cuerpo Instrumentos Expresivos y Comunicacionales, Lenguaje Básico TeatralDocumento4 páginasVoz y El Cuerpo Instrumentos Expresivos y Comunicacionales, Lenguaje Básico TeatralJohanyely100% (1)
- HelveticaDocumento1 páginaHelveticaYiz UnicaucaAún no hay calificaciones
- Botiquin Veterinario VinchosDocumento10 páginasBotiquin Veterinario VinchosRenan Martinez PerezAún no hay calificaciones
- Depurador y SeparadorDocumento2 páginasDepurador y SeparadorJessica Alejandra TGAún no hay calificaciones
- Trabajo Práctico de ElectroestáticaDocumento1 páginaTrabajo Práctico de ElectroestáticaHernan Adolfo Coro floresAún no hay calificaciones
- Presentac Planificac Control Gestión 31-10-22Documento16 páginasPresentac Planificac Control Gestión 31-10-22Arantxita OlivesAún no hay calificaciones
- Materialismo CartesianoDocumento4 páginasMaterialismo CartesianoTalento Libre DE PsicologiaAún no hay calificaciones
- Tarea 4. Documento de ApoyoDocumento7 páginasTarea 4. Documento de ApoyoIvan BriseñoAún no hay calificaciones
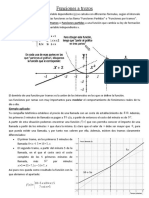
- Apunte Funciones Por TramosDocumento4 páginasApunte Funciones Por TramosBERYLL ZICARELLIAún no hay calificaciones
- CALENDARIO OCTUBRE MATEMÁTICAS 3oDocumento1 páginaCALENDARIO OCTUBRE MATEMÁTICAS 3oProfa. Carmen OlveraAún no hay calificaciones
- Claibracion Del Actuador Optico Compresor deDocumento2 páginasClaibracion Del Actuador Optico Compresor dejose paezAún no hay calificaciones
- Informe Final - MarketingDocumento28 páginasInforme Final - Marketingbruno rodriguezAún no hay calificaciones
- Clasificaciones Con WekaDocumento15 páginasClasificaciones Con WekaveraluzmgAún no hay calificaciones
- Manual de Procesos y ProcedimientoDocumento2 páginasManual de Procesos y ProcedimientoEhuvany MartinezAún no hay calificaciones
- Examen Parcial 1Documento5 páginasExamen Parcial 1Luisa Fernanda Mejía JaramilloAún no hay calificaciones
- Las Partes de Una ComputadoraDocumento10 páginasLas Partes de Una ComputadorafernandosoresAún no hay calificaciones
- Lorca MesinaDocumento147 páginasLorca Mesinamgarcia_244635Aún no hay calificaciones
- Diagnostico de PIP Mejoramiento de Pistas y VeredasDocumento11 páginasDiagnostico de PIP Mejoramiento de Pistas y VeredasJosseph R Aller AyalaAún no hay calificaciones
- Vision de EternidadDocumento2 páginasVision de EternidadJesus María Pastoral Argentina Uruguay Jesus MariaAún no hay calificaciones
- Rae BF ObesidadDocumento19 páginasRae BF Obesidadlaura rodriguezAún no hay calificaciones
- Catalogo POSDocumento7 páginasCatalogo POSFrancisco CatalánAún no hay calificaciones
- Fase 1 - Modelar El Sistema Dinámico en El Dominio Del Tiempo - Omar GomezDocumento6 páginasFase 1 - Modelar El Sistema Dinámico en El Dominio Del Tiempo - Omar GomezOmar Gomez100% (1)
- El Poeta y Su Trabajo, 35 PDFDocumento93 páginasEl Poeta y Su Trabajo, 35 PDFCaimito de Guayabal100% (1)
- Tecnicas de NegociacionDocumento1 páginaTecnicas de NegociacionAlejandro Garcìa0% (1)
- Cristo No Pudo Haber Nacido El 25 de DiciembreDocumento33 páginasCristo No Pudo Haber Nacido El 25 de DiciembreDavid MendozaAún no hay calificaciones
- PINTURAS FAMOSAS - Valentina TovarDocumento4 páginasPINTURAS FAMOSAS - Valentina TovaracfiestaAún no hay calificaciones