Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cinetica de La Alogenación de La Acetona
Cargado por
Cuauhtémoc M RdzDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cinetica de La Alogenación de La Acetona
Cargado por
Cuauhtémoc M RdzCopyright:
Formatos disponibles
INSTITUTO POLITCNICO NACIONAL
UNIDAD PROFESIONAL INTERDISCIPLINARIA DE BIOTECNOLOGA
INGENIERA FARMACUTICA
___________________________________________________________________________________
LABORATORIO DE FISICOQUMICA
Prctica No. XI
Cintica de la halogenacin de la acetona.
Integrantes:
Montes Ortega Luis ngel.
Ramrez Chvez Rosalba.
Ruz Hernndez Gustavo.
Grupo:
3FM5
EQUIPO 2
Profesor:
Emma Bolaos Valerio.
Alfonso Xotlanihua Flores.
Fecha de entrega:
27 de noviembre de 2013.
PRCTICA XI.
CINTICA DE LA HALOGENACIN DE LA ACETONA.
OBJETIVOS.
Determinar el orden de reaccin para la cintica de halogenacin de la acetona.
Determinar el efecto de la concentracin de cido y de acetona sobre la cintica de
halogenacin de la acetona.
Determinar la constante de velocidad para la reaccin de halogenacin de la acetona.
INTRODUCCIN.
En los estudios de cintica qumica es importante determinar la expresin de velocidad que dar la
concentracin de uno o ms de los reactivos o productos como una funcin del tiempo y obtener la
constante de velocidad k. En ella se intenta seguir su curso por medio del cambio de alguna propiedad
fsica como puede ser presin, absorbancia, conductividad, ndice de refraccin, ngulo de rotacin de
la luz polarizada, pH, etc.
La cintica qumica, como ya se seal antes, estudia el cambio de una concentracin de reactivos o de
productos con el transcurrir del tiempo. Tal cambio se puede expresar mediante una ecuacin
diferencial donde aparece la velocidad de la reaccin qumica. Dicha velocidad se define como la tasa
de cambio de la concentracin de una especie con el tiempo.
[]
[]
Las reacciones qumicas se denominan homogneas, cuando ocurren en una sola fase, y
heterogneas, cuando ocurren entre especies que se encuentran en diferentes fases. Las reacciones
homogneas en disolucin acuosa, como por ejemplo:
aA + bBcC + dD
No ocurren, habitualmente, en un solo paso, sino en varios, como ocurre, prcticamente, en todas las
reacciones que incluyen ms de dos molculas reactantes.
El conjunto de todos los pasos elementales se conoce como el mecanismo de reaccin. Uno de los
objetivos principales de la cintica qumica es obtener informacin para ayudar al esclarecimiento de
los mecanismos de reaccin, que son fundamentales para la comprensin de los procesos qumicos.
Experimentalmente, se encuentra que la velocidad de reaccin es proporcional a la concentracin de
los reactivos elevada a unos exponentes, que suelen ser nmeros enteros sencillos. Esto nos lleva a
una expresin de la velocidad del tipo:
[]
Donde:
: constante de velocidad.
Exponentes , y : rdenes parciales con respecto a cada reactivo.
La suma de ellos es el orden total de la reaccin. Estos valores pueden determinarse
experimentalmente, al igual que el valor de .
El orden de la reaccin aparente con respecto a la especie que interesa se puede obtener por una
variedad de mtodos que miden concentraciones a diferentes tiempos.
[]
(A)
La ecuacin (A) se puede integrar fcilmente para diferentes valores de p, y, mediante una
representacin grfica apropiada, puede obtener se el valor de p que mejor reproduce los datos
experimentales. Una vez determinado el valor de p puede calcularse el valor de la constante .
RESULTADOS.
1. Preparacin de la curva tipo.
Tabla 1. Disoluciones para la curva tipo.
Tubo
Solucin de
yodo (mL)
Solucin de HCl
(mL)
Agua
destilada
(mL)
Concentracin molar de
yodo (mmol/L)
A
460
1 0 1 9 0 0
2 0.5 1 8.5 0.25 0.224
3 1 1 8 0.5 0.58
4 1.5 1 7.5 0.75 0.816
5 2 1 7 1 0.958
2. Determinacin de la cintica de reaccin.
Tabla 2. Concentraciones iniciales de las 3 sustancias.
Tubo Acetona
(mL)
Solucin
de cido
(mL)
Solucin
de yodo
(mL)
Agua
destilada
(mL)
Concentracin
acetona [M]
Concentracin
cido [M]
Concentracin
yodo [M]
1 1.00 0.10 2.00 6.90
1.3619146 0.023282501
0.001
2 1.00 0.20 2.00 6.80 1.3619146 0.046565003 0.001
3 1.00 0.50 2.00 6.50 1.3619146 0.116412507 0.001
4 1.00 1.00 2.00 6.00 1.3619146 0.232825014 0.001
5 0.12 1.00 2.00 6.88 0.16342975 0.232825014 0.001
6 0.25 1.00 2.00 6.75 0.34047865 0.232825014 0.001
7 0.50 1.00 2.00 6.50 0.6809573 0.232825014 0.001
8 0.25 1.00 1.00 7.75 0.34047865 0.232825014 0.0005
3. Interpolar los valores de absorbancia en la curva tipo y determinar la concentracin de yodo
para cada tiempo.
Tabla 3 Abosrbancia a 460 nm de cada una de las disoluciones
Tiempo (s) Tubo 1 Tubo 2 Tubo 3 Tubo 4 Tubo 5 Tubo 6 Tubo 7 Tubo 8
15 0.922 1.069 0.822 0.865 0.923 0.89 0.971 0.452
30 0.913 1.032 0.737 0.746 910 0.864 0.931 429
45 0.904 1.031 0.652 0.621 0.897 0.841 0.88 0.407
60 0.896 1.009 0.567 0.493 0.884 0.817 0.849 0.384
75 0.888 0.988 0.492 0.367 0.871 0.793 0.81 0.362
90 0.88 0.965 0.401 0.242 0.858 0.769 0.758 0.339
105 0.871 0.942 0.318 0.123 0.845 0.745 0.714 0.326
120 0.863 0.917 0.237
0.831 0.72 0.669 0.294
135 0.855 0.899 0.157
0.818 0.696 0.662 0.271
150 0.847 0.869
0.805 0.671 0.573 0.248
165 0.89 0.845
0.792 0.647 0.521 0.225
180 0.832 0.82
0.779 0.623 0.471 0.202
195 0.823 0.797
0.766 0.599 0.42 0.179
210 0.815 0.699
0.753 0.576 0.377 0.156
225 0.806 0.673
0.74 0.553 0.331 0.133
240 0.797 0.648
0.727 0.53 0.283 0.109
255 0.789 0.622
0.714 0.507 0.263
270 0.781 0.595
0.701 0.483 0.189
285 0.773 0.576
0.688 0.461 0.142
300 0.763 0.546
0.674 0.434
315 0.754 0.522
0.647 0.406
330 0.745 0.499
0.634 0.38
345 0.736 0.474
0.621 0.353
360 0.724 0.448
0.608 0.326
375 0.719 0.427
0.594 0.3
390 0.71 0.398
0.58 0.275
405 0.701 0.361
0.567 0.25
420 0.693 0.421
0.553 0.224
435 0.684 0.342
0.54 0.175
450 0.676 0.361
0.527 0.151
465 0.658 0.371
0.515 0.13
480 0.65 0.262
0.502 0.109
495 0.641 0.275
0.49
510 0.632 0.248
0.477
525 0.623 0.224
0.464
540 0.615 0.205
0.451
555 0.606 0.176
0.438
570 0.597 0.153
0.425
585 0.589 0.13
0.412
600 0.58 0.107
0.399
615 0.572
0.386
630 0.563
0.373
645 0.554
0.359
660 0.546
0.345
675 0.537
0.332
690 0.528
0.314
705 0.52
0.302
720 0.511
0.287
735 0.502
0.272
750 0.499
0.257
765 0.485
0.242
780 0.476
0.228
795 0.467
0.219
810 0.458
0.199
825 0.449
0.185
840 0.44
0.171
855 0.431
0.157
870 0.422
0.144
885 0.413
0.131
900 0.403
0.118
0.395
0.105
0.385
0.376
0.367
0.358
0.349
0.34
0.331
0.322
0.312
0.303
0.294
0.285
0.276
0.267
0.257
0.248
0.239
0.23
0.22
Tabla 4. Cintica de las concentraciones de los tubos 1-8
Tiempo (s) Tubo 1 Tubo 2 Tubo 3 Tubo 4 Tubo 5 Tubo 6 Tubo 7 Tubo 8
1.50E+01 9.05E-04 1.05E-03 8.05E-04 8.48E-04 9.06E-04 8.73E-04 9.54E-04 4.37E-04
3.00E+01 8.96E-04 1.03E-03 7.21E-04 7.30E-04 8.93E-04 8.47E-04 9.14E-04 4.14E-04
4.50E+01 8.87E-04 1.01E-03 6.36E-04 6.05E-04 8.80E-04 8.24E-04 8.63E-04 3.92E-04
6.00E+01 8.79E-04 9.92E-04 5.51E-04 4.77E-04 8.67E-04 8.00E-04 8.32E-04 3.69E-04
7.50E+01 8.71E-04 9.71E-04 4.76E-04 3.52E-04 8.54E-04 7.77E-04 7.93E-04 3.47E-04
9.00E+01 8.63E-04 9.48E-04 3.86E-04 2.27E-04 8.41E-04 7.53E-04 7.42E-04 3.24E-04
1.05E+02 8.54E-04 9.25E-04 3.03E-04 1.09E-04 8.28E-04 7.29E-04 6.98E-04 3.11E-04
1.20E+02 8.46E-04 9.00E-04 2.22E-04 8.14E-04 7.04E-04 6.53E-04 2.79E-04
1.35E+02 8.38E-04 8.82E-04 1.43E-04 8.01E-04 6.80E-04 6.46E-04 2.56E-04
1.50E+02 8.30E-04 8.52E-04
7.88E-04 6.55E-04 5.57E-04 2.33E-04
1.65E+02 8.23E-04 8.28E-04
7.76E-04 6.31E-04 5.05E-04 2.10E-04
1.80E+02 8.15E-04 8.03E-04
7.63E-04 6.07E-04 4.56E-04 1.87E-04
1.95E+02 8.06E-04 7.81E-04
7.50E-04 5.83E-04 4.05E-04 1.64E-04
2.10E+02 7.98E-04 7.56E-04
7.37E-04 5.60E-04 3.62E-04 1.42E-04
2.25E+02 7.89E-04 7.26E-04
7.24E-04 5.37E-04 3.16E-04 1.19E-04
2.40E+02 7.81E-04 7.08E-04
7.11E-04 5.14E-04 2.68E-04 9.47E-05
2.55E+02 7.73E-04 6.83E-04
6.98E-04 4.91E-04 2.48E-04
2.70E+02 7.65E-04 6.57E-04
6.85E-04 4.68E-04 1.74E-04
2.85E+02 7.57E-04 6.32E-04
6.72E-04 4.46E-04 1.28E-04
3.00E+02 7.47E-04 6.06E-04
6.58E-04 4.19E-04
3.15E+02 7.38E-04 5.79E-04
6.31E-04 3.91E-04
3.30E+02 7.29E-04 5.54E-04
6.18E-04 3.65E-04
3.45E+02 7.20E-04 5.30E-04
6.05E-04 3.38E-04
3.60E+02 7.08E-04 5.06E-04
5.92E-04 3.11E-04
3.75E+02 7.03E-04 4.83E-04
5.78E-04 2.85E-04
3.90E+02 6.94E-04 4.59E-04
5.64E-04 2.60E-04
4.05E+02 6.85E-04 4.33E-04
5.51E-04 2.35E-04
4.20E+02 6.77E-04 4.12E-04
5.37E-04 2.09E-04
4.35E+02 6.68E-04 3.83E-04
5.24E-04 1.60E-04
4.50E+02 6.60E-04 3.54E-04
5.11E-04 1.37E-04
4.65E+02 6.42E-04 3.49E-04
4.99E-04 1.16E-04
4.80E+02 6.34E-04 3.47E-04
4.86E-04 9.47E-05
4.95E+02 6.25E-04 2.60E-04
4.74E-04
5.10E+02 6.16E-04 2.33E-04
4.62E-04
5.25E+02 6.07E-04 2.09E-04
4.49E-04
5.40E+02 5.99E-04 1.91E-04
4.36E-04
5.55E+02 5.90E-04 1.61E-04
4.23E-04
5.70E+02 5.81E-04 1.39E-04
4.10E-04
5.85E+02 5.73E-04 1.16E-04
3.97E-04
6.00E+02 5.64E-04 9.27E-05
3.84E-04
6.15E+02 5.56E-04
3.71E-04
6.30E+02 5.47E-04
3.58E-04
6.45E+02 5.38E-04
3.44E-04
6.60E+02 5.30E-04
3.30E-04
6.75E+02 5.21E-04
3.17E-04
6.90E+02 5.12E-04
2.99E-04
7.05E+02 5.04E-04
2.87E-04
7.20E+02 4.95E-04
2.72E-04
7.35E+02 4.86E-04
2.57E-04
7.50E+02 4.83E-04
2.42E-04
7.65E+02 4.69E-04
2.27E-04
7.80E+02 4.61E-04
2.13E-04
7.95E+02 4.52E-04
2.04E-04
8.10E+02 4.43E-04
1.84E-04
8.25E+02 4.34E-04
1.70E-04
8.40E+02 4.25E-04
1.56E-04
8.55E+02 4.16E-04
1.43E-04
8.70E+02 4.07E-04
1.30E-04
8.85E+02 3.98E-04
1.17E-04
9.00E+02 3.88E-04
1.04E-04
9.15E+02 3.80E-04
9.07E-05
9.30E+02 3.70E-04
9.45E+02 3.61E-04
9.60E+02 3.52E-04
9.75E+02 3.43E-04
9.90E+02 3.34E-04
1.01E+03 3.25E-04
1.02E+03 3.16E-04
1.04E+03 3.07E-04
1.05E+03 2.97E-04
1.07E+03 2.88E-04
1.08E+03 2.79E-04
1.10E+03 2.70E-04
1.11E+03 2.61E-04
1.13E+03 2.52E-04
1.14E+03 2.42E-04
1.16E+03 2.33E-04
1.17E+03 2.24E-04
1.19E+03 2.15E-04
4. Construir para cada caso la grfica de tiempo (eje x) contra concentracin de yodo (eje y).
Grfica 2. Cintica de halogenacin de la acetona de os tubos 1-8.
y = -6E-07x + 0.0009
R = 0.9998
y = -2E-06x + 0.0011
R = 0.9982
y = -6E-06x + 0.0009
R = 0.9998
y = -8E-06x + 0.001
R = 0.9999
y = -9E-07x + 0.0009
R = 0.9997
y = -2E-06x + 0.0009
R = 0.9986
y = -3E-06x + 0.001
R = 0.997
y = -2E-06x + 0.0005
R = 0.9994
0.00E+00
2.00E-04
4.00E-04
6.00E-04
8.00E-04
1.00E-03
1.20E-03
0.00E+00 2.00E+02 4.00E+02 6.00E+02 8.00E+02 1.00E+03 1.20E+03 1.40E+03
A
b
s
o
r
b
a
n
c
i
a
Concentracion molar mol/L
1 2 3 4 5 6 7 8
5. Determinar para cada caso los valores de
[
, mediante regresin lineal de las grficas
anteriores.
Tabla 5. Valores de las pendientes en la regresin
lineal.
tubo [
[
[
]
1 0.0000006
-14.32633618
2 0.000002
-13.12236338
3 0.000006 -12.02375109
4 0.000008 -11.73606902
5 0.0000009 -13.92087107
6 0.0000017 -13.28488231
7 0.000003 -12.71689827
8 0.0000015 -13.41004545
6. Graficar los valores de log de la concentracin de [H
+
] contra
[
(resultados de los tubos
1-4).
Tabla 6. Clculo del orden parcial con respecto al cido.
Tubo [H] log [H]
1
0.0232825
-3.760053
-14.32633618
2 0.046565 -3.066906 -13.12236338
3 0.11641251 -2.150615 -12.02375109
4 0.23282501 -1.457468 -11.73606902
7. Graficar los valores de log de la concentracin de acetona contra de
[
(resultados de
los tubos 4-7).
Tabla 7. Clculo del orden parcial con respecto a la acetona.
Tubo [Acetona] log [Ac]
[
[
]
4
1.3619146 0.3088915 -11.73606902
5 0.16342975 -1.811372 -13.92087107
6 0.34047865 -1.077403 -13.28488231
7 0.6809573 -0.384256 -12.71689827
y = 1.1351x - 9.841
R = 0.9492
-15
-14.5
-14
-13.5
-13
-12.5
-12
-11.5
-11
-10.5
-10
-4 -3.5 -3 -2.5 -2 -1.5 -1
l
o
g
(
*
I
2
+
/
t
)
log [H]
Orden parcial de reaccin con respecto al cido
Grfica 3. Determinacin del orden parcial de reaccin con respecto al cido.
Grfica 4. Determinacin del orden parcial de reaccin con respecto a la acetona
Graficar los valores de log de la concentracin de yodo contra de
[
(resultados de los tubos 6 y
8).
y = 0.8439x - 12.387
R = 0.9997
-14.5
-14
-13.5
-13
-12.5
-12
-2 -1.8 -1.6 -1.4 -1.2 -1 -0.8 -0.6 -0.4 -0.2 0
l
o
g
(
*
I
2
+
/
t
)
log [H]
Orden parcial de reaccin con respecto al acetona
Tabla 8. Clculo del orden parcial con respecto al yodo.
Tubo [Yodo] log [y]
[
[
]
6
0.001 -6.907755 -13.28488231
8 0.0005 -7.600902 -13.41004545
Grfica 5. Determinacin del orden parcial de reaccin con respecto al yodo.
DETERMINACIN DE LA LEY DE VELOCIDAD PARA LA REACCIN DE HALOGENACIN DE LA ACETONA.
Podemos simplificar la ley de velocidad para la reaccin, obteniendo la siguiente expresin:
Obteniendo el logaritmo en ambos miembros de la ecuacin tenemos:
[
[
] [
] [
] [
]
Si consideramos la concentracin de acetona y yodo constantes, podemos establecer la ecuacin
simplificada siguiente:
Orden parcial de reaccin con respecto al cido (HCl).
[
[
] [
]
[
] [
]
y = 0.9109x - 1.3084
R = 1
-16
-14
-12
-10
-8
-6
-4
-2
0
-14 -13 -12 -11 -10 -9 -8 -7 -6
l
o
g
(
*
I
2
+
/
t
)
log [H]
Orden parcial de reaccin con respecto al yodo
Orden parcial de reaccin con respecto a la acetona.
[
[
] [
]
[
] [
]
Orden parcial de reaccin con respecto al yodo.
[
[
] [
]
[
] [
]
Determinacin de la constante de velocidad
]
[
]
[
[ ]
[ ]
[ ]
[ ]
[ ]
[ ]
Orden Global de la Reaccin.
[] [] []
ANLISIS DE RESULTADOS.
Se realiz la reaccin de halogenacion de la acetona con yodo, cuya cintica es lenta en condiciones
normales, y acelerada considerablemente en condiciones cidas.
En disolucin acuosa la reaccin de yodacin de la acetona (2-propanona) catalizada por cido puede
describirse como:
Para la determinacin de la ecuacin cintica de la reaccin se emple el mtodo de aislamiento de
Ostwald, que para mantener constante la concentracin de un reactivo, normalmente este se utiliza en
gran exceso, de forma que su concentracin no vari prcticamente al transcurrir la reaccin.
Para una reaccin dada A+BProductos.
Si [B]>>> [A] [B]= cte k = k [B]
b
La velocidad depende de la concentracin de ms de un reactivo.
En la reaccin de halogenacin de acetona se utiliz un exceso de acetona y de cido respecto a la
concentracin de yodo presente.
Las concentraciones de acetona y de cido permanecen prcticamente constantes durante la reaccin.
[
[]
] [] []
En la prctica, se utiliza yodo metlico y yoduro de potasio para preparar la solucin de yodo, ya que
esta mezcla produce una tintura en soluciones de alcohol o agua o la mezcla de ambas y esto nos
permita mediar la absorbancia de la concentracin de la solucin en el espectrofotmetro.
Leyes integradas para un slo reactante, consideran la obtencin de la ley de velocidad para reacciones
de tipo A B, es decir en que la velocidad se puede expresar en trmino de la concentracin de un
nico reactivo.
Representando [A] en funcin del tiempo se obtendr una recta pendiente k (vase figura 1).
Figura 1. Concentracin contra tiempo.
Representando Ln[A] en funcin del tiempo se obtendr una recta pendiente k. (vase figura 2).
Figura 2. Concentracin contra tiempo.
De acuerdo con el tratamiento de los datos, en las tablas 6, 7 y 8, la reaccin de halogenacin de la
acetona es:
De orden cero, es decir es independiente con respecto al yodo (halgeno).
[
] [
]
De primer orden con respecto al cido clorhdrico (ion hidrxido).
[
] [
]
De primer orden con respecto a la acetona.
[
] [
]
Lo que significa que el estado de transicin del paso determinante de la reaccin contiene a la acetona
y el hidrxido, pero no al halgeno, que debe participar en una reaccin rpida posterior al paso
determinante de la reaccin.
Figura 3. Perfil de estado de una reaccin.
Las grficas 9, 10 y 11 se linealizar para determinar el valor de la pendiente cuyo valor ser igual al
valor de las constantes a, b y c que son los rdenes parciales de cada reaccin. Por lo tanto el
orden total de la reaccin se determina mediante la suma de los rdenes parciales.
Para los valores obtenidos se tiene que el orden global de la reaccin es de 1 utilizando acetona, cido
clorhdrico y yodo como reactivos; y una vez determinados los valores de a, b, y c, es posible
determinar la constante de velocidad, igual a
.
Uno de los principales factores que pueden alterar la velocidad de reaccin de la halogenacion de la
acetona es la concentracin de la solucin ya que al aumentarla se aumenta la concentracin de la
misma y por lo tanto la reaccin es ms rpida.
El siguiente esquema satisface los requerimientos cinticos para la reaccin de halogenacin de la
acetona:
Esquema 1. Velocidad de reaccin de halogenacin de la acetona.
Otro factor que altera la velocidad con que se lleva a cabo la reaccin, es la temperatura ya que si esta
se incrementa aumenta la energa cintica, provocando el aumento de la velocidad.
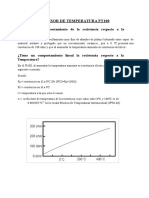
Las reacciones qumicas presentan cinco tipos de comportamiento para la relacin temperatura-
velocidad de reaccin. (Vase figura 3).
Figura 4. Velocidad de reaccin en funcin de la temperatura: diferentes comportamientos.
El comportamiento representado por la grafica es caracterstico de la mayor parte de las reacciones,
la velocidad de la reaccin aumenta de una manera continua al aumentar la temperatura. Los
resultados experimentales en cintica qumica, observan este tipo de comportamiento.
Puesto que la temperatura no afecta mucho la concentracin, la constante de velocidad de reaccin
debe aumentar al elevarse la temperatura. La constante de velocidad y por tanto la velocidad aumenta
con la temperatura. Como regla general un aumento de 10 grados en la temperatura duplica la
velocidad de reaccin.
Arrhenius encontr que la mayor parte de los datos de velocidades de reaccin obedecen la siguiente
ecuacin.
Donde:
: constante de velocidad.
energa de activacin.
constante de los gases.
: temperatura absoluta.
: factor de frecuencia, se puede suponer constante con la temperatura.
CONCLUSIONES.
En la cintica de halogenacin de la acetona podemos concluir que la reaccin es de orden cero con
respecto al yodo, y de primer orden con respecto al cido clorhdrico y a la acetona, mientras que la
constante de velocidad, es igual a
.
Con base en los resultados obtenidos se puede decir que el cido clorhdrico es un catalizador
adecuado para fijar la ley de la velocidad inicial, es decir, el orden de la reaccin con respecto a la
acetona, el ion hidrogeno el yodo, y la constante de velocidad.
Para obtener resultados ms precisos se sugiere exactitud al tomar lecturas del tiempo ya que algunas
reacciones de formacin de color son muy rpidas y otras muy lentas. Esto se debe a que algunas
especies coloreadas experimentan desvanecimientos debidos a la descomposicin por la luz y/o por
reposo, por lo que lo ideal es agilizar la reaccin para estabilizarla.
Verificar la adicin correcta de reactivos al preparar las diluciones, para evitar variaciones en la
disminucin del color al transcurrir el tiempo afectando las mediciones de absorbancia, as como la
longitud de onda.
La velocidad de halogenacin de la acetona es independiente de la concentracin del yodo, pero se
debe tener control para no tener exceso ya que puede existir variacin en la absorcin y perjudicar la
precisin.
En la industria farmacutica, la cintica qumica permite lograr estabilidad en los medicamentos, la
prediccin de su vida til y definir las condiciones de conservacin de los mismos.
y = 1.0472x - 0.0128
R = 0.9967
-0.2
0
0.2
0.4
0.6
0.8
1
1.2
0 0.2 0.4 0.6 0.8 1 1.2
A
4
6
0
Concentracin molar de yodo.
REFERENCIAS.
Velzco, J. R. (s.f.). Determinacin de la constante de velocidad de la reaccin. . Recuperado el 16 de
noviembre de 2013, de http://experimentacion-qf.webs.com/ferrocianuro/files/Ferro_persultafo.pdf
Clara Gmez et al. (2009-2010). Cintica. Recuperado el 27 de noviembre de 2013, de
http://ocw.uv.es/ciencias/1-1/1teo_cinetica_nuevo.pdf
Garric., M. (1979). Qumica General. Barcelona, Espaa: Revert.
UNAM. (s.f.). Teora del estado de transicin. Recuperado el 27 de noviembre de 2013, de
http://depa.fquim.unam.mx/amyd/archivero/Teoria2_354.pdf
USAL. (s.f.). Influencia de la temperatura sobre la velodad de reaccion. Recuperado el 27 de noviembre
de 2013, de http://web.usal.es/~jmcsil/biblioteca/fisicoquimica/capitulo22/parte2.pdf
MEMORIA DE CLCULO.
Tabla 1. Disoluciones para la curva tipo.
Grfica 1. Construccin de la curva tipo.
Concentracin molar del yodo.
)(
Tabla 2. Concentraciones iniciales de las 3 sustancias.
Acetona:
)(
cido clorhdrico pureza del 36%:
(
) (
)(
)(
Yodo:
)(
)
Tabla 4. Concentracin de yodo (mmol/L) de cada una de las disoluciones (Interpolacin).
( )
También podría gustarte
- Determinación de La Ley Experimental de Rapidez. Estudio de La Cinética de Yodación de La Acetona PDFDocumento5 páginasDeterminación de La Ley Experimental de Rapidez. Estudio de La Cinética de Yodación de La Acetona PDFErick ContrerasAún no hay calificaciones
- Relojes QuimicosDocumento4 páginasRelojes QuimicosJuanAún no hay calificaciones
- Determinación densidadDocumento16 páginasDeterminación densidadBrianda de la SanchaAún no hay calificaciones
- Practica 11 HalogenacionendgameremasterizadoDocumento19 páginasPractica 11 HalogenacionendgameremasterizadoEduardo RomeroAún no hay calificaciones
- Practica 3 FisicoquimicaDocumento7 páginasPractica 3 FisicoquimicaQuique RosasAún no hay calificaciones
- Caídas de Presión en Tuberías (P7)Documento7 páginasCaídas de Presión en Tuberías (P7)Josue HernandezAún no hay calificaciones
- Practica 2. Disolución Del KNO3 1.docx FINALDocumento8 páginasPractica 2. Disolución Del KNO3 1.docx FINALKiiKi DeeAún no hay calificaciones
- Adsorción de Ácido Acético Sobre Carbón Vegetal PDFDocumento10 páginasAdsorción de Ácido Acético Sobre Carbón Vegetal PDFAllison ArcanaAún no hay calificaciones
- PRÁCTICA #2 MAI "Preparación y Uso de Disoluciones Patrón Complejométricas" FINALDocumento17 páginasPRÁCTICA #2 MAI "Preparación y Uso de Disoluciones Patrón Complejométricas" FINALGirard GarciaAún no hay calificaciones
- Balance de Materia Con Reaccion Quimica Hidratacion de Anhidrido AceticoDocumento9 páginasBalance de Materia Con Reaccion Quimica Hidratacion de Anhidrido AceticoANAHI ALVARADO TOLENETINOAún no hay calificaciones
- Absorción de Ácido Acético Con Carbón ActivadoDocumento8 páginasAbsorción de Ácido Acético Con Carbón ActivadoMariaElizabethSanchezAún no hay calificaciones
- Diferencia entre grasas y aceites, fabricación de jabónDocumento2 páginasDiferencia entre grasas y aceites, fabricación de jabónIsa SantiagoAún no hay calificaciones
- Determinación de La Ley Experimental de Rapidez.Documento6 páginasDeterminación de La Ley Experimental de Rapidez.thenightfly08160% (5)
- Yodacion-De-Acetona Muy DetalladoDocumento10 páginasYodacion-De-Acetona Muy DetalladoPablo Reinado100% (1)
- Intercambio IonicoDocumento12 páginasIntercambio IonicoAdanJimenezAún no hay calificaciones
- Informe-Adsorción de Ácido Acético Sobre Carbón Activado - Equipo 5 - 3AV1Documento14 páginasInforme-Adsorción de Ácido Acético Sobre Carbón Activado - Equipo 5 - 3AV1ricardo reyesAún no hay calificaciones
- Practica 9 Relojes QuimicosDocumento9 páginasPractica 9 Relojes QuimicosLizette Ramirez100% (1)
- Reporte de Práctica 3. Relojes QuímicosDocumento3 páginasReporte de Práctica 3. Relojes QuímicosBen CHAún no hay calificaciones
- 2p Cinetica de Oxidacion de La Vitamina C Con Ferricianuro de Potasio PDFDocumento4 páginas2p Cinetica de Oxidacion de La Vitamina C Con Ferricianuro de Potasio PDFRuben FelipeAún no hay calificaciones
- Practica Propiedades ColigativasDocumento13 páginasPractica Propiedades ColigativasSara VenturaAún no hay calificaciones
- Examen 2Documento4 páginasExamen 2Jose Fernando Ochoa AlvaradoAún no hay calificaciones
- Reloj de YodoDocumento4 páginasReloj de YodoEdwin Jhovany Alzate RodríguezAún no hay calificaciones
- Adsorción de Ácido Acético Sobre Carbón VegetalDocumento13 páginasAdsorción de Ácido Acético Sobre Carbón VegetalJose Fernando Ochoa AlvaradoAún no hay calificaciones
- Humedad en Una Muestra Comercial de TalcoDocumento3 páginasHumedad en Una Muestra Comercial de TalcoDanahy PraviaAún no hay calificaciones
- CineticaDocumento9 páginasCineticarubenAún no hay calificaciones
- Practica 5 Entalpias de VaporizacionDocumento5 páginasPractica 5 Entalpias de VaporizacionBelen Cy GómezAún no hay calificaciones
- Practica 3 Cromatografia Laboratorio de Quimica de Los HidrocarburosDocumento5 páginasPractica 3 Cromatografia Laboratorio de Quimica de Los HidrocarburosJAVIER GutierrezAún no hay calificaciones
- Isoterma de AdsorciónDocumento35 páginasIsoterma de AdsorciónChris VFAún no hay calificaciones
- Manual Q. Analitica PDFDocumento98 páginasManual Q. Analitica PDFAriadna SCAún no hay calificaciones
- Universidad Nacional Autónoma de México: Facultad de Estudios Superiores CuautitlánDocumento12 páginasUniversidad Nacional Autónoma de México: Facultad de Estudios Superiores CuautitlánDiego CarñoAún no hay calificaciones
- Práctica 2 Determinación de La CMCDocumento6 páginasPráctica 2 Determinación de La CMCGiovanny Tapia CarlosAún no hay calificaciones
- Reporte P4 PDFDocumento10 páginasReporte P4 PDFMarco Antonio DueñasAún no hay calificaciones
- Luyben Ejemplo 2Documento101 páginasLuyben Ejemplo 2Victor ZafersonAún no hay calificaciones
- Antecedentes Practica 8Documento9 páginasAntecedentes Practica 8Tania MorenoAún no hay calificaciones
- Reporte 3 LIQIVDocumento6 páginasReporte 3 LIQIVCarlos GuevaraAún no hay calificaciones
- Examen Fisicoquimica I.Q. E-J 2021 U.4-Aniceto HJDocumento4 páginasExamen Fisicoquimica I.Q. E-J 2021 U.4-Aniceto HJMexico CampeonAún no hay calificaciones
- Influencia Del PH en El Equilibrio RedoxDocumento7 páginasInfluencia Del PH en El Equilibrio RedoxNicib MendozaAún no hay calificaciones
- Descomposicion Catalitica Del Peroxido de HidrogenoDocumento22 páginasDescomposicion Catalitica Del Peroxido de HidrogenoAzul_fqaazAún no hay calificaciones
- Cinética de La Halogenación de La Acetona.Documento17 páginasCinética de La Halogenación de La Acetona.Juan Pablo Mamani ApazaAún no hay calificaciones
- Practica 3 Termo3Documento9 páginasPractica 3 Termo3Anonymous jU0TwwIAún no hay calificaciones
- Lab. QA (2) CaCO3 en TUMSDocumento5 páginasLab. QA (2) CaCO3 en TUMSGerardo MartínezAún no hay calificaciones
- Isotermas de AdsorciónDocumento8 páginasIsotermas de AdsorciónAnonymous ExcNQWv7PAún no hay calificaciones
- Practica 1. Preparacion de DisolucionesDocumento6 páginasPractica 1. Preparacion de DisolucionesItzel González Triple S100% (1)
- Practica 9 Calor de CombustionDocumento12 páginasPractica 9 Calor de CombustionJuan Fermin PachecoAún no hay calificaciones
- Previos Practica 3 - Titulación ConductimétricaDocumento9 páginasPrevios Practica 3 - Titulación ConductimétricaAxl HinojosaAún no hay calificaciones
- Parte 1 AdsorptionDocumento108 páginasParte 1 AdsorptionDaniela Alejandra OsorioAún no hay calificaciones
- Isotermas de Adsorción de Ácido AcéticoDocumento7 páginasIsotermas de Adsorción de Ácido Acéticoメデ カナAún no hay calificaciones
- Espectrofotometria EDTADocumento9 páginasEspectrofotometria EDTALeoAún no hay calificaciones
- Informe Practica 2Documento6 páginasInforme Practica 2Abi CorreaAún no hay calificaciones
- Practica 7Documento3 páginasPractica 7salvador sanchezAún no hay calificaciones
- Prácticas de Laboratorio (Espectrofotometria)Documento12 páginasPrácticas de Laboratorio (Espectrofotometria)Guillermo Javier Alonso Trujillo100% (1)
- Balance de materia MEG dilución régimen no permanenteDocumento9 páginasBalance de materia MEG dilución régimen no permanentemartin pedrazAún no hay calificaciones
- Espectrofotometría y curvas patronesDocumento2 páginasEspectrofotometría y curvas patronesYess BlueAún no hay calificaciones
- Torre de EnfriamientoDocumento1 páginaTorre de EnfriamientoErik MendozaAún no hay calificaciones
- EyC P-7Documento10 páginasEyC P-7Diego SanchezAún no hay calificaciones
- Aplicación de La Catálisis en El Enfoque AlimenticioDocumento3 páginasAplicación de La Catálisis en El Enfoque AlimenticioLuis BernyAún no hay calificaciones
- Previo 10 EycDocumento14 páginasPrevio 10 EycXimena GonzálezAún no hay calificaciones
- Practica 2 Liq 1Documento10 páginasPractica 2 Liq 1MONTSERRAT HERNANDEZ BETANCOURTAún no hay calificaciones
- Ejercicio Incertidumbre 2021-1 NALJDocumento4 páginasEjercicio Incertidumbre 2021-1 NALJFusto WalasAún no hay calificaciones
- Cálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaDe EverandCálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaCalificación: 5 de 5 estrellas5/5 (1)
- CristalizaciónDocumento11 páginasCristalizaciónCuauhtémoc M RdzAún no hay calificaciones
- Prueba de Sensibilidad de AntibióticosDocumento15 páginasPrueba de Sensibilidad de AntibióticosCuauhtémoc M RdzAún no hay calificaciones
- Tecno 2 Disc Pract 3 y 4Documento18 páginasTecno 2 Disc Pract 3 y 4Cuauhtémoc M RdzAún no hay calificaciones
- Práctica No. 7 Preparación e Identificación de Emulsiones.Documento19 páginasPráctica No. 7 Preparación e Identificación de Emulsiones.Cuauhtémoc M Rdz60% (5)
- Práctica No. 7 Preparación e Identificación de Emulsiones.Documento19 páginasPráctica No. 7 Preparación e Identificación de Emulsiones.Cuauhtémoc M Rdz60% (5)
- Cultivo DiferencialDocumento15 páginasCultivo DiferencialjoeljuanAún no hay calificaciones
- Cinetica de La Alogenación de La AcetonaDocumento21 páginasCinetica de La Alogenación de La AcetonaCuauhtémoc M RdzAún no hay calificaciones
- Cinetica de La Alogenación de La AcetonaDocumento21 páginasCinetica de La Alogenación de La AcetonaCuauhtémoc M RdzAún no hay calificaciones
- Practica de Difusividad TermicaDocumento18 páginasPractica de Difusividad TermicaCuauhtémoc M RdzAún no hay calificaciones
- Practica 1 FQDocumento16 páginasPractica 1 FQCuauhtémoc M RdzAún no hay calificaciones
- Celebrex Prospecto PacientesDocumento5 páginasCelebrex Prospecto PacientesJaianArancibiaAún no hay calificaciones
- Balance de MateriaDocumento13 páginasBalance de MateriaCuauhtémoc M RdzAún no hay calificaciones
- Practica 1Documento7 páginasPractica 1Cuauhtémoc M RdzAún no hay calificaciones
- BasaltoDocumento2 páginasBasaltoCuauhtémoc M RdzAún no hay calificaciones
- Solidificacion de MetalesDocumento59 páginasSolidificacion de Metalessalda7a100% (1)
- Calculo de VentilacionDocumento22 páginasCalculo de VentilacionManuel CorreiaAún no hay calificaciones
- Comportamiento Conductividad Electrica Frente TemperaturaDocumento7 páginasComportamiento Conductividad Electrica Frente Temperaturakikin312012Aún no hay calificaciones
- Ejercicios ResueltosDocumento7 páginasEjercicios ResueltosJuanpaCalle100% (3)
- Fisica AplicadaDocumento8 páginasFisica AplicadaalncitoAún no hay calificaciones
- Flujo Termico en SoldaduraDocumento25 páginasFlujo Termico en SoldaduraRoberto DavisAún no hay calificaciones
- Equilibrio líquido-líquido en mezclas binariasDocumento12 páginasEquilibrio líquido-líquido en mezclas binariasLaura Rodriguez100% (1)
- Monografia VeterinariaDocumento14 páginasMonografia Veterinariadavid alonso50% (2)
- Resina epoxi impregnación gota-gota clase FDocumento2 páginasResina epoxi impregnación gota-gota clase FAysmar EsthelaAún no hay calificaciones
- La Temperatura y Presion AtmosfericaDocumento12 páginasLa Temperatura y Presion AtmosfericaYesid CorreaAún no hay calificaciones
- Calor y Cambios de EstadoDocumento33 páginasCalor y Cambios de EstadoFederico Del Brio0% (1)
- Investigacion WestinghouseDocumento37 páginasInvestigacion WestinghouseRaúl Valadez100% (1)
- Conceptos Esenciales para La Comprehención de Prevención de IncendiosDocumento34 páginasConceptos Esenciales para La Comprehención de Prevención de IncendiosIsrael Rodriguez MarquezAún no hay calificaciones
- MAT - U6 - 3er Grado - Sesion 07Documento5 páginasMAT - U6 - 3er Grado - Sesion 07Gladys Maria Quiroz TorrealvaAún no hay calificaciones
- Tipos de hornos para secado de maderaDocumento17 páginasTipos de hornos para secado de maderaAlejandro Montes GarciaAún no hay calificaciones
- Termodinámica Del Universo Temprano Desde Una Cosmología NewtonianaDocumento5 páginasTermodinámica Del Universo Temprano Desde Una Cosmología Newtonianawilson alexander rojas castilloAún no hay calificaciones
- Msds Anticongelante AkronDocumento5 páginasMsds Anticongelante AkronGiancarlo Olivera BejarAún no hay calificaciones
- Curso Masico Parte 1Documento41 páginasCurso Masico Parte 1979183Aún no hay calificaciones
- Capacidad de Vaporizacion de Una CalderaDocumento3 páginasCapacidad de Vaporizacion de Una CalderaVeangance DarkAún no hay calificaciones
- Turbinas A Gas Aplicadas A La Propulsión NavalDocumento39 páginasTurbinas A Gas Aplicadas A La Propulsión Navalkatja_tkm100% (1)
- Feedback Sensor de Temperatura Pt100Documento7 páginasFeedback Sensor de Temperatura Pt100anon_342155441Aún no hay calificaciones
- Estacion Meteorologica Augusto WeberbauerDocumento21 páginasEstacion Meteorologica Augusto WeberbauerSuly Flores50% (2)
- Procedimiento de Pintado Proyecto Puente Osmare Pacocha - VAE Rev00 - SPCCDocumento8 páginasProcedimiento de Pintado Proyecto Puente Osmare Pacocha - VAE Rev00 - SPCCmiguelonju100% (1)
- Folleto Balance de Materia y EnergiaDocumento14 páginasFolleto Balance de Materia y Energialupo57Aún no hay calificaciones
- Psicología Diferencial: Calidad que se acredita internacionalmenteDocumento96 páginasPsicología Diferencial: Calidad que se acredita internacionalmenteFernando Mendez Baltazar67% (3)
- Curso Termodinamica CompDocumento355 páginasCurso Termodinamica CompGiancarlo Lazaro Cruz100% (3)
- Capítulo 14Documento21 páginasCapítulo 14KaworuIIDXAún no hay calificaciones
- 08 0988 QDocumento144 páginas08 0988 Q4lvar0Aún no hay calificaciones
- Norma ChimeneasDocumento17 páginasNorma ChimeneasGustavo RiveraAún no hay calificaciones
- Norma INV E-302-07Documento13 páginasNorma INV E-302-07Jorge Luis Trujillo VanegasAún no hay calificaciones