Documentos de Académico
Documentos de Profesional
Documentos de Cultura
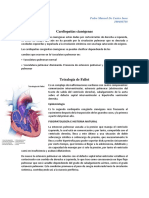
Pediatria Cardiopatías
Cargado por
olgalucia6435355Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Pediatria Cardiopatías
Cargado por
olgalucia6435355Copyright:
Formatos disponibles
PEDIATRÍA
LAS CARDIOPATÍAS CONGÉNITAS
Dr. J. Vidal-Bota
ÍNDICE
Cardiopatías con cortocircuito izquierda-derecha (sistémico-pulmonar)
o Persistencia del conducto arterioso
o Comunicación interventricular
o Comunicación interauricular
o Síndrome de Eisenmenger
Cardiopatías con cortocircuito derecha-izquierda (pulmonar-sistémico)
o Tetralogía de Fallot
o Transposición de los grandes vasos
Cardiopatías obstructivas de salida de ventrículo derecho o ventrículo
izquierdo
CARDIOPATÍAS CON CORTOCIRCUITO IZQUIERDA-DERECHA
(SISTÉMICO-PULMONAR)
Son defectos anatómicos que permiten una interconexión entre los dos circuitos
sanguíneos, originándose un paso de sangre a favor de gradiente desde el de
mayor presión al de presión más baja (en condiciones normales desde el circuito
sistèmico al sistema vascular pulmonar).
Podemos diferenciar diversos niveles de cortocircuito: aquél que conecta la aorta
con la arteria pulmonar (el más frecuente es la persistencia del conducto
arterioso de Botal), el que que conecta ambas aurículas entre sí
(comunicación interauricular) y el que conecta ambos ventrículos
(comunicación interventricular). Existen también formas mixtas, como el
defecto aurículo-ventricular (denominado también canal aurículo-ventricular en
las formas más graves), frecuente sobre todo en personas con síndrome de
Down. (inicio)
PERSISTENCIA DEL CONDUCTO ARTERIOSO (PCA, PDA)
(Inglés: Patent Ductus Arteriosus)
Consiste en la persistencia en la vida postnatal de un vaso fetal, el ductus
arteriosus o conducto arterioso, que conecta la aorta con la arteria
pulmonar. Supone el 6-8% de las cardiopatías congénitas.
Antes del nacimiento, esta estructura vascular (denominada con frecuencia
simplemente "ductus") conecta la arteria pulmonar con la aorta descendente. Se
trata de un vaso de tipo arterial que - en el feto- deriva directamente hacia la
aorta gran parte de la sangre que sale del ventrículo derecho y entra en el tronco
de la arteria pulmonar, evitando así que penetre en los pulmones. Como ya se
ha explicado, esta estructura fetal se debe cerrar poco después de nacer (ver:
circulación de transición).
FIGURA 1
Ductus arterioso persistente (PDA). Se trata de un componente de la
circulación fetal que deriva la sangre procedente del ventrículo derecho
(venosa) directamente hacia la aorta, sin atravesar los pulmones. Esta
estructura fetal se debe cerrar dentro de los tres días que siguen al
nacimiento. Cuando permanece permeable, la dirección del flujo de
sangre se invierte después de que el recién nacido inicie la respiración,
dirigiéndose entonces desde la aorta hacia la arteria pulmonar (flujo
izquierda-derecha). AO aorta, AP arteria pulmonar, VD ventrículo
derecho, VE ventrículo izquierdo, PDA ductus.
Copyright © 2007 - Universitat de Lleida
En los niños afectados de esta cardiopatía, el ductus permanece permeable al
nacer, y después de iniciar la respiración la dirección del flujo de sangre se
invierte pasando de la aorta a la arteria pulmonar (flujo izquierda-derecha).
Como consecuencia aumenta el contenido de sangre en los pulmones y en el
corazón (sobrecarga de volumen de aurícula y ventrículo izquierdos) y aumenta
el caudal cardíaco.
FIGURA 2 FIGURA 3
Sintomatología: la persistencia del ductus se puede presentar en el prematuro,
enmarcándose entonces en el entorno de las alteraciones de la circulación de
transición (ver).
Cuando el vaso es de pequeño calibre puede manifestarse - en el niño a
término, del que aquí nos ocupamos - por el hallazgo casual de un soplo
cardíaco. Los ductus de mayor diámetro originan síntomas de insuficiencia
cardíaca, principalmente disnea, infecciones respiratorias frecuentes y retraso en
la ganancia de peso.
La exploración nos ayudará a precisar el diagnóstico: en su forma típica, el
tórax es a menudo prominente y puede palparse un frémito a nivel del foco
pulmonar, lugar donde se ausculta un soplo continuo intenso. Llama la atención
la gran hiperdinamia circulatoria: pulsos amplios fácilmente palpables a nivel
carotídeo y femoral, y latido de punta muy activo. La tensión arterial diferencial
es amplia, con una diastólica baja.
El electrocardiograma y la radiografía de tórax muestran hipertrofia auricular y
ventricular izquierdas, observándose en la placa de tórax un aumento del arco
pulmonar y mayor densidad hiliar. La ecocardiografía-Doppler permite
visualizar directamente el ductus y pone en evidencia el flujo sanguíneo anómalo
sistólico-diastólico desde la aorta a la arteria pulmonar.
FIGURA 5
Imagen ecocardiográfica
FIGURA 4 que muestra el arco
aórtico (AO) y la arteria
Espectrograma Doppler que muestra un flujo pulmonar (PA). El flujo
continuo de alta velocidad desde aorta a turbulento (rojo, amarillo
arteria pulmonar y verde) sirtuado entre
ambas estructuras
corresponde a un
pequeño ductus.
La evolución es variable. Existe el peligro de que la situación se descompense
y el niño entre en insuficiencia cardíaca congestiva. Otras veces la
persistencia del ductus se complica con una endocarditis bacteriana (infección
a menudo estreptocócica o estafilocócica). En tercer lugar, si el ductus es grande
y no se trata, el hiperaflujo mantenido puede acabar alterando la anatomia de las
arteriolas pulmonares, dando lugar a una situación progresiva e irreversible de
hipertensión pulmonar que finalmente producirá la inversión del cortocircuito. La
corriente sanguínea fluirá entonces desde la pulmonar a la aorta (situación de
Eisenmenger), produciendo una desaturación sistémica y - si no se corrige- una
muerte prematura.
En la situación de Eisenmenger aparece cianosis y disnea a pequeños esfuerzos
y la auscultación se va empobreciendo: el soplo se acorta y se hace
mesosistólico o desaparece; el segundo tono aumenta de intensidad y se hace
muy fuerte; y puede aparecer en foco pulmonar un soplo protodiastólico de
insuficiencia pulmonar. El ECG muestra una progresiva hipertrofia de cavidades
derechas, y la radiografía un aumento de la cardiomegalia y del relieve del arco
pulmonar, así como un refuerzo vascular a nivel de los hilios, cosa que contrasta
con la claridad vascular de la periferia del pulmón (imagen en árbol podado).
Llegados a este punto evolutivo, el cierre del ductus está contraindicado, siendo
el trasplante cardiopulmonar la única opción terapéutica posible.
FIGURA 7
FIGURA 6 Situación de Eisenmenger: la
cardiomegalia ha aumentado y los
Radiografía correspondiente a un hilios se han hecho muy densos.
lactante con un cortocircuito izquierda- Pero la densidad se interrumpe
derecha por un ductus. El cuadro da repentinamente, siendo los vasos
lugar al aumento de sangre en el escasos en la periferia pulmonar
circuito pulmonar y se traduce (imagen en árbol podado). La
radológicamente por hiperflujo hipertensión pulmonar grave
pulmonar. produce campos pulmonares
claros, con disminución de marcas
vasculares.
El tratamiento del ductus grande no complicado consiste inicialmente en tratar
la insuficiencia cardíaca. Con ello mejora la situación clínica del paciente y es
posible proceder posteriormente a la ligadura y sección del vaso (tratamiento
quirúrgico). También se puede cerrar el ductus sin recurrir a la cirugía, en el
curso de un cateterismo venoso intervencionista: se deposita en el interior del
vaso un coil (espiral metálica enrollada) con poder embolizante, obstruyendo así
la luz, o bien colocando en el interior del vaso un dispositivo oclusor para
ductus tipo Amplatz o similar.
Profilaxis endocardítica: Al igual que ocurre con la mayoría de las cardiopatías
congénitas, mientras no se haya corregido completamente el defecto hará falta
prevenir la infección endocardítica administrando ante situaciones de riesgo
elevado el oportuno antibiótico . (inicio)
COMUNICACIÓN INTERVENTRICULAR (CIV, VSD)
(Inglés: Ventricular Septal Defect)
Consiste en uno o más orificios a nivel del septum interventricular, los
cuales comunican entre sí ambos ventrículos.
Es la cardiopatía congénita más frecuente (32%). Desde el punto de vista
anatómico, las formas más frecuentes de comunicación se encuentran a nivel
del septo muscular (CIV muscular) o cerca de la raíz aórtica (CIV
perimembranosa). A veces se localiza en el infundíbulo pulmonar (CIV
infundibular). En los trastornos de fusión de las estructuras embriológicas
denominadas almohadillas endocárdicas, la CIV se sitúa en el mismo plano que
las válvulas aurículo-ventriculares, en el tracto de entrada de la cavidades
ventriculares (CIV de tipo canal atrioventricular).
Fisiopatología: La CIV produce un cortocircuito izquierda-derecha a nivel de los
ventrículos que se traduce clínicamente por un soplo cardíaco descubierto
habitualmente en el curso d’una exploración rutinaria del niño.
FIGURA 8 FIGURA 9
La clínica La clínica es similar a la ya descrita para el ductus: signos de
dificultad respiratoria, taquicardia, hepatomegalia y retraso de crecimiento. Se
auscultará un soplo pansistólico fuerte a nivel de la parte baja del borde esternal
izquierdo, lugar donde se palpará un frémito.
Cuando la CIV es grande, la persistencia de un cortocircuito sanguíneo
importante favorece la producción de cambios anatómicos irreversibles en las
capas más internas de las arteriolas, lo que comporta una obstrucción al paso de
la sangre y conduce a una situación irreversible de elevación de la presión
pulmonar (hipertensión pulmonar fija). Es el síndrome de Eisenmenger. La
hipertensión pulmonar fija contraindica la corrección del defecto, al convertirse
éste en la única vía de escape del exceso de presión del ventrículo derecho, el
cual de lo contrario acabaría fallando (insuficiencia cardíaca derecha).
El ECG mostrará en la CIV no complicada hipertrofia biventricular de predominio
izquierdo. La radiografía de tórax presenta cardiomegalia y aumento de las
marcas vasculares. En caso de complicarse evolucionando a hipertensión
pulmonar, aparecerá de forma progresiva en el ECG hipertrofia ventricular y
auricular derechas, y la radiografía de tórax exagerará el aumento del arco
pulmonar, desapareciendo las marcas vasculares a nivel de la periferia pulmonar
(imagen de árbol podado). La ecocardiografía-Doppler nos precisará
exactamente la localización anatómica de la comunicación y las repercusiones
hemodinámicas.
FIGURA 10
Radiografía de
tórax
correspondiente
a una CIV. Se
observa un
hiperaflujo
pulmonar. En
caso de
evolucionar a
hipertensión
pulmonar,
aparecerá de
forma
progresiva en el
ECG hipertrofia
ventricular y
auricular
derechas, y la
radiografía de
tórax mostrará
un aumento
más notable del
arco pulmonar,
desapareciendo
las marcas
vasculares a
nivel de la
periferia
pulmonar
(imagen de
árbol podado)
Evolución: La mayoría de comunicaciones interventriculares del niño son
pequeñas y tienen tendencia a reducirse de diámetro durante el primer año.
Muchos de estos defectos pequeños cierran espontáneamente a lo largo de los
primeros años. En cambio, los defectos grandes a menudo deben cerrarse
quirúrgicamente.
El tratamiento inicial se dirigirá a la insuficiencia cardíaca y a la prevención de la
endocarditis bacteriana. En caso de persistir un cortocircuito importante tras los
primeros meses o del primer año, hará falta valorar la posibilidad de corregir la
CIV quirúrgicamente antes de que pueda derivar hacia un síndrome de
Eisenmenger. En el lactante pequeño se hace a veces necesario practicar una
intervención paliativa provisional denominada "banding de la arteria pulmonar"
con el fin de producir una estenosis artificial temporal del tronco de dicha arteria i
disminuir así el flujo sanguíneo hacia el pulmón. De esta manera es posible
superar la situación de insuficiencia cardíaca que la sobrecarga de volumen
comportaba. (inicio)
COMUNICACIÓN INTERAURICULAR (CIA, ASD)
(Inglés: Atrial Septal Defect)
Se trata de un defecto del septum interauricular, que se puede localizar a
diferentes niveles. La CIA tipo ostium secundum se situa en la zona del foramen
oval, mientras que la denominada ostium primum se encuentra en la parte más
baja del septo interauricular y se asocia a válvulas aurículo-ventriculares
anormales (defecto o cleft a nivel de la válvula mitral o de la tricúspide). Son
menos frecuentes: la CIA tipo seno coronario, situada a nivel de esta estructura y
las comunicaciones interauriculares que se sitúan en la desembocadura de las
venas cavas (tipo seno venoso).
Fisiopatología: Se origina un cortocircuito izquierda-derecha entre las aurículas.
FIGURA 11. Tipos de comunicación interauricular.
Síntomas: En el niño y en función de su tamaño, la CIA puede cursar sin
síntomas o puede originar bronquitis frecuentes. En los casos más graves
pueden aparecer signos de insuficiencia cardíaca y con los años originar el
cuadro de la hipertensión pulmonar fixa (també denominada reactiva). Este
proceso se puede acelerar en caso de grandes comunicaciones, especialmente
si se trata de un ostium primum. En el adulto, la CIA puede ser responsable de la
aparición de arrítmias como la fibrilación auricular.
FIGURA 12. Comunicación
interauricular. Fisiología
En el examen físico destaca la presencia de un soplo suave de eyección en
foco pulmonar acompañado de un segundo ruido permanentemente desdoblado.
En caso de flujo importante se auscultará también un soplo mesodiastólico a
nivel tricuspídeo (por aumento del caudal sanguíneo a través de la válvula AV
derecha).
La radiografía de tórax muestra un moderada cardiomegalia a expensas sobre
todo de cavidades derechas, arco prominente de la arteria pulmonar, un botón
aórtico de volumen reducido y refuerzo de las marcas vasculares pulmonares. El
electrocardiograma muestra en el ostium secundum una sobrecarga de
volumen del ventrículo derecho con un desvío del eje QRS en el plano frontal
hacia la derecha (entre 90 y 130 grados) y con un complejo rSR' en V1, con S
ancha en V6. En el ostium primum hay una típica hiperdesviación del eje QRS
hacia la izquierda en el plano frontal (trazado que también se puede encontrar en
el hemibloqueo anterior izquierdo del sistema de conducción). La
ecocardiografía permite objetivar el defecto septal (posición y tamaño),
confirmando así el diagnóstico. Además permitirá evaluar la situación
hemodinámica (grado de dilatación del VD y existencia - en las comunicaciones
importantes - de alteraciones de la dinámica ventricular, con movimiento septal
ventricular aplanado o invertido).
FIGURA 14. Bloqueo de rama derecha FIGURA 15. Defecto
FIGURA 13.
en el ECG de un enfermo con interauricular tipo ostium
Radiografía en un
comunicación interauricular. secundum, que comunica
caso de CIA
la aurícula derecha (RA)
con la izquierda (LA)
Evolución: Estos defectos no suelen cerrar espontáneamente. Si el shunt es
importante (QP/QS o relación entre el flujo pulmonar y el sistémico igual o
superior a 1,5) se deberá proceder a su cierre.
Tratamiento: El cierre de la CIA (quirúrgico o por un dispositivo que se coloca en
un catéter vascular) se deberá hacer en todos los niños sintomáticos y también –
como ya hemos comentado- en aquellos que tengan un flujo importante a través
del defecto. Los resultados son muy buenos.
Dado el bajo riesgo de endocarditis de esta cardiopatía, no está indicada en la
CIA la profilaxis de endocarditis. (inicio)
DEFECTO SEPTAL ATRIOVENTRICULAR [nombres relacionados: canal
atrioventricular, defecto de cojinetes endocárdicos, ostium primum]
(Inglés: Atrioventricular septal defect)
Se trata de un defecto tipo ostium primum con malformación de una o las dos
válvulas aurículo-ventriculares, con o sin comunicación interventricular. Esta
malformación es la consecuencia del desarrollo anómalo de las almohadillas
endocárdicas y puede ser parcial o completo. El 30% de pacientes con defecto
completo presentan síndrome de Down.
El defecto septal atrioventricular parcial es el que hemos estudiado como
comunicación interauricular tipo ostium primum en el apartado anterior. La
sintomatología y la exploración son similares a las del ostium secundum.
El defecto septal atrioventricular completo se compone de una comunicación
interauricular baja amplia tipo ostium primum, una comunicación interventricular
a nivel del tracto de entrada a los ventrículos y un orificio valvular común con
insuficiencia valvular. Existe una derivación o shunt izquierda-derecha tanto a
nivel auricular como ventricular. Se produce una dilatación de las cuatro
cavidades cardíacas y aumento en el contenido de sangre de la circulación
pulmonar. La evolución natural es hacia el síndrome de Eisenmenger, motivo por
el cual es necesario proceder al cierre quirúrgico precoz del defecto.
Si bien la cardiopatía puede ser asintomática cuando se trata de un ostium
primum con defecto pequeño, si el defecto es grande suele provocar
insuficiencia cardíaca (ver: IC del niño). La radiografía muestra cardiomegalia
con dilatación de la aurícula derecha y de los los dos ventrículos, aumento del
botón pulmonar y aumento de las marcas vasculares pulmonares. De forma
característica, el ECG muestra un eje QRS dirigido hacia arriba, un bloqueo AV
de primer grado y signos de hipertrofia de las mismas cavidades mencionadas al
describir la radiografía.
La evolución natural es hacia el síndrome de Eisenmenger, motivo por el cual es
necesario proceder pronto al cierre quirúrgico del defecto. Antes hará falta tratar
la insuficiencia cardíaca. Se debe hacer profilaxis de la endocarditis.
SÍNDROME DE EISENMENGER (situación de Eisenmenger, hipertensión
pulmonar reactiva secundaria a un shunt izquierda-derecha)
A lo largo del texto hemos ido describiendo esta complicación de los
cortocircuitos izquierda-derecha. Recopilamos ahora lo que hemos ido
explicando.
Cualquiera de los cortocircuitos izquierda derecha que hemos explicado, si es
importante y persiste a lo largo del tiempo, es capaz de provocar este síndrome.
Si no se corrige antes, al cabo de unos años da lugar a una alteración anatómica
de las arteriolas que provoca una progresiva hipertensión pulmonar que tiene la
particularidad de ser irreversible y progresiva, produciendo la inversión del
cortocircuito cuando las presiones pulmonares superan las sistèmicas. El flujo de
sangre irá entonces desde la arteria pulmonar hacia la aorta (situación de
Eisenmenger).
La persistencia de un cortocircuito sanguíneo
Grados de lesión de la importante estimula a nivel pulmonar la
arteria pulmonar: producción de cambios anatómicos irreversibles
en las capas más internas de las arteriolas. Ello
a. Hipertrofia de la implica una obstrucción al paso de la sangre y
media conducen - a partir de cierto grado de lesión - a
b. Proliferación de una situación irreversible de elevación de la
la íntima presión pulmonar (hipertensión pulmonar
c. Fibrosis de la reactiva o fija). La hipertensión pulmonar fija
íntima (irreversible) contraindica la corrección quirúrgica del defecto,
al convertirse éste en la única vía de escape del
d. Lesiones exceso de presión del ventrículo derecho, el
plexiformes cual de lo contrario entraría en fallo cardiaco.
(irreversibles)
En la situación de Eisenmenger aparece
cianosis y disnea a pequeños esfuerzos y la
auscultación se irá empobreciendo: el soplo sistólico se acorta y se hace
mesosistólico o desaparece del todo; el segundo tono aumenta de intensidad y
se hace muy fuerte, pudiendo aparecer un soplo protodiastólico de
insuficiencia pulmonar. El ECG muestra una progresiva hipertrofia de cavidades
derechas, y la radiografía un aumento de la cardiomegalia y del relieve del arco
pulmonar, así como un refuerzo vascular a nivel de los hilios, lo cual contrasta
con la claridad vascular de la periferia del pulmón (imagen en árbol podado).
(figuras 6 y 7)
La actitud terapéutica correcta consiste en evitar que se llegue a esta situación,
corrigiendo antes el defecto. Si no se actuó de esta manera y el cuadro ya se ha
instaurado plenamente, entonces el cierre del ductus está contraindicado. El
tratamiento deberá entonces ser sintomático, procurando hidratar bien al
enfermo y efectuándose eritroféresis periódicas para disminuir la policitemia y
corregir los valores excesivamente elevados de hematocrito.
Evolución: de forma natural, el cuadro progresa lentamente y acaba
produciendo la muerte en unos años, generalmente en la adolescencia o
juventut del enfermo, a menos que se efectúe un trasplante cardiopulmonar, el
cual - caso de ir bien - resulta el único recurso eficaz para devolverle la salud. De
forma típica, los niños con síndrome de Down tienen especial propensión a
desarrollar pronto esta complicación: se detecta ya cuando el niño es aún
pequeño, a los dos o tres años. Por este motivo, los niños con trisomía 21 (S. de
Down) y cortocircuito izquierda derecha deben ser tratados cuando antes,
procediendo al cierre del shunt. (inicio)
CARDIOPATÍAS CON CORTOCIRCUITO DERECHA IZQUIERDA
(PULMONAR-SISTÉMICO)
Son defectos anatómicos que permiten también una conexión entre ambos
circuitos sanguíneos, produciéndose entre ellos un paso de sangre a favor de
gradiente de presión, el cual, por las peculiares condiciones anatómicas de los
defectos irá desde las cavidades derechas a las izquierdas o desde el circuito
pulmonar al sistémico. Como consecuencia estos niños presentaran cianosis.
Las cardiopatías más representativas del grupo son la tetralogía de Fallot y la
transposición de los grandes vasos. (inicio)
TETRALOGÍA DE FALLOT (Inglés: Tetralogy of Fallot)
Suponiendo el 10% del total de las cardiopatías congénitas, la tetralogia de
Fallot es la más frecuente de las cardiopatías cianosantes y constituye la primera
causa de cianosis en el niño de más de 1 año. Fue descrita por primera vez en
Francia a finales del siglo XIX por Fallot (maladie bleu o enfermedad azul), con
los cuatro componentes clásicos: comunicació interventricular ancha situada
inmediatamente bajo la aorta, estenosis pulmonar de predominio infundibular,
malposición de la aorta, la cual cabalga sobre el septum interventricular, e
hipertrofia ventricular derecha. Embriológicamente se origina por partición
desigual del tronco-cono a favor de la aorta y con menoscabo de la pulmonar,
cosa que explica el origen de la estenosis pulmonar, el defecto septal por mala
alineación y el cabalgamiento aórtico. La hipertrofia ventricular derecha sería
secundaria, consecuencia de la estenosis pulmonar.
La fisiopatología justifica los hallazgos clínicos. El retorno venoso sistémico llega
al VD y se encuentra con dificultad para seguir la vía pulmonar, tomando la
sangre el camino más fácil de la CIV y entrando en la aorta. Se trata pues de un
cortocircuito derecha-izquierda (venoso arterial) que ocasionará disminución del
flujo arterial pulmonar y desaturación arterial sistémica (cianosis e hipoxia). La
presencia de la CIV impedirá la elevación de la presión del VD por encima de la
presión sistémica (propia del del ventrículo izquierdo) por muy importante que
sea la estenosis pulmonar, pues existe un fácil escape por el defecto septal. Esta
es la razón de que no haya ni cardiomegalia ni insuficiencia ventricular derecha.
FIGURA 16.- La Tetralogía de Fallot FIGURA 17.- La sangre del VD se vacía
presenta estenosis pulmonar, parcialmente en el VI a través de la CIV sin
comunicación interventricular, aorta pasar por los pulmones, produciendo
cabalgando sobre el septum e desaturación sistémica. Clínicamente se traduce
hipertrofia de ventrículo derecho. por cianosis.
VSD: ventricular septal defect (=
CIV).
El inicio de la sintomatología dependerá de dos factores: del grado de
obstrucción al flujo pulmonar y del gasto cardíaco. Si - como ocurre
habitualmente en el niño pequeño - ninguno de los dos es extremo, el
cortocircuito derecha-izquierda es moderado y la cianosis puede pasar al
principio desapercibida. Sin embargo, el aumento repentino (llanto) o progresivo
(aumento de peso) del gasto cardíaco origina la aparición repentina (crisis
hipóxica) o progresiva de desaturación arterial, produciéndose una hipoxemia
que se traducirá clínicamente por la aparición de cianosis franca.
Esto explica que no se aprecie cianosis en el momento de nacer, pero que esta
se vaya haciendo patente a medida que transcurre el primer año,
acompañándose de limitación en la tolerancia al esfuerzo.
En esta cardiopatía se producen a menudo crisis de cianosis. Denominadas
también crisis hipóxicas, estos episodios se suelen presentar a partir del cuarto o
quinto mes de edad, a veces como primera manifestación de hipoxia en un
enfermo que todavía no estaba claramente cianótico. En un episodio, la
secuencia clínica habitual es que el niño empieza a llorar y se va poniendo
progresivamente cianótico, hasta estarlo intensamente. Llama la atención la
hiperventilación que acompaña al cambio de color así como el hecho de
asociarse a una disminución de la conciencia. A veces la pierde del todo. Los
niños algo más grandes evitan estas crisis agachándose en cuclillas (posición
denominada “squatting” en la literatura anglosajona).
Las crisis cianóticas se suelen iniciar de manera repentina y progresar
rápidamente. A menudo se producen por la mañana, al despertar, con el llanto y
las rabietas, es decir: en situaciones de aumento rápido del caudal cardíaco. En
esta situación aumenta el retorno venoso y el volumen de sangre derivada
directamente al corazón izquierdo a través de la CIV, produciéndose hipoxia y
acidosis severas y desencadenándose de manera refleja una hiperventilación
compensadora que aumenta todavía más el retorno venoso y el cortocircuito
derecha-izquierda, cerrándose así el círculo vicioso.
La crisis cianótica representa siempre una urgencia vital y es una indicación de
no demorar la corrección quirúrgica. El tratamiento de la crisis consiste en
sedar (morfina 0,2 mg/kg sc o im), hacerle adoptar la posición genupectoral y
administrar oxígeno. También se han utilizado betabloqueantes.
En la exploración del paciente con tetralogía de Fallot se aprecia cianosis de
grado variable y en –el niño más grande- acropaquias. Es típica la auscultación
en el área pulmonar de un soplo de eyección que es más corto cuanto más
importante es la estenosis y que desaparece completamente durante la crisis
hipoxica severa. La radiografía de tórax muestra un corazón de volumen normal
y de morfología típica en zueco (punta elevada y arco pulmonar excavado). Se
aprecia también una disminución de la vascularitzación pulmonar (oligohemia
pulmonar). El ECG muestra hipertrofia ventricular derecha moderada. El
ecocardiograma-Doppler confirmará el diagnóstico (hipoplasia pulmonar y
aorta cabalgando sobre un amplio defecto septal ventricular).
El tratamiento de la tetralogia de Fallot es quirúrgico y puede ser paliativo
(creación de una fístula sistémico-pulmonar denominada fístula de Blalock-
Taussig) o reparador (corregir la obstrucción al flujo pulmonar y cerrar la CIV
con un parche de material sintético). A ser posible se efectúa directamente la
reparación. Cuando se presentan síntomas de hipoxia grave el tratamiento se
llevará a término enseguida. En los demás casos se efectuará de forma electiva:
entre los 6 meses y los 2 años de edad.
En los niños con tetralogía de Fallot se tendrá que efectuar profilaxis antibiótica
cuando se presenten situaciones de riesgo de endocarditis bacteriana. (inicio)
D-TRANSPOSICIÓN DE LOS GRANDES VASOS (o d-transposición de las
grandes arterias) (D-TGA)
Inglés: Transposition of the Great Arteries)
Consiste en la inversión de la relación anatómica entre las grandes arterias del
corazón y los ventrículos. La aorta nace del ventrículo derecho y la pulmonar del
ventrículo izquierdo.
FIGURA 20.- Dos circulaciones
en paralelo (1) VD - Aorta -
FIGURA 18.-
FIGURA 19.- Esquema Circ.sistémica - Ret. venoso -
Anatomía de la D-
fisiopatológico Auríc. der - VD (2) VI - AP -
TGA
Venas P - Auric. iz - VI. Unidas
por el foramen oval y el ductus
Se producen dos circulaciones paralelas (pulmonar y sistémica) sin más mezcla
de sangre entre ellas que la que permite un foramen oval permeable y la
presencia de eventuales comunicaciones asociadas (PCA, CIA o CIV). La
consecuencia será una mala oxigenación a nivel sistémico y un hiperaflujo
sanguíneo pulmonar, puesto que el circuito menor es el de menor presión y la
sangre tiene tendencia a acumularse en él. Como pasa en prácticamente todas
las malformaciones cardíacas, también existe hoy en día un tratamiento eficaz
para esta cardiopatía .
Se produce cianosis grave al nacer y se presenta muy pronto insuficiencia
cardíaca. La radiografía muestra hiperaflujo pulmonar y cardiomegalia, con
morfología ovoide de la silueta cardíaca. El hiperaflujo pulmonar está producido
por el cortocircuito izquierda derecha que acompaña a menudo a la
transposición vascular, condicionado por la existencia de un ductus persistente,
una CIV o una CIA. Pese a la administración de oxígeno a dosis altas (FiO2 del
100%) no se consigue elevar significativamente la PaO2 y la saturación
d’oxígeno de la hemoglobina (prueba de la hiperoxia). Cuando nos encontramos
en esta situación tendremos que sospechar de inmediato que estamos delante
de una transposición de los granos vasos, situación crítica que requiere un
tratamiento inmediato. En ocasiones éste diagnóstico ya se ha realizado
previamente, en el curso de una ecocardiografia fetal.
El tratamiento empieza ya en el área neonatal, instaurando una perfusión
contínua de prostaglandina E (Alprostadil®), la cual permite mantener abierto y
permeable el ductus arterioso de Botal tras el nacimiento, aumentando así la
cantidad de sangre que se oxigena en los pulmones. Si no hay comunicaciones
asociadas que permitan aumentar este flujo (CIV, CIA) tendrá que efectuarse
una atrioseptostomía de Rashkind.
En esta maniobra, un catéter especial
que lleva un balón en el extremo se
introduce , desde la aurícula derecha a
la aurícula izquierda a través del
foramen oval. Una vez en la aurícula
hinchamos el balón y tiramos
bruscamente del catèter arrastrando
con fuerza el balon a través del
foramen oval desde una a otra aurícula
hasta lograr ampliar el orificio. Con ello
destruimos parcialmente el septum,
permitiendo así un flujo interauricular
más abundante.
Unos días más tarde se efectuará la
reparación anatómica de la
transposición (procedimiento descrito e iniciado por Jatene el año 1973).
Consiste en reimplantar los vasos en el ventrículo correspondiente. Esta
intervención tiene que efectuarse dentro de los primeros 14 días después del
nacimiento, antes de que involucione el ventrículo izquierdo y acabe por perder
su capacidad para soportar presiones elevadas. Este proceso de debilitamiento
se produce con rapidez y de forma espontánea a medida que - tras el nacimiento
- descienden las presiones pulmonares.
De no ser posible la reparación anatómica se efectuará lo que se conoce como
corrección fisiológica (técnicas de Mustard o de Senning). En ella se desvian
los flujos auriculares entrecruzándolos, de forma que el retorno venoso sistémico
se dirija hacia el ventrículo izquierdo y el flujo venoso pulmonar hacia la aurícula
derecha.
Al igual que en el caso de las otras cardiopatías congénitas (con la excepción
sólo del ductus ya operado y de la CIA) tendremos que hacer prevención de la
endocarditis bacteriana ante de situaciones de riesgo. (inicio)
CARDIOPATIAS OBSTRUCTIVAS DE SALIDA DE VENTRÍCULO
DERECHO O IZQUIERDO
En general presentan clínica similar a la del adulto y ya se trataron el curso
pasado. Pero hace falta remarcar la diversa evolución y el diferente tratamiento
de dos de estas cardiopatias:
ESTENOSIS CONGÉNITA DE LA VÁLVULA AÓRTICA:
Se manifiesta desde el nacimiento por un soplo sistólico en foco aórtico, intenso
y eyectivo, precedido de un clic de eyección y acompañado de frémito. Es una
cardiopatia poco sintomática en la infancia a menos que la estenosis sea
importante. Cuando el gradiente es elevado el niño presenta fatiga de esfuerzo
y - ocasionalmente - dolor precordial. La radiografía de tórax muestra pocas
alteraciones. El ECG manifiesta en las derivaciones precordiales izquierdas, en
estas estenosis importantes, signos de hipertrofia ventricular izquierda con
sobrecarga de presión: voltajes elevados del QRS y alteraciones en la
repolarización.
Resulta característica la tendencia a empeorar, pasando con la edad a grados
más intensos de estenosis. Hará falta por lo tanto hacer controles seriados por
ecocardiografia y medir el grado de estenosis por Doppler, con objeto de
detectar este empeoramiento. El Doppler permite averiguar la aceleración de la
velocidad del flujo sanguíneo al pasar por la zona estenosada, calculando el
gradiente de presiones entre ventrículo izquierdo y aorta ascendente. El
resultado de este gradiente se da en mmHg y sirve para seguir la evolución de la
estenosis.
También conviene saber que la dilatación por válvuloplastia - que en la
estenosis de la válvula pulmonar es muy eficaz e incluso es el tratamiento de
elección - suele ser muy poco eficaz en la estenosis aórtica. Sólo se lleva a
término en niños pequeños como tratamiento paliativo con la finalidad de
retrasar - si es posible - la sustitución valvular y poder efectuarla al final del
proceso de crecimiento.
El tratamiento definitivo consiste en sustituir la válvula estenótica por una
prótesis valvular. Pero esto no se suele efectuar hasta que el tamaño de la
válvula es ya similar a la de el adulto, permitiendo una sustitución definitiva. Es
decir, en la adolescencia. Mientras tanto hará falta evitar el ejercicio físico,
especialmente el competitivo, y se pueden administrar vasodilatadores
sistémicos para disminuir la postcarga y facilitar la función del ventrículo
izquierdo. También hace falta vigilar las posibles complicaciones: endocarditis
bacteriana (¡es necesario hacer profilaxis!), cuadros sincopales, arrítmias...
Una complicación fatal y no infrecuente de las formas más severas es la muerte
súbita. Por este motivo es importantísimo no llegar a estos grados de estenosis.
ESTENOSIS CONGÉNITA DE LA VÁLVULA PULMONAR:
Suele ser poco sintomática y bastante bien tolerada. Se manifiesta al nacer por
un soplo eyectivo de características patológicas localizado en foco pulmonar. Se
suele auscultar un clic de eyección y el segundo tono cardíaco suele estar
desdoblado, aunque varía el grado de desdoblamiento con la respiración. El
ECG muestra hipertrofia ventricular derecha con sobrecarga de presión. A
diferencia de la estenosis aórtica, la estenosis pulmonar no tiene tanta tendencia
a progresar, especialmente tras el año de edad, aunque también lo puede hacer.
Cuando el gradiente transvalvular de presión supera los 40 mmHg se indica la
práctica de una válvuloplastia (dilatando con balón el anillo valvular), que suele
ser muy eficaz y se considera el tratamiento adecuado de la cardiopatía, sin que
se tenga que recurrir a la cirugía y corrigiendo suficientemente la estenosis para
permitir un régimen de vida y de actividad física normal. A veces hace falta
repetir este procedimiento al cabo de un tiempo.
Es necesario prevenir la endocarditis bacteriana en caso de maniobras con
riesgo de bacteriemia.
COARTACIÓN DE AORTA:
Es una estenosis de la aorta descendente que se localiza distalmente a la salida
de la arteria subclavia izquierda. A menudo se asocia a la existencia de una
válvula aórtica bicúspide (Fig.21).
FIGURA 21 FIGURA 22
Distinguimos dos grupos de coartación aórtica:
1. La forma preductal o infantil, asociada a hipoplasia del arco aortico y otras
anomalías cardíacas. En estos casos existe siempre un conducto arterioso
persistente con flujo de derecha a izquierda (Fig.22). El momento de nacer
representa un fuerte desafío para la circulación aórtica y el neonato se agrava y
acaba cayendo en insuficiencia cardíaca a los pocos días de edad.
2. La forma postductal o tipo adulto, en la cual no hay otras anomalías
cardíacas asociadas y el ductus está cerrado o es pequeño.
En el momento de nacer ya se ha constituido una circulación colateral suficiente
para compensar parcialmente la interrupción aórtica, evitando que la
sintomatología se inicie tan pronto como en las formas preductales.
Clínica: La forma preductal da a menudo insuficiencia cardíaca en el periodo
neonatal, presentándose como una urgencia vital. Los demás casos se
manifiestan más tarde por la presencia de un soplo cardíaco de eyección que se
ausculta en los focos de la base (pulmonar y aórtico) y en el espacio
interescapular.
La clave del diagnóstico la da la ausencia (o disminución) y retraso del pulso
femoral respecto del braquial, y la existencia de hipertensión arterial en las
extremidades superiores. Más allá de la edad neonatal, los enfermos se pueden
quejar de cansancio en las piernas o presentar cefaleas o epistaxis, pero a
menudo las manifestaciones clínicas son escasas.
Evolución: También los casos de diagnóstico más tardío son tributarios de
tratamiento quirúrgico a la mayor brevedad posible, evitando así las
complicaciones que una hipertensión arterial sistémica mantenida puede
producir (accidentes cerebrales, etc.) y evitando también que dicha hipertensión
se pueda hacer permanente.
El tratamiento quirúrgico consiste en una resección de la zona coartada del
vaso y una anastomosis término-terminal. La intervención comporta riesgo
importante en las coartaciones preductales, pero la mortalidad operatoria es
mínima en las postductales. En caso de recidivas (recoartaciones) se evita una
nueva intervención quirúrgica y se efectúa dilatación de la zona recoartada con
balón (angioplastia). Este procedimiento no está indicado en el caso de
coartaciones nativas (originarias).
También convendrá efectuar prevención de la endocarditis bacteriana.
[Volver al inicio]
Copyright © 2007 - Universitat de Lleida
Actualització novembre de 2007
Correo Dr. J. Vidal-Bota
También podría gustarte
- Recetario JUGOSDocumento11 páginasRecetario JUGOSJessilorePiña100% (3)
- Cardiopatías Congénitas: Causas, Tipos y TratamientoDocumento84 páginasCardiopatías Congénitas: Causas, Tipos y TratamientoJOEL ANDY MITE CATAGUAAún no hay calificaciones
- ACV Accidente Cerebrovascular: Guía de actividades con ejercicios y desafíos mentalesDe EverandACV Accidente Cerebrovascular: Guía de actividades con ejercicios y desafíos mentalesAún no hay calificaciones
- Conceptos Y Estrategias En Terapia RespiratoriaDe EverandConceptos Y Estrategias En Terapia RespiratoriaCalificación: 4 de 5 estrellas4/5 (1)
- Drenaje Venoso PDFDocumento9 páginasDrenaje Venoso PDFLucia VillacrizAún no hay calificaciones
- Cardio PedriatriaDocumento64 páginasCardio PedriatriaMedicina Fisica Rehabilitacion IntegralAún no hay calificaciones
- Manual para la prevención de la enfermedad coronaria: Consejos para mejorar la calidad de vidaDe EverandManual para la prevención de la enfermedad coronaria: Consejos para mejorar la calidad de vidaAún no hay calificaciones
- Revista Computer Hoy 15 AgostoDocumento68 páginasRevista Computer Hoy 15 AgostoFrancisco Raul OsoAún no hay calificaciones
- Cardiopatias Congénitas No CianoticasDocumento80 páginasCardiopatias Congénitas No CianoticasDiego Antonio Quezada ㋑100% (8)
- Sindromes Cardiologicos PediatricosDocumento18 páginasSindromes Cardiologicos Pediatricosjimmy SaavedraAún no hay calificaciones
- Cardiopatías Congénitas 2020Documento50 páginasCardiopatías Congénitas 2020Angy Ojeda100% (1)
- Estructura y Mecanismos de Las Enzimas. Cofactores y Coenzimas. Función Biológica y Control de La Actividad.Documento6 páginasEstructura y Mecanismos de Las Enzimas. Cofactores y Coenzimas. Función Biológica y Control de La Actividad.Marina100% (1)
- Fernando Holguín Quiñones: (Aplicada A Las Ciencias Sociales)Documento401 páginasFernando Holguín Quiñones: (Aplicada A Las Ciencias Sociales)Raul Fernandez FrancoAún no hay calificaciones
- Foramen Oval PulmonarDocumento14 páginasForamen Oval Pulmonarjviva1Aún no hay calificaciones
- Cardiopatias As en El AdultoDocumento50 páginasCardiopatias As en El AdultoAdrian CenturionAún no hay calificaciones
- Unidad 7 CardiopatiasDocumento44 páginasUnidad 7 CardiopatiasCamila Verao CoelhoAún no hay calificaciones
- Cardiopatias CongenitasDocumento19 páginasCardiopatias CongenitasIsa.snotesAún no hay calificaciones
- CARDIOPATIAS CONGENITAS NO CIANOTICAS y CIANOTICASDocumento9 páginasCARDIOPATIAS CONGENITAS NO CIANOTICAS y CIANOTICASCuarentime Music - No Copyrights MusicAún no hay calificaciones
- Cardiopatias CongenitasDocumento5 páginasCardiopatias CongenitastamaradelriegoAún no hay calificaciones
- Tetralogia de FallotDocumento14 páginasTetralogia de Fallotjimenez velazquez luis alejandroAún no hay calificaciones
- Cardiopatías Congénitas.Documento12 páginasCardiopatías Congénitas.Cintia BonillaAún no hay calificaciones
- Comunicación InterventricularDocumento5 páginasComunicación InterventricularIsa.snotesAún no hay calificaciones
- PCA y Ventana AortopulmonarDocumento18 páginasPCA y Ventana AortopulmonarTania UrquiagaAún no hay calificaciones
- 6 CojinesDocumento8 páginas6 CojinesLanddy GonzalezAún no hay calificaciones
- Atresia PulmonarDocumento8 páginasAtresia PulmonarJosé Rap Garcia VelazquezAún no hay calificaciones
- 04 Cardiopatías CongénitasDocumento6 páginas04 Cardiopatías CongénitasJuan Diego MarulandaAún no hay calificaciones
- Comunicación InterauricularDocumento2 páginasComunicación InterauricularAlicia SeguraAún no hay calificaciones
- Tarea 11 - Las Alteraciones Del Corazón y Pericardio en AnimalesDocumento20 páginasTarea 11 - Las Alteraciones Del Corazón y Pericardio en AnimalesSEBASTIAN ALONSO ORTIZ MATTAAún no hay calificaciones
- Cardiopatias CongénitasDocumento17 páginasCardiopatias CongénitasVitor FloreAún no hay calificaciones
- Cia CivDocumento8 páginasCia CivcarmonaanedAún no hay calificaciones
- 2 Cardiopatias CongenitasDocumento13 páginas2 Cardiopatias CongenitasOmar LopezAún no hay calificaciones
- Resumen Cardiopatias CongenitaDocumento4 páginasResumen Cardiopatias CongenitaSaul Palomino ChullaAún no hay calificaciones
- Malformaciones CardiovascularesDocumento16 páginasMalformaciones Cardiovascularesgenesis1kasandraAún no hay calificaciones
- 497 571 PDFDocumento58 páginas497 571 PDFWerner Ta RoAún no hay calificaciones
- Transposición de Los Grandes VasosDocumento4 páginasTransposición de Los Grandes Vasosapi-543828470Aún no hay calificaciones
- CIA Lo Que Voy A DecirDocumento2 páginasCIA Lo Que Voy A DecirlilyAún no hay calificaciones
- Cardiopatias CongenitasDocumento21 páginasCardiopatias CongenitasMariana P Uicab ColoradoAún no hay calificaciones
- Cardiopatías Congénitas FinalDocumento103 páginasCardiopatías Congénitas FinalAbrahamAguilarAún no hay calificaciones
- 4 ValvulopatiasDocumento62 páginas4 ValvulopatiasKarol NarvAún no hay calificaciones
- Cardiopatías congénitas tallerDocumento4 páginasCardiopatías congénitas tallerivanvillota7510Aún no hay calificaciones
- Trabajos Autónomos NeonatologíaDocumento44 páginasTrabajos Autónomos NeonatologíaMaría de los Ángeles Cedeño ÁvilaAún no hay calificaciones
- Comunicación InterauricularDocumento3 páginasComunicación InterauricularlilyAún no hay calificaciones
- Comunicación interventricular: causas, síntomas y tratamientoDocumento5 páginasComunicación interventricular: causas, síntomas y tratamientoAnthony QuiñónezAún no hay calificaciones
- SarabhiMorales Act14M4Documento12 páginasSarabhiMorales Act14M4Suhely MoralesAún no hay calificaciones
- Cardiopatías Congénitas CorregidoDocumento4 páginasCardiopatías Congénitas CorregidoANGGIE YOHANA ALFARO PANIURAAún no hay calificaciones
- Cardiopatías Congénitas: CC Cianóticas Con Flujo Pulmonar DisminuidoDocumento4 páginasCardiopatías Congénitas: CC Cianóticas Con Flujo Pulmonar DisminuidoVale CabreraAún no hay calificaciones
- Cardiopatías CongénitasDocumento5 páginasCardiopatías CongénitasMariane GudielAún no hay calificaciones
- Dextrotransposición de Grandes VasosDocumento6 páginasDextrotransposición de Grandes VasosUn Tal Alejo TrujilloAún no hay calificaciones
- Cardiopatías congénitas: clasificación, causas y síntomasDocumento26 páginasCardiopatías congénitas: clasificación, causas y síntomasFernanda SotoAún no hay calificaciones
- Drenaje Venoso Anómalo de Venas PulmonaresDocumento25 páginasDrenaje Venoso Anómalo de Venas Pulmonaresdaniel c.0% (1)
- Cardiopatías CianógenasDocumento4 páginasCardiopatías CianógenasPedro M. De CastroAún no hay calificaciones
- Transposición de Los Grandes Vasos o Arterias Trabajo FinalDocumento5 páginasTransposición de Los Grandes Vasos o Arterias Trabajo FinalLitzy CarranzaAún no hay calificaciones
- Circulacion FetalDocumento31 páginasCirculacion Fetalacuario7850% (2)
- Cia CivDocumento4 páginasCia CivCarolina CanulAún no hay calificaciones
- PatologiaDocumento20 páginasPatologiaapi-560327902Aún no hay calificaciones
- Clasificación de Las Cardiopatías CongénitasDocumento21 páginasClasificación de Las Cardiopatías Congénitasapi-374089767% (3)
- Cardiopatía Congénita No CianóticaDocumento35 páginasCardiopatía Congénita No CianóticaSharon Aldave100% (1)
- 3 CARDIOPATIAS CONGENITAS 1Documento3 páginas3 CARDIOPATIAS CONGENITAS 1carlos colmenarezAún no hay calificaciones
- Cardiopatias CongenitasDocumento62 páginasCardiopatias CongenitasFernanda Rodríguez RazoAún no hay calificaciones
- ENFERMEDADES CARDIOVASCULARES TatyDocumento16 páginasENFERMEDADES CARDIOVASCULARES TatyDangelliAún no hay calificaciones
- CardioDocumento4 páginasCardioMARGARETH JULIETH PEÑA JARABAAún no hay calificaciones
- Neoplasias VeterinariasDocumento69 páginasNeoplasias VeterinariasJoelValleDeRossiAún no hay calificaciones
- Cardiopatías Congénitas Del AdultoDocumento37 páginasCardiopatías Congénitas Del AdultoYasser Calvo GómezAún no hay calificaciones
- Cardiopatía Tetralogía FallotDocumento4 páginasCardiopatía Tetralogía FallotJuan Carlos JimenezAún no hay calificaciones
- Actividad 4. Análisis de Video Águilas o GallinasDocumento4 páginasActividad 4. Análisis de Video Águilas o Gallinasmc22021Aún no hay calificaciones
- Defensa ribereña Huaraz-2018Documento79 páginasDefensa ribereña Huaraz-2018Niagq GutYesAún no hay calificaciones
- Recetario SaludableDocumento12 páginasRecetario Saludablejhosep santiago saavedraAún no hay calificaciones
- Vacunas Inactivas RecombinanteDocumento6 páginasVacunas Inactivas RecombinantebypikaAún no hay calificaciones
- Taller Evaluativo Áreas de Figuras PlanasDocumento1 páginaTaller Evaluativo Áreas de Figuras PlanasRodrigoAún no hay calificaciones
- Alumbramiento ManualDocumento17 páginasAlumbramiento ManualAngelita Ascarrunz AmurrioAún no hay calificaciones
- Relieves de AmericaDocumento6 páginasRelieves de AmericaRosa Isabel SánchezAún no hay calificaciones
- Filosofía medieval cristianismoDocumento3 páginasFilosofía medieval cristianismoSandra Paola Serrano AmadoAún no hay calificaciones
- Capitulo 15 Terminaciones Nivel IIDocumento39 páginasCapitulo 15 Terminaciones Nivel IIIngeniero Angeles Miranda BustamanteAún no hay calificaciones
- Todo para El Aula 2DO CICLO - ABRIL 2019Documento134 páginasTodo para El Aula 2DO CICLO - ABRIL 2019Gloria FloresAún no hay calificaciones
- La Colocación de Postes Prefabricados o Hechos A Medida de Fibra Afecta La Supervivencia de 3 Años de Premolares Tratados EndodónticamenteDocumento7 páginasLa Colocación de Postes Prefabricados o Hechos A Medida de Fibra Afecta La Supervivencia de 3 Años de Premolares Tratados EndodónticamenteDan MPAún no hay calificaciones
- Cono de ArenaDocumento17 páginasCono de ArenaABELAún no hay calificaciones
- Capitulo 3. A.A.Documento43 páginasCapitulo 3. A.A.Tatiana CastañoAún no hay calificaciones
- Tub Opera G500 RTL - RTM 101HSDocumento17 páginasTub Opera G500 RTL - RTM 101HSFrusescu LucianAún no hay calificaciones
- Inf. Pruebas Met - Arturo MusirisDocumento3 páginasInf. Pruebas Met - Arturo MusirisJeanpierre TorreblancaAún no hay calificaciones
- Alcantar - Política Del Transporte PDFDocumento6 páginasAlcantar - Política Del Transporte PDFErika AlcantarAún no hay calificaciones
- Investigación Arquitecturas Vernáculas Hallenhaus o "Casa Sajona"Documento6 páginasInvestigación Arquitecturas Vernáculas Hallenhaus o "Casa Sajona"api-583988681Aún no hay calificaciones
- Tegnologia WifiDocumento11 páginasTegnologia WifiLuis ChambaAún no hay calificaciones
- Areas de Regiones Poligonales y CircularesDocumento1 páginaAreas de Regiones Poligonales y CircularesHilde Idrogo TorresAún no hay calificaciones
- S11 s3 LABORATORIO CALIFICADO 3 GUIA DE TRABAJODocumento5 páginasS11 s3 LABORATORIO CALIFICADO 3 GUIA DE TRABAJOElizabeth AlmironAún no hay calificaciones
- Desarrollo Sustentable Ensayo Documental.Documento2 páginasDesarrollo Sustentable Ensayo Documental.Mitzi SanchezAún no hay calificaciones
- Jonson Evinrude Piezas NumerosDocumento121 páginasJonson Evinrude Piezas NumerosAnonymous qqGw19Aún no hay calificaciones
- Conteo VehicularDocumento92 páginasConteo VehicularJean Pierre MoralesAún no hay calificaciones
- Diseño de programa de cosecha para cultivos de estación fríaDocumento3 páginasDiseño de programa de cosecha para cultivos de estación fríaMaicol VizaAún no hay calificaciones
- Diabetes 1 y 2Documento35 páginasDiabetes 1 y 2Melody EsquivelAún no hay calificaciones
- Los Mandamientos Del Abogado Eduardo J CoutureDocumento61 páginasLos Mandamientos Del Abogado Eduardo J CoutureCarla Francisca Fuentes GonzalezAún no hay calificaciones