Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Equipamentos Industriais
Cargado por
Claudinei MartinsTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Equipamentos Industriais
Cargado por
Claudinei MartinsCopyright:
Formatos disponibles
1
EQUIPAMENTOS INDUSTRIAIS
INTRODUO
No vivel separar os componentes de uma fase com base na diferena de suas
propriedades mecnicas, como densidade ou tamanho, pois eles esto dispersos
molecularmente uns nos outros. O recurso criar ou introduzir uma outra fase no sistema.
Devido a diferenas de volatilidade ou solubilidade dos componentes, sua distribuio ser
diferente nas duas fases, fato que constitui a base da separao. Recai-se, finalmente numa
separao mecnica das fases.
A separao entre duas fases, mais fcil quando baseada numa propriedade fsica que
varia bastante entre os componentes a serem separados.
O equipamento usado nas operaes de transferncia de massa depende das fases a
serem processadas. Em alguns casos, as fases so repetidamente reunidas e depois
separadas medida que passam pelo equipamento. A anlise das operaes de
transferncia de massa nas quais as fases so reunidas e separadas vrias vezes
alternadamente toma como base o estgio de equilbrio O termo operaes em estgios
refere-se aos processos de separao que podem ser descritos pelo modelo de um estgio
de equilbrio.
Outros equipamentos operam, mediante o contato contnuo entre as duas fases, neste caso
a grandeza da transferncia de massa depende da taxa de transferncia e do tempo de
contato.
Os clculos bsicos necessrios para projetar o equipamento para as diversas operaes
em estgios so fundamentados em conceitos idnticos.
Quando duas fases de composio diferentes so colocadas em contato ocorre
transferncia de componentes de uma fase para outra. Quando esse contato realizado
durante um intervalo de tempo suficiente ocorre o estado de equilbrio.
Em processos de separao nos quais certos componentes so de difcil separao, h a
necessidade do estudo das diversas propriedades qumicas e fsicas dos constituintes da
mistura, afim de, avaliar qual oferece maior diferena entre os componentes e assim optar
por um mtodo de separao mais fcil e econmico. As operaes unitrias abrangem
apenas as operaes que envolvem separaes com base nas diferenas das propriedades
fsicas.
Uma unidade de equipamento onde ocorre o contato ntimo entre duas fases de maneira a
possibilitar a mxima aproximao das condies de equilbrio entre as fases denominada
estgio. Nessa etapa os componentes difusveis da mistura se distribuem entre as fases
possibilitando assim uma composio diferente da inicial.
Quando se deseja modificaes considerveis nas composies das fases a operao
realizada em vrios estgios, ou seja, mediante separaes sucessivas.
Em funo do tempo necessrio para que se atinja o equilbrio ideal (real) os equipamentos
industriais no operam nessa condio, sendo a eficincia do estgio definida pela razo
entre a modificao de composio num estgio real e a composio do estgio de
equilbrio. Mesmo que a condio de equilbrio ideal no seja atingida na maioria dos
equipamentos, um timo modelo fsico para a anlise das operaes em estgios.
As eficincias de estgio dependem da taxa de transferncia de massa, e do tempo de
contato e da rea de contato num nico estgio. As caractersticas do equipamento
dependem do nmero de estgios de equilbrio e da eficincia de estgio.
Alguns equipamentos operam com apenas um estgio, porm, mais usualmente empregam-
se unidades em vrios estgios com escoamento em contracorrente entre as duas fases.
O equipamento de separao ou mistura depende das caractersticas fsicas das fases. Os
gases e os lquidos escoam com facilidade de um estgio para o outro j, um slido de
difcil escoamento, por esse motivo usual operar com slidos pulverizados, os quais
podem escoar como fluido, sendo mecanicamente transportado de um estgio para outro.
Contato gs-lquido
2
No caso da separao entre um gs e um lquido, a diferena de densidade entre as fases
torna a separao relativamente fcil. As duas fases podem ser misturadas mediante
borbulhamento ascendente do gs no lquido, formando uma fase gasosa contnua quando
atingem a superfcie do lquido. Dessa forma os estgios so construdos em coluna vertical
de modo que o lquido flua por gravidade na descendente e o gs de maneira ascendente
em virtude da diferena de presso mantida por um refervedor ou por um compressor ou
ainda por um soprador. Esses estgios reais nesses equipamentos so denominados pratos
ou bandejas.
Esquema de uma coluna de destilao simples com uma alimentao, condensador total e refervedor parcial.
(Fonte: Marangoni, 2005)
Pratos com borbulhadores
O borbulhador projetado de modo a dispersar a fase gasosa em bolhas finas no seio do
lquido e impedir que este desa pelas passagens do gs quando esse flui com baixa
velocidade.
Borbulhador desmontado
O gs flui atravs do duto ascendente e passa pela
campnula saindo pelas fendas verticais
dispersando-se na fase lquida
3
Prato com borbulhadores
:
Borbulhador expandido
Borbulhador montado
Prato com vlvulas
Em altas velocidades do vapor, a vlvula totalmente aberta e, quando ocorre a diminuio da
velocidade do vapor, a vlvula parcialmente ou totalmente fechada. As vlvulas proporcionam boa
mistura entre o lquido e o vapor e podem operar com fluxos muitos
pequenos (BARROS et al., 1994).
Prato com borbulhadores e fluxo cruzado.
Os vertedores-metlicos, ao longo dos lados direito e esquerdo do prato, mantm o lquido
num nvel suficientemente alto para cobrir as fendas nas campnulas dos borbulhadores.
(a)
(b)
4
(c)
Esquemas do escoamento e direo do fluxo dos fludos em pratos e nas colunas de destilao.
Fonte:
http://www.poli.usp.br/p/luiz.terron/destilacao/2_paginas_equipamentos/2_2_distilacao_colun
as_internas.htm
Os pratos perfurados em virtude de sua
simplicidade e baixo custo vem se tornando muito
populares.
A bandeja perfurada uma chapa metlica que
contm centenas de orifcios circulares de
dimetro usualmente entre 1/8 e 1/2 polegada
Quando a velocidade do gs grande as bolhas
atravessam o lquido e formam um obstculo ao
escoamento do lquido. J quando a velocidade do
gs baixa o escoamento do lquido torna-se um
obstcula a passagem do gs. Este vazamento
pode reduzir em muito a eficincia do estgio.
Os pratos mais modernos possuem perfuraes em uma bandeja
valvulada, contando com oprculos mveis sobre as perfuraes
os quais so levantados pelo gs quando este flui para cima e
abaixam-se sobre o orifcio em velocidades baixas.
O escoamento de lquido sobre o prato deve proporcionar uma
profundidade suficiente para a cobertura adequada dos canais de
gs, em todas as velocidades do gs.. A profundidade do lquido
est governada pela taxa de escoamento do lquido e pela altura
do vertedor de sada. A queda de presso na fase gasosa
depende tambm da altura do lquido sobre os canais do gs. O
arraste transporte de um prato para o superior, de gotculas de
lquido pela fase gasosa. Este transporte indesejvel pois
abaixa efetivamente a eficincia de estgio. O arraste ocorre em
velocidades elevadas de escoamento.
Embora a formao de espuma num prato proporcione maior rea
superficial de contato gs-Iquido e por isso taxas de transferncia
de massa mais elevadas, o espumejamento excessivo encher
com a espuma o espao entre os pratos e acarretar um arraste
muito grande.
A inundao da coluna ocorre quando h um arraste excessivo ou
quando h acmulo demasiado de lquido no vertedor
descendente. A inundao o resultado de se tentar fazer passar
ou muito gs ou muito lquido atravs da coluna. Um ponto
fundamental ao se escolher o dimetro da coluna o de evitar a
inundao.
Contato Iquido-lquido
A separao dos constituintes misturados num lquido, atravs de um tratamento com
um determinado solvente, no qual um ou mais dos componentes misturados se dissolvem
preferencialmente, chama-se extrao lquido-lquido
5
Numa extrao por solvente, dois lquidos imiscveis devem ser intimamente misturados e
depois separados. No contato lquido-gs, a grande diferena entre as fases possibilita o uso
da gravidade para promover o escoamento e dispersar o gs no lquido; na extrao, a
diferena entre as fases dos dois lquidos pequena, de modo que a gravidade menos
eficiente para a disperso das fases. No se usam bandejas com borbulhadores ou
bandejas valvuladas para a extrao lquido-lquido, pois o escoamento induzido pela
gravidade no acarreta uma disperso adequada das fases. A fase mais leve que ascende
pela bandeja no suficientemente dividida em gotculas ao passar pelos borbulhadores ou
pelos orifcios valvulados.
As bandejas perfuradas, com vertedores descendentes, so bastante usadas para o contato
lquido-lquido, embora a construo da coluna seja diferente da destinada ao contato gs-
Iquido. Qualquer das duas fases, a do lquido leve ou a do pesado, pode ser dispersa. Para
se ter uma boa disperso na bandeja perfurada, o lquido que no molha a bandeja deve ser
o disperso. O lquido que molha preferencialmente a bandeja deve ser a fase contnua.
Desta forma, a fase dispersa liberta-se com rapidez da bandeja e forma pequenas gotas.
Uma coluna tpica, com a fase leve dispersada, . Esta coluna tem a aparncia de uma
coluna de bandeja perfurada para o contato gs-Iquido, e o lquido leve faz papel anlogo
ao do gs. A coluna em que a fase pesada est dispersa basicamente uma coluna de fase
leve dispersada, porm invertida. Os vertedores, nesta coluna, passam o lquido leve para
cima, e a fase pesada dispersada embaixo de cada bandeja.
A taxa de escoamento total da fase dispersa determina o nmero de orifcios em cada
bandeja e a altura do lquido na bandeja determinada pela presso necessrio, para que
haja a taxa de escoamento desejado atravs das perfuraes, permitindo assim uma boa
disperso. A rea do vertedor da fase contnua determinada de maneira a se ter uma
velocidade suficientemente baixa no permitindo o arraste das gotculas da fase dispersa
pelo vertedor.
Afim de se obter uma maior disperso entre as fases pode-se empregar misturadores
mecnicos que podem proporcionar uma taxa de eficinica de estgio entre 90 e 100%.
Aps as misturas as fases so separadas em um tanque de decantao. Os misturadores-
decantadores podem ser utilizados em srie afim de se ter separao em vrios estgios.
Deve-se tomar o cuidado para que a misturao no seja excessivamente energtica a
ponto que forme emulso.
6
Em casos em que a diferena de densidade entre as fases for muito pequena pode-se
empregar centrfugas.
O arranjo vertical dos estagios permite o escoamente gravitacional, porm em alguns caso
so muito grandes. A disposio horizontal requer bombeamento o que somado aos
tamques de sedimentao separados eleva o custo em comparao ao uso de bandejas
perfuradas.
Contato slido-fluido
O maior problema empregado para se obter o contato entre slido granulado e fluido em
sistemas de vrios estgios de maneira contnua o transporte dos slidos de um estgio
para outro. Esse transporte pode ser feito atravs de cestos e o contato realizado em
contra corrente apenas na metade do sistema.
Extrator de Bollman Usado por exemplo na extrao de
leo de soja. As sementes esmagadas so alimentadas nos
cestos perfurados que giram acoplados a uma correia
contnua. O solvente virgem alimentado de um lado do
extrator (a esquerda) em um ponto intermedirio, escoando
em contra-corrente o qual ao atingir a base recirculado
para o lado oposto onde escoa em fluxo paralelo e ao atingir
a base retirado como extrato final que filtrado.
7
Um slido finamente dividido, em condies apropriadas pode escoar como um fluido com o
auxilio de um gs ou de um lquido proporcionando assim o contato entre as fases. Para
trabalhos em grande escala empregam-se espessadores contnuos nos quais o slido passa
de estgio para estgio na forma de lama aquosa.
Relaes Entre Fases
A separao de misturas multicompostas depende da teoria fsico-qumica, das questes
econmicas e da viabilidade operacional, sendo o dimensionamento da unidade ditado pelas
limitaes do equilbrio e da taxa de transferncia. Para tanto, deve se considerar a
influncia da temperatura e da presso nas relaes de equilbrio.
Fundamentos do equilbrio de fases
Segundo Gibbs o equilbrio entre as fases exige a igualdade de todos os potencias incluindo
no s presso e temperatura mas tambm os potenciais qumicos, , de cada componente
de cada fase, que exprime a tendncia do componente de abandonar a fase, ou estado
qumico. Estudos posteriores demonstraram que o coeficiente qumico poderia ser
substitudo pela fugacidade (f).
1
=
1
=
1
como,
1
= RT ln f
i
+
Tem-se que: f
1
= f
1
= f
1
A fugacidade tem diversas vantagens sobre o potencial qumico, no sendo a menor a de
que, pelo menos em princpio, pode ser relacionada com facilidade a grandezas fsicas
mensurveis.
Quando o nmero de variveis, num sistema de diversos componentes com equilbrio entre
vrias fases, relacionado ao nmero de equaes entre elas, conforme o esquema
anterior, o resultado a regra das fases de Gibbs,
F = C+ 2 - p
onde F = nmero de variveis intensivas que podem ser alteradas independentemente (a
varincia do sistema)
C = nmero de componentes do sistema
p = nmero de fases no sistema
Define-se fase como uma parte fisicamente definida e homognea do sistema, quer seja
slida, lquida ou gasosa.
Uma varivel intensiva independente da massa total da fase.
A regra das fases til para prever o nmero d variveis intensivas que podem ser variadas
de maneira independente, em qualquer sistema.
Por exemplo, para o equilbrio lquido vapor etanol e gua
C=2
P= 2
Assim pela equao F = 2, sendo possvel variar independentemente duas variveis entre a
temperatura, presso e a concentrao.
J para o equilbrio lquido vapor da gua pura temos
C = 1
P = 2
Assim F = 1, dessa forma s uma varivel pode ser alterada independentemente das outras.
Os clculos da destilao e da absoro de gs requerem o conhecimento do equilbrio gs-
Iquido. Assim, a igualdade entre as fugacidades fica:
onde funo da tenperatura
e f
i
aproxima-se de p
i
quando p
i
aproxima-se se zero
8
f
aL
= p
a
x
a
a
f
aG
= t
aL
A fugacidade da fase gasosa poderia ser substituda pela presso parcial do gs (p
a
= y
a
p),
na presso de interesse, caso o comportamento seja ideal em presso muito baixa.
conveniente introduzir um fator corretivo, o coeficiente de fugacidade ( f / p)
a
para relacionar
o comportamento real do gs ao seu comportamento ideal. Ento:
onde: f = fugacidade de a
p = presso total no sistema
y
a
= frao molar de a no vapor
Considerando que a frao molar relaciona a fugacidade do componente puro fugacidade
do componente numa mistura de lquidos "ideais", e definindo o coeficiente de atividade
a
como a razo entre a fugacidade de a numa soluo real e a fugacidade de a numa soluo
ideal, a
fugacidade do lquido :
onde: p
a
= presso de vapor de a na temperatura de equilbrio
x
a
= frao molar de a no lquido
Assim:
O
possvel relacionar o coeficiente de fugacidade (f/P)., e o coeficiente de atividade , s
propriedades moleculares fundamentais no caso de componentes simples, no associados,
quando as no-idealidades da fase lquida podem ser ignoradas Existem equaes de
estado bastante exatas, de modo que este clculo se faz com muita propriedade. Uma
vantagem particu- lar da resultante a de que O equilbrio lquido-vapor pode ser expresso
analiticamente e transcrito para programas de computador.
Quando ocorrem no-idealidades na fase lquida preciso determinar o coeficiente de
atividade a partir de informaes sobre o campo de foras intermoleculares ou correlacionar
empiricamente os dados experimentais. As duas abordagens so usadas. Zellner
apresentou uma abordagem combinada, que conveniente a baixas temperaturas.
Quando a fase gasosa comporta-se como um gs ideal, (f/P)
a
.=1, e se a fase lquida for uma
soluo ideal, y
a
=1. Neste caso a lei de Raoult (presso parcial de cada componente em
uma soluo ideal dependente da presso de vapor dos componentes individuais e da
frao molar dos mesmos componentes) aparece:
P y
a
= P
a
x
a
Estas equaes mostram que o vapor proveniente de uma mistura lquida ser uma mistura
dos mesmos componentes que o lquido. O vapor ser, em geral, mais rico (relativamente)
no componente que tenha a presso de vapor mais elevada na temperatura da vaporizao.
A lei de Raoult s exata para o equilbrio vapor-Iquido de uma soluo ideal em equilbrio
com uma mistura gasosa ideal. As solues que mostram desvios desprezveis em relao
idealidade incluem componentes que tm estruturas e propriedades fsicas semelhantes,
como, por exemplo. as de benzeno e tolueno, de propano e butano, de metanol e etanol. A
lei de Raoult mostra que , as composies numa mistura em equilbrio dependem da
presso total do sistema e das presses de vapor dos componentes.
, muitas vezes, conveniente exprimir o equilbrio de fase pela relao,
f
aG
= f p y
a
p
a
f p y
a
= p
a
x
a
a
p
a
9
V
a
= K
a
x
a
Onde: K uma constante experimentalmente determinada.
Este parmetro K. , em muitos casos, fracamente dependente da concentrao, mesmo em
sistemas que no obedecem lei de Raoult; denominado a "constante ideal de
vaporizao" ou o "valor K".
Em muitos sistemas, a presso de vapor do soluto, numa soluo muito diluda, pode ser
usada como se tivssemos uma formulao da lei de Raoult onde ela fizesse o papel de
uma constante sobre uma faixa significativa de concentraes. Esta a base da lei de
Henry, que se escreve mais habitualmente como
P
a
=H c
a
onde P = presso parcial de a no vapor
H = constante de Henry, medida experimentalmente
c = concentrao de a no lquido
Num sistema binrio, o componente com a presso de vapor mais elevada, numa dada
temperatura, o "componente mais voltil", enquanto o que tem a menor presso de vapor
o "componente menos voltil". Por uma conveno habitual, a composio de uma mistura
binria ser expressa em termos da concentrao do componente mais voltil.
No caso de sistemas binrios, onde a o componente mais voltil e b o menos voltil,
admitindo-se vlida a lei de Raoult,
Como a volatilidade relativa () a relao entre as constantes de equilbrio de dois
componentes.
Sendo que uma constante de equilbrio expressa a relao entre a concentrao de
um componente no vapor e o mesmo componente no lquido em ebulio no
equilbrio.
p
a
= y
a
x
a
Assim, tendo-se uma mistura de um componente a e um outro componente b temos:
y
a
p
a
= x
a
= y
a
. x
b
p
b
y
b
x
a
y
b
y
a
Desta forma, a volatilidade relativa entre os componentes do componente a em relao ao b
pode ser expressa por:
Sabendo-se que y
b
= 1 y
a
e x
b
= 1 - x
a
Podemos escrever a equao em relao ao componente mais voltil
Y
a
x
b
= P
a
=
ab
X
a
y
b
P
b
Y
a
1 - x
a
= P
a
=
ab
X
a
1 y
a
P
b
10
Para sistemas que no seguem a lei de Raoult, a volatilidade relativa definida como:
Onde: K uma constante experimentalmente determinada.
Exemplo
Uma mistura de butano e pentano est em equilbrio na presso de 300 kN/m
2
e a 40C.
Calcular as composies do lquido e do vapor usando:
(a) a lei de Raoult;
(b) os valores experimentais de K.
A presso total do sistema 300 kN/m
2
Pela tabela de presso de vapor
31,0Presso de vapor do butano a 40
o
C = 373 k N/ m
2
Presso de vapor do pentano a 40
o
C = 117 k N/ m
2
a) Como:
P y
a
= P
a
X
a
Como x = 1, para a mistura bicomponente y
B
+ y
P
= 1, e x
B
+ x
P
= 1
Assim, x
p
= 1 x
B
ento:
1,24 x
B
+ 0,39 (1 x
B
) = 1
Assim:
x
B
= 0,72 y
B
= 0,89
x
P
= 0,28 y
P
= 0,11
b) Pelos valores experimentais de k
a 300 kN/m
2
e 40
o
C
k
B
= 1,2 e k
P
= 0,38
Como, Y
a
= k
a
. x
a
1,2 x
B
+ 0,38 (1 x
B
) = 1
x
B
= 0,76 y
B
= 0,91
x
P
= 0,24 y
P
= 0,09
a.b
= K
a
K
b
y
p
= P
p
x
p
y
p
= 117 x
p
y
p
= 0,39 x
p
P 300
y
B
= P
B
x
B
y
B
= 373 x
B
y
B
= 1,24 x
B
P 300
11
12
Constantes de equilbrio lquido-vapor para hidrocarbonetos
K =a + b ( t/100) + c (t/100)
2
+ d (t/100)
3
conde t est em
o
F
Composto Presso (psia) a b c d
CH
4
50 32,7500 4,9583 8,0000 -1,8333
100 17,9500 4,6583 2,4000 -0,6333
150 9,4500 11,6083 -4,2000 0,7667
250 6,5500 4,9583 -1,0000 0,1667
C
2
H
4
50 5,9250 6,9375 2,5000 -0,5500
100 3,2000 3,7667 1,4000 -0,2667
150 1,7250 4,2542 -0,5000 0,1833
250 1,4000 1,8200 0,3800 -0,0400
C
2
H
6
50 2,3250 7,6242 -0,5400 0,2233
100 2,2500 1,7850 1,2800 -0,1800
150 0,7450 3,7442 -0,8600 0,2233
250 0,9300 0,9883 0,6000 -0,1133
C
3
H
6
50 -0,9500 7,7083 -3,8000 1,1667
100 0,2750 1,5442 0,2800 0,0233
150 0,4300 0,3917 0,7000 -0,0867
250 1,3950 -3,1775 -3,1400 -0,6500
C
3
H
8
50 1,6000 -0,9983 3,0600 -0,5267
100 0,3700 0,9417 0,5800 -0,0467
150 0,3125 0,4771 0,5700 -0,0683
250 0,675 0,7146 0,0700 0,0217
iC
4
H
10
50 -0,1300 1,5750 -0,1200 0,1800
100 0,2575 -0,0724 0,6540 -0,0623
150 0,0825 0,2574 0,2460 0,0023
250 0,1300 -0,0233 0,3000 -0,0267
nC
4
H
10
50 0.0375 0,6479 0,2900 0.0883
100 0,0075 0,4346 0.0900 0,0617
150 0.0100 0.3170 0,0560 0,0440
250 0.1000 -0,0725 0.2800 -0.0300
iC
5
H
12
50 -0,0425 0,3846 0.0100 0.1017
100 0.0450 0.0228 0,1560 0,0207
150 0.1305 -0,2953 0,3820 -0,0510
250 10.0588 -0,0957 0,1590 -0.0092
nC
5
H
12
50 0,0050 0,1815 0,0820 0,0780
100 -0.0025 0,1099 0,0660 0.0323
150 0.0135 0,0431 0,0664 0,0206
250 -0.0140 0,1065 -0.0136 0.0269
nC
6
H
14
50 -0.0275 0,1458 -0.0620 0.0730
100 -0,0400 0.1567 -0.0820 0,0493
150 0,0005 0.0259 0.0084 0.0213
250 0.0005 0,0176 0.0094 0,0126
nC
7
H
16
50 0.0108 -0,0090 0,0086 0,0312
100 -0.0250 0,0898 -0.0640 0.0327
150 -0,0089 0.0378 -0.0245 0,0189
250 0,0000 0,0080 -0.0014 0,0094
nC
8
H
18
50 -0.0038 0.0260 -0.0330 0.0278
100 -0.0198 0,0704 0,0614 0.0256
150 -0.0119 0.0440 -0.0387 0.0175
250 -0.0055 0.0228 -0.0200 0.0105
Constantes de equilbrio na vaporizao de hidrocarbonetos
13
14
y
A
= P
a
x
A
P
Exerccio
Determine a volatilidade relativa do butano em relao ao pentano, a 40
o
C e 465 psi e
verifique se a essa presso a lei de Raoult vlida.
Diferentemente de um lquido puro, a temperatura em que uma soluo lquida vaporiza no
constante a uma dada presso. A temperatura na qual se inicia a vaporizao de um
soluo de composio determinao denominada ponto de bolha. J a temperatura na
qual se inicia a condensao de um vapor num processo de resfriamento denominada
ponto de orvalho. Para um lquido puro o ponto de bolha e o ponto de orvalho coincidem
com o ponto de ebulio.
Para solues ideais os pontos de bolha e de orvalho podem ser calculados pela lei de
Raoult. No caso de outras misturas deve-se utilizar os valores de k.
Exerccio
Calcular o ponto de orvalho de uma mistura gasosa que contm 20% molares de benzeno,
30% molares de tolueno e 50% molares de ortoxileno, a 100 kN/m
2
.
Para presses baixas e componentes semelhantes pode-se empregar a lei de Raoult. Como
as presses de vapor dependem da temperatura pode-se aplicar um procedimento de
tentativas, pois as presses de vapor no podem ser expressas com funes simples da
temperatura.
empregando a relao
determina-se os valores de X em ralao a presso parcial.
15
Atravs da tabela de presso de vapor em relao a temperatura, adotando uma
temperatura determina-se as presses de vapor.
Como, na temperatura correta x
B
+ x
T
+ x
x
= 1, verifica-se a relao.
Caso a relao no esteja correta, tenta-se outra temperatura e repete-se o procedimento.
Os clculos de equilbrio de fases, podem ser efetuados com facilidade num computador
digital. No entanto, a expresso do equilbrio de fase tem que aparecer sob forma analtica.
Quando se pode empregar a lei de Raoult, preciso ter tambm uma expresso para a
presso de vapor. A equao de Antoine ajusta-se maioria dos dados de presso de
vapor:
log P
a
= A
a
+ B
a
/(C
a
+ T)
onde A., B. e C. = constantes empricas.
Quando se deseja calcular o ponto de bolha para uma mistura ternria que obedece lei de
Raoult, a combinao do balano de massa com a lei de Raoult e com a equao de Antoine
d
X
a
(10)
A
a
+B
a
/(C
a
+T
) + X
b
(10)
A
b
+B
b
/(C
b
+T)
+ X
c
(10)
A
c
+B
c
/(C
c
+T)
= P
Constantes da equao de Antoine para a presso de vapor
Onde: PV a presso de vapor em mm Hg; t est em
o
C
A B C
Acetona 7,02447 1161,0 224
Acido actico 7,18807 1416,7 211
Agua 7,96681 1668,21 228,0
Anilina 7,24179 1675,3 200
Benzeno 6,90565 1211,033 220,79
i-Butano 6,74808 882,8 240,0
n-Butano 6,83029 945,9 240,0
Estireno 6,92409 1420,0 206,0
Etanol 8,04494 1554,3 222.65
ter dietrlico 6,78574 994,195 220,0
Etilbenzeno 6.95719 1424,255 213,206
Etilenoglicol 7,8808 1957,0 193,8
n-Heptano 6,90240 1268,115 216,9
n-Hexano 6,87776 1171,53 222,366
n-Octano 6,9237 1355,126 209,517
i-Pentano 6,78967 1020,012 233,097
n-Pentano 6,85221 1064,63 232,000
Tolueno 6,95464 1344,800 219,482
o-Xileno 6,99891 1474,679 213,686
m-Xileno 7,00908 1462,266 215,108
p-Xileno 6.99052 1453,430 215,307
Log
10
PV = A - B
C + t
16
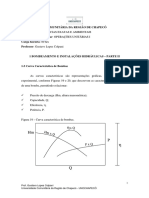
O ponto de orvalho e o ponto de bolha, de uma soluo binria, so funes da composio,
conforme est mostrado no diagrama a seguir para o sistema benzeno-tolueno. As curvas
so calculadas a partir de dados de presso de vapor, admitindo que a lei de Raoult vlida
para este sistema. O ponto de orvalho e o ponto de bolha coincidem quando x. = Y. = O e x.
= Y. = 1,0, pois estas composies representam o tolueno puro e o benzeno puro,
respectivamente. Os valores das temperaturas correspondentes a cada uma destas
composies so os pontos de ebulio dos componentes puros.
Quando se aquece uma soluo lquida, com a frao molar do benzeno igual a 0,4 (este
processo est representado na Figura pela reta vertical ascendente), o incio da
vaporizao, no ponto de bolha da soluo (ponto a) a 203,5F. A primeira bolha de vapor
em equilbrio, formada tambm a 203,5F tem a composio dada pelo ponto b -frao molar
do benzeno 0,625. medida que a temperatura aumenta (de a at c) a quantidade de
lquido evaporado tambm aumenta, at que a ltima gota de lquido vaporiza-se a 215F
(d). Durante o processo de vaporizao, a composio do lquido varia de 0,4 at 0,215 e a
do vapor de 0,625 at 0,4, tudo em frao molar do benzeno; a composio global da
mistura de lquido e vapor, no entanto, permanece constante e dada pela frao molar do
benzeno igual a 0,4.
A regio do plano do diagrama que fica abaixo da curva do ponto de bolha representa fase
lquida. Um lquido a uma temperatura abaixo da do seu ponto de bolha um lquido sub-
resfriado; o lquido no ponto de bolha um lquido saturado. Analogamente o vapor no seu
ponto de orvalho chamado vapor saturado. Entre as curvas do ponto de bolha e as de
ponto do orvalho h uma regio de duas fases em que coexistem um lquido saturado e um
vapor saturado. As quantidades relativas de lquido e de vapor, na regio de duas fases,
podem ser calculadas por um balano de massa .Acima da curva do ponto de orvalho est
uma regio de vapores superaquecidos.
17
Um grfico que frequentemente til o da Figura, com os dados x, y e T sob presso
constante. Porm, ao se desejarem balanos de massa nas relaes de fase, numa certa
presso, pode ser que a temperatura no seja determinvel.
As solues no-ideais podem ter curvas de temperatura contra composio que diferem
substancialmente das que foram citadas anteriormente. A figura abaixo, apresenta dois
sistemas no-ideais, o formado pelo iso-propanol e cloreto de propileno e o constitudo por
acetona e clorofrmio. Cada um destes sistemas forma um azetropo isto , uma soluo
lquida que tem um vapor em equilbrio cuja composio idntica do lquido. Na
composio do azetropo, o ponto de orvalho e o ponto de bolha coincidem e a soluo
lquida vaporiza-se a uma temperatura fixa.
Diagrama da temperatura contra composio de sistemas que formam azetropo na presso
atmosfria
Na destilao, e em outros processos de transferncia de massa, preciso efetuar no s
clculos de balano de massa mas tambm clculos de balano de energia. Esta energia ,
em geral, a entalpia, definida como a energia interna mais o produto PV . Na figura a seguir
aparecem os dados de entalpia contra concentrao para o sistema etanol-gua. A entalpia
molar est no eixo das ordenadas e a frao molar do componente mais voltil est no eixo
horizontal. Qualquer ponto no diagrama define a entalpia e a composio de uma soluo
binria. Podem-se organizar diagramas anlogos a estes com as fraes mssicas, em lugar
das fraes molares, no eixo das composies.
A entalpia de uma mistura binria uma grandeza relativa, tomada a partir de um certo
estado arbitrrio de referncia para os componentes puros. Por exemplo, na figura a seguir,
as entalpias do etanol puro e lquido a 32F e a da gua pura lquida, tambm a 32F, so
escolhidas como zero. As solues de etanol e gua podem ter entalpias diferentes de zero,
a 32F, em virtude da variao da entalpia na solubilizao ou na diluio. As variaes so
pequenas para o sistema etanol-gua. As solues lquidas, em temperaturas diferentes de
32F, tero entalpias diferentes de zero em virtude da variao de entalpia no processo de
aquecimento e que determinada pela capacidade calorfica da soluo e pela modificao
da temperatura. Se uma mistura lquida for vaporizada, a sua entalpia aumentar de uma
grandeza igual ao calor latente de vaporizao. Todas as variaes de entalpia so
consideradas ao se construir um diagrama entalpia-composio de um sistema binrio,
usando dados experimentais para as capacidades calorficas, os calores de soluo e os
calores de vaporizao.
Na figura a curva identificada por H representa os vapores nos respectivos pontos de
orvalho (vapores saturados) e a curva identificada por h representa os lquidos nos pontos
de bolha (lquidos saturados). A distncia vertical entre as curvas , portanto, o calor latente
de vaporizao de uma soluo. Entre as duas curvas h uma regio bifsica, de lquido e
vapor. Para determinar os pontos das curvas de vapor saturado e de lquido saturado que
esto em equilbrio, usa-se a curva de equilbrio da parte inferior do diagrama. Escolhe-se
18
um valor Y. na composies que esto em equilbrio. Na regio bifsica, as retas
identificadas por valores da temperatura so linhas de amarrao.
h
,
H
,
e
n
t
a
l
p
i
a
d
o
l
q
u
i
d
o
o
u
d
o
v
a
p
o
r
B
t
u
/
l
b
-
m
o
l
19
Quando se d a temperatura de equilbrio, as composies do vapor e do lquido so
determinadas a partir de um grfico de temperatura contra composio, para o sistema
C
3
H
7
OH-C
3
H
6
CI
2
. A regio abaixo da curva de lquido saturado representa lquidos sub-
resfriados. Nesta regio aparecem curvas de temperatura constante, isto , isotermas. No
sistema etanol- gua, oscaloresde soluo e dediluio so pequenos, de modo que as
isotermas so curvas quase retas, o que indica entalpia constante. Acima da curva do vapor
saturado est a regio dos vapores superaquecidos.
Nos casos tpicos, o aumento da presso eleva a temperatura em que ocorre o equilbrio
vapor-lquido e tambm diminui a nitidez da separao entre as composies de vapor e
lquido. Este efeito est ilustrado, para o sistema etanol-gua, na Figura
Na presso atmosfrica, uma soluo lquida com a frao molar do etanol igual a 0,2 est
em equilbrio com um vapor no qual a frao molar do etanol 0,53, enquanto que a 300
psia (20,4 atm) a mesma soluo est em equilbrio com um vapor de frao molar 0,42 em
etanol. Quando a presso diminui, a composio do azetropo tambm se modifica,
tornando-se mais rica em etanol.
Exemplo. Qual a composio do vapor em equilbrio com um lquido saturado com a
frao molar do etanol igual a 0,5 e a da gua tambm igual a 0,5?
Resoluo. Na Figura, traa-se uma reta vertical, para baixo, a partir da curva da entalpia
do lquido, na abscissa Xa = 0,5. O valor de equilbrio Ya determinado pela interseo
desta vertical com a curva de equilbrio e pode ser lido no eixo das ordenadas, direita,
como Ya = 0,66. Para transportar este valor para o eixo horizontal, traa-se uma reta
horizontal, a partir da curva de equilbrio, at a diagonal, e depois uma vertical, para cima,
20
at encontrar-se a curva da entalpia do vapor saturado. O ponto na curva H pode ser ligado
ao ponto inicial na curva h por uma linha de amarrao. A temperatura de equilbrio pode ser
determinada levando-se em conta a Figura. igual aproximadamente a 176F .
Exerccio Determinar as composies das fases presentes nas seguintes condies:
(a) Etanol e gua, a 177F e 1 atm. A concentrao global do etanol de 50%.
(b) Amnia e gua a 1 atrn, com Xa = 0,3.
(c) Etanol e gua, a 100F e 1 atm.
(d) Amnia e gua a 100 psia (6,8 atm), H = 10.000, frao molar global da amnia NH
4
=
0,5.
(e) Amnia e gua, a 100 psia (6,8 atm), H = 20.000, frao molar global da amnia = 0,4.
21
22
h
,
H
,
e
n
t
a
l
p
i
a
d
o
l
q
u
i
d
o
o
u
d
o
v
a
p
o
r
B
t
u
/
l
b
-
m
o
l
23
EQUILBRIOS LQUIDO-LQUIDO
Numa extrao lquido-lquido o soluto transferido de uma mistura lquido para uma outra
fase lquida, geralmente um solvente, insolvel na primeira. Em muitos casos, os dois
solventes so parcialmente solveis sendo que, o soluto pode interferir nessa solubilidade.
Nesses casos necessrio um diagrama de equilbrio ternrio o qual geralmente plotado
em um triangulo eqiltero. Aplicando-se as regras das fases (F = C + 2 P) possvel
verificar que podem haver trs variveis possveis para esse equilbrio: a presso, a
temperatura e as concentraes de dois componente sendo a possvel determinar a
concentrao do terceiro componente em funo da concentrao de dois.
O sistema ternrio ter isoproplico-cido actico-gua representativo de sistemas
em que apenas um par de lquidos parcialmente solvel enquanto os outros dois pares
so completamente solveis. Na Figura abaixo, cada vrtice do tringulo representa um
componente puro: o ngulo reto o da gua pura; o vrtice superior, o do ter isoproplico
puro; e o vrtice direita, o do cido actico puro. Em geral, o vrtice do ngulo reto repre-
senta uma fase pura constituda pelo componente principal do refinado que no extrado
(b) (denominado inerte); o vrtice superior representa o solvente puro usado na extrao
(c); e o vrtice direita o soluto puro (a) a ser extrado do refinado pelo solvente. O lado
horizontal do tringulo representa misturas de soluto e de inerte, sem a presena do
solvente. O lado vertical do tringulo representa misturas de inerte e solvente.
Como X
a
+ X
b
+ X
c
= 1, suficiente lanar os dados da concentrao em termos de
frao molar de dois componentes apenas. Qualquer ponto no interior do triangulo
representa uma mistura ternria. O lado inclinado do triangulo representa misturas onde X
b
= 0 ou Y
c
= 0, sendo mais fcil plotar no triangulo a frao mssica do soluto (X
a
ou Y
a
) e a
frao mssica do solvente (X
b
, Y
b
).
A curva nopqr separa a regio bifsica ( esquerda) da monofsica ( direita) e uma
curva de solubilidade demonstrando as composies de equilbrio. As misturas na parte
superior da curva a fase do extrato, rica em solvente e a mistura na parte inferior o
rafinado (tamm denominado refinado) e possui elevada concentrao de inerte.
Na parte inferior do diagrama aparece a curva de equilbrio que permite determinar as
composies de equilbrio. No ponto p indica onde no h linha de amarrao, portanto
demonstra o ponto crtico onde a composio do extrato e refinado so idnticos.
24
Em sistemas nos quais dois entre trs pares de lquidos so parcialmente solveis, o extrato
e o refinado so representados por curvas independentes sistema e no existe ponto crtico.
25
Neste caso, a curva do extrato muito curta no diagrama sendo portando inconveniente
para clculos de estgios. Para remediar esta situao pode-se recalcular os dados numa
base livre de solvente e plotar os pontos resultantes.
A representao numa base livre de solvente deve ser feita em dois diagramas, plotando os
pontos da concentrao do material diverso de solvente (soluto + inerte) nos eixos das
abscissas e no eixo das ordenadas a concentrao a do soluto no extrato e em outro a razo
entre o material solvente e o material no solvente. Isso pode ser realizado.
Convencionando a = soluto puro
b = componente do refinado no extrado ( inerte )
c = solvente puro usado na extrao
assim para uma determinada frao em massa do componente a determina-se pela curva de
equilbrio a frao mssica do solvente. Como a soma das fraes igual a 1, determina-se
a frao mssica do inerte (c). Dessa forma possvel determinar a frao do soluto isento
de solvente e a razo entre a massa de solvente e o no solvente pelas relaes:
Y
a
= massa de soluto
Massa do soluto + massa de inerte
Y
c
= massa do solvente
Massa do soluto + massa de inerte
E assim plotar os pontos nos diagramas.
Exerccio
Construa o representao numa base livre de solvente para o sistema dietilenoglico-
estireno-etilbenzeno com base na curva do extrato dada a seguir. Utilize os seguintes
valores para y
a
:
0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9 e 1,0
26
27
V
n+1
V
n
L
n-1
L
n
Para o tringulo eqiltero
Cada vrtice do tringulo representa um componente puro e misturas de quaisquer dois
componentes so representadas por pontos nas laterais do tringulo. As misturas que
contm todos os trs componentes caem no interior do tringulo, mas so prontamente
identificveis ou plotadas em termos de fraes de massa de quaisquer dois componentes.
O diagrama triangular usual tem linhas paralelas a seus lados que dividem cada um desses
lados em centsimos de seu comprimento total. A Figura mostra o efeito geral, mas
somente com as paralelas principais traadas. prtica comum marcar a frao massa de
cada componente ao longo de cada um dos trs lados. Os componentes so o soluto a ser
extrado (A), o solvente de extrao (C) e o solvente ou diluente original (B). A frao massa
de A na mistura amostral P representada por qualquer dos comprimentos assinalados a
na Figura . Similarmente as fraes de massa de C e B so representadas por qualquer dos
comprimentos assinalados se h, respectivamente. p evidentemente 30% de A, 50% de B e
20% S.
A plotagem ou interpretao de pontos no diagrama triangular facilitada pela obedincia a
umas poucas regras simples.
O conceito do estgio ideal
A Figura mostra o ensimo estgio ou unidade de contato numa cascata de extrao. O
ensimo estgio aceita a corrente V
n+1
do estgio (n + 1) que se refere ao extrato do
estgio posterior e fornece a corrente L
n
, o refinado, para esse estgio. Similarmente, aceita
a corrente L
n-l
do estgio (n -1), o refinado do estgio anterior e retoma a corrente V
n
o
extrato desse estgio. Se o estgio for ideal realizar perfeitamente a tarefa a ele
designada, i. ., realizar contato perfeito entre as correntes que chegam V
n+l
e L
n-l
e
separar limpamente a mistura nas correntes de equi1t'brio V n e Ln.
Na prtica esse estado de coisas dificilmente pode ser conseguido. A parte da operao
relativa transferncia de massas torna-se intoleravelmente lenta quando o equilbrio
aproximado, mesmo se forem tomadas medidas visando agitao vigorosa, e a separao
perfeita das duas fases muito difcil quando uma estiver finamente dispersa na outra e
especialmente se tiverem densidades comparveis. Qualquer falha na separao
corresponde a seu transporte para a destilao, e isto pode ser permitido a princpio, se a
Estgio n
28
separao real estiver adequadamente caracterizada. E mais comum, entretanto, a anlise
de uma cascata de extrao ser efetuada atravs da utilizao do conceito do estgio ideal,
e o nmero de tais estgios necessrios transformado para termos reais por meio de um
fator de eficincia baseado na experincia ou em testes.
EQUILBRIOS SLIDO-GS
A adsoro, que a forma mais
comum do estabelecimento de
equilbrio entre gs e slido, pode
ocorrer, conforme se observa, mediante
mecanismos fsicos e qumicos. A
adsoro fsica ocorre quando as foras
intermoleculares de atrao das
molculas na fase fluida e da superfcie
slida so maiores que as foras
atrativas entre as molculas do prprio
fluido. As molculas do fluido aderem
superfcie do adsorvente slido, e fica
estabelecido um equilbrio entre o fluido
adsorvido e a fase fluida restante.
Na Figura ao lado aparecem
diversas isotermas de adsoro fsica,
determinadas experimentalmente, de
vapores de hidrocarbonetos puros em
slica gel.
Fig. 3.12 Isotermas de adsoro de
hidrocarbonetos em silica gel
29
A adsoro de uma mistura de
gases leva a uma composio do
adsorvato diferente da que existe no
gs. Por isso possvel separar
misturas gasosas mediante adsoro
seletiva. As composies de equilbrio
da fase gasosa e do adsorvato, para
misturas de propano e propeno,
aparecem na Figura. Este diagrama de
equilbrio muito parecido com o da
destilao e da extrao em fase
lquida. Pode-se estabelecer uma
analogia entre o adsorvente na
adsoro, a entalpia na destilao e o
solvente na extrao por solvente.
Deve-se observar que a fase gasosa (V)
ocorre em yc = 0 e que a fase slida(L)
tem valores de Xc maiores que zero, em
contraste com o diagrama anlogo da
extrao em fase lquida.
Os dados de uma adsoro fsica
podem ser expressos, muitas vezes,
por meio de uma equao emprica. As
equaes comuns para as isotermas de
adsoro incluem:
Freundlich: X = k
1
p
1ln
Langmuir: X = k
2
p = k
2
p para pequenos valores de p onde
1 + k
3
p
Onde:
X = massa do adsorvato
unidade de massa do adsorvente
p = presso parcial do gs adsorvido na fase gasosa
n, k1 , k2, k3 = constantes empricas
A adsoro qumica, ou quimissoro, envolve a interao qumica entre o fluido
adsorvido e o slido adsorvente. Em muitos casos a adsoro irreversvel e difcil
separar o adsorvato do adsorvente. Por esta razo somente a adsoro fsica apropriada
a uma operao contnua em estgios. A adsoro usada para processar lquidos e
tambm gases. Os adsorventes comuns incluem slica gel, carvo, alumina, zelitos
sintticos e diversas argilas.
Uma forma ainda mais simples de equilbrio gs- slido a que ocorre na sublimao
de um slido ou na cristalizao de um slido a partir de um gs. Neste caso, o conceito
30
de presso de vapor usado exatamente nas mesmas formas que apareceram nas
Equaes
e p
a
= Hc
a
onde H = contante de Henry e ca = concentrao de a
a
Usualmente, no entanto, somente um componente capaz de cristalizar, ou de sublimar,
e por isso x = 1,0 para a fase condensada.
A troca inica outra operao de equilbrio slido-lquido, mas assemelha-se a uma
adsoro qumica. A resina slida de troca inica fabricada de modo a incluir um on
que ser substitudo por um outro on determinado numa fase fluida. Um exemplo comum
de troca inica ocorre com os "zelitos" abrandadores de gua, nos quais os ons sdio
da resina so trocados pelos ons clcio na gua. As operaes industriais de troca
inica ou so descontnuas, ou a contato contnuo, em lugar de ocorrerem em estgios;
por isso, sero analisadas num captulo posterior.
EQUILBRIOS SLIDO-LQUIDO
Numa extrao slido-lquido, um
solvente lquido usado para
dissolver um slido solvel
misturado a um slido insolvel.
Parte da soluo resultante adere
ao resduo insolvel. Um "estgio
de equilbrio" pode ser definido
como aquele em que o lquido
aderente aos slidos que saem do
estgio tem a mesma composio
que o extrato lquido que sai do
mesmo estgio. ento
necessrio determinar
experimentalmente a massa de
lquido aderente por unidade de
slidos insolveis. Estes dados
podem ser plotados num
diagrama ternrio, conforme est
na Figura
Composies da fase densa na extrao slido- liquido.
As curvas resultantes so as curvas da fase densa ou, conforme o caso, as curvas da lama;
estas curvas no representam verdadeiras condies de equilbrio. No diagrama aparecem
tambm curvas de razo constante entre o solvente e os inertes e entre a soluo e os
inertes, alm de uma curva determinada experimentalmente para a extrao de leo de
hipoglosso (espcie de linguado) usando-se ter como solvente. A fase densa pode ser
considerada como uma mistura de slidos inertes e soluo. O vrtice do ngulo reto
representa os slidos inertes puros e a hipotenusa do tringulo de composio representa as
solues lmpidas. Qualquer reta unindo uma soluo lmpida, com a composio sobre a
hipotenusa, ao vrtice do ngulo reto, intercepta a curva da fase densa na composio desta
fase em equilbrio com a soluo lmpida. Portanto, a parte da reta situada entre a
hipotenusa e a curva da fase densa uma linha de amarrao de equilbrio. A curva da fase
densa determina as quantidades relativas de soluo que adere aos slidos inertes. Os
f
aG
= f p y
a
p
a
31
dados da Fig. 3.13 so representa- tivos de curvas de fase densa. Quando os dados
experimentais so conhecidos, eles devem ser usados. Sendo,
No figura temos:
Curva 1 = Razo constante da massa de solvente aderente = 1
massa de inertes
Curva 2 = Razo constante de massa da soluo aderente = 1
massa de inertes
Curva 3 = Curva experimental para a extrao do leo de fgado de hipoglosso pelo ter.
porm, estes dados limitados, podem-se usar retas como 1 ou 2, ao modo de aproximaes.
Nmero de pratos numa coluna de destilao
O clculo do nmero de pratos de uma coluna de destilao normalmente se baseia no
conceito de pratos tericos (ou estgios de equilbrio). Um prato terico aquele em que as
correntes que saem do prato esto em equilbrio, ou seja, houve tempo e contato suficientes
para que as correntes que chegam no prato interajam e atinjam o equilbrio, antes de o
deixarem.Na realidade, os pratos reais se desviam deste comportamento de acordo com sua
forma e tipo, sendo este desvio denominado rendimento ou eficincia do prato. Na
determinao do nmero de pratos tericos de uma coluna de destilao binria, so
analisadas, normalmente, duas situaes:
quando a diferena entre as temperaturas do fundo e do topo da coluna pequena (10 a 50
C);
32
quando a diferena de temperatura entre o fundo e o topo da coluna grande (neste caso, >
50C).
Mtodo McCabe-Thiele
Quando se pode considerar a diferena entre as temperaturas do fundo e do topo da coluna
como pequena (de 10 a 50 C), geralmente as propriedades trmicas da mistura que se
deseja separar podem ser consideradas aproximadamente constantes em cada prato da
coluna. Desta forma, as vazes molares de lquido e vapor so constantes em todos os
pratos da seode retificao (SR) e, tambm, na seo de esgotamento (SE), diferindo, no
entanto,daquelas vazes existentes na SR. O mtodo de McCabe-Thiele consiste na
aplicao das consideraes acima para o clculo/anlise da destilao de misturas
binrias, utilizando-se o diagrama (curva) de equilbrio do sistema em questo. Este grfico
tem as seguintes propriedades:
- os pontos do grfico que representam as composies do lquido e do vapor em
equilbrio em um mesmo prato terico esto situados sobre a curva
de equilbrio;
- os pontos do grfico que representam a composio do vapor procedente de um
prato terico, em funo da composio do lquido que desce do prato imediatamente
superior, correntes que se cruzam, esto situados sobre as retas de operao das sees
de retificao e esgotamento.
O nmero total de pratos tericos necessrios determinado a partir do nmero de degraus
formados pela construo grfica em cima do diagrama. A Figura representa o resultado
para uma coluna hipottica, em que foram encontrados 4
pratos tericos.
33
Resumindo a definio de equilbrio:
Temperatura em Equilbrio
T
liq
= T
vap
Presso no Equilbrio
p
liq
= p
vap
Equilbrio qumico
(
i
)
liq
= (
i
)
vap
Lei Raoult: p
1
(x
i
, T) = x
i
p
i
(sat)
(T) Lei de Dalton: p
i
= y
i
p
P y
a
= P
a
x
a
Mtodo de McCabe-Thiele
Regra de Trouton:
vap
H (J/mol) 85xT
b
Exemplo: Benzeno; T
b
= 80 + 273 = 353 K
vap
H 85 x 353 = 30005 30 kJ/mol (Exp.: 30.8 kJ/mol)
Substncias a destilar tm Tb semelhantes
vap
H semelhantes
O calor necessrio para vaporizar o lquido provm do calor libertado da condensao do
vapor
So constantes os caudais ou fluxos (que o volume de fludo que atravessa uma dada
rea por unidade de tempo) de vapor e de lquido em cada seco da coluna
34
Em cada andar:
Moles de lquido que se evaporam Moles de vapor que condensam (Fluxo molar constante
- CMO)
L
1
= L
2
=..= L V
1
= V
2
=..= V
L
f+1
= L
f+2
=..= L V
f+1
= V
f+2
=..= V
Caudais de vapor e de lquido numa seco da coluna
(sem entradas e sem sadas) variam pouco de
pratopara prato e admitem-se constantes
O Mtodo de McCabe-Thiele:
Resoluo grfica das equaes dos balanos (mssicos e entlpicos) envolvem:
- Seco de rectificao
- Seco de alimentao
- Seco de esgotamento
Usa diagrama y-x onde aquelas linhas operatrias so retas
Corresponde soluo alternada das equaes referentes s retas operatrias e da
curva de equilbrio
Diagrama x-y
- Presso constante.
- Representa-se em funo do componente mais voltil
- Pontos na curva representam fases em equilbrio
- Linha auxiliar x = y. No tem significado fsico (mas muito conveniente)
Reta Operatria da Retificao
35
Relaciona a composio do lquido de um prato com a composio do vapor que vem do
prato inferior
BMT: V
1
= L
1
+ D
BMP: y
n+1
V
1
= L
1
x
n
+ D x
D
Isolando y
n+1
Relacionando com a Razo de refluxo
Assim:
Para qualquer andar da retificao
Assim obtm-se a reta de
retificao com:
coeficiente angular
e coeficiente linear
Recta Operatria de Esgotamento
Relaciona a composio do lquido de um prato da seco de esgotamento com a
composio do vapor que chega do prato inferior
y
n+1
= L
1
x
n
+ D x
D
V
1
V
1
R = L
R
L = R D
D
L
1
= R . D = R . D = R
V
1
L
1
+ D R . D + D (1 + R)
D
= L/R = L R = 1
V
1
L
1
+ L/R R . L ( 1+R) (1 + R)
y
n+1
= R x
n
+ x
D
(1+R) (1 + R)
y
= R x
+ x
D
(1+R) (1 + R)
R
(1+R)
X
D
(1+R)
36
BMT: L = V + W
BMP: x
m
L = V y
m+1
+ W x
w
Isolando y
m+1
Para qualquer andar
Lquido proveniente do fundo da
coluna apenas parcialmente
vaporizado e reciclado para a coluna
x
N
y
w
x
w
Recta Operatria da Alimentao
A relao entre os caudais das seces de retificao e de esgotamento (e por isso, os
declives das respectivas retas operatrias) depende do estado trmico
da corrente de alimentao que determina a sua entalpia
andar f
F + L + V = L + V
Fh
f
+ Lh
l
+ Vh
v
= Lh
l
+ Vh
v
q: grandeza adimensional (representa a
condio trmica da alimentao) - a razo
entre o aumento de caudal molar de lquido
no prato da alimentao por mol da corrente
de alimentao
Alimentao: lquido saturado ou vapor saturado ou mistura lquido-vapor,
q a fraco da alimentao que lquido
y
m+1
= L x
m
- W x
w
V V
y
m+1
= L x
m
- W x
w
V V
Y
= L x
- W x
w
V V
D
= L/R = L R = 1
V
1
L
1
+ L/R R . L ( 1+R) (1 + R)
37
38
También podría gustarte
- Estrutura e propriedades dos polímerosDocumento26 páginasEstrutura e propriedades dos polímerosClaudinei MartinsAún no hay calificaciones
- Derivados do Buteno: Nylon 6.6Documento11 páginasDerivados do Buteno: Nylon 6.6Claudinei MartinsAún no hay calificaciones
- Transferencia de Massa e Energia 11-07Documento15 páginasTransferencia de Massa e Energia 11-07Claudinei MartinsAún no hay calificaciones
- Processos IndustriaisDocumento21 páginasProcessos IndustriaisClaudinei MartinsAún no hay calificaciones
- Processos IndustriaisDocumento21 páginasProcessos IndustriaisClaudinei MartinsAún no hay calificaciones
- Principais Conversões Químicas Da Indústria PetroquímicaDocumento17 páginasPrincipais Conversões Químicas Da Indústria PetroquímicaClaudinei MartinsAún no hay calificaciones
- Bibliografia e soluções tampãoDocumento6 páginasBibliografia e soluções tampãoBruno Paccola Meirelles80% (5)
- Reacoes Quimicas1aDocumento20 páginasReacoes Quimicas1aClaudinei MartinsAún no hay calificaciones
- Apostila Desenho Com Computador Soniareis Mt2005 Modulo1Documento96 páginasApostila Desenho Com Computador Soniareis Mt2005 Modulo1Claudinei MartinsAún no hay calificaciones
- Caldeiras Industriais - Relatorio Trab FinalDocumento18 páginasCaldeiras Industriais - Relatorio Trab FinalClaudinei MartinsAún no hay calificaciones
- Caldeiras Industriais - Relatorio Trab FinalDocumento18 páginasCaldeiras Industriais - Relatorio Trab FinalClaudinei MartinsAún no hay calificaciones
- QFL 2309 – Reatividade de Compostos OrgânicosDocumento10 páginasQFL 2309 – Reatividade de Compostos OrgânicosClaudinei Martins100% (1)
- Apostila Eletroeletronica El2004Documento73 páginasApostila Eletroeletronica El2004Claudinei MartinsAún no hay calificaciones
- Processos IndustriaisDocumento21 páginasProcessos IndustriaisClaudinei MartinsAún no hay calificaciones
- Planejamento e Controle de Estoque na ProduçãoDocumento125 páginasPlanejamento e Controle de Estoque na ProduçãoClaudinei MartinsAún no hay calificaciones
- Apostila de Quimica Analitica Qualitativa IDocumento60 páginasApostila de Quimica Analitica Qualitativa Irodrigues.filho91% (11)
- Análise de RiscoDocumento16 páginasAnálise de RiscoClaudinei MartinsAún no hay calificaciones
- Teoria Orbital MolecularDocumento13 páginasTeoria Orbital MolecularClaudinei MartinsAún no hay calificaciones
- APRAmbiente ConfinadoDocumento20 páginasAPRAmbiente ConfinadoClaudinei MartinsAún no hay calificaciones
- Resumo. Teoria Dos Orbitais MolecularesDocumento5 páginasResumo. Teoria Dos Orbitais MolecularesClaudinei MartinsAún no hay calificaciones
- Apostila Cad 1007Documento96 páginasApostila Cad 1007Claudinei MartinsAún no hay calificaciones
- Capitulo 2Documento12 páginasCapitulo 2Claudinei MartinsAún no hay calificaciones
- Operações Unitárias II: Transferência de CalorDocumento5 páginasOperações Unitárias II: Transferência de Calorcir2003Aún no hay calificaciones
- Apostila de Quimica Analitica Qualitativa IDocumento60 páginasApostila de Quimica Analitica Qualitativa Irodrigues.filho91% (11)
- Capitulo 3Documento12 páginasCapitulo 3Claudinei MartinsAún no hay calificaciones
- Absorção Gasosa e Permuta de CalorDocumento31 páginasAbsorção Gasosa e Permuta de CalorClaudinei MartinsAún no hay calificaciones
- Apostila Analogica IIDocumento37 páginasApostila Analogica IIClaudinei MartinsAún no hay calificaciones
- Simetria Molecular Universidade Estadual Do CearáDocumento63 páginasSimetria Molecular Universidade Estadual Do CearáClaudinei MartinsAún no hay calificaciones
- Teoria Orbital MolecularDocumento13 páginasTeoria Orbital MolecularClaudinei MartinsAún no hay calificaciones
- 4 1-Sistemas+de+Ar+Comprimido PDFDocumento50 páginas4 1-Sistemas+de+Ar+Comprimido PDFMarco EsquivelAún no hay calificaciones
- Cap 3 Destilação Flash - Azevedo e Alves 2009Documento5 páginasCap 3 Destilação Flash - Azevedo e Alves 2009Marcel SouzaAún no hay calificaciones
- Pressão Hidrostática em Diferentes ProfundidadesDocumento4 páginasPressão Hidrostática em Diferentes ProfundidadesLucas de Oliveira SantosAún no hay calificaciones
- UFSC - Fenômenos de TransporteDocumento27 páginasUFSC - Fenômenos de TransporteBruna FrainerAún no hay calificaciones
- Estudo Dos GasesDocumento3 páginasEstudo Dos GasesWaldecyr Iuata CardosoAún no hay calificaciones
- LISTA 1 MEC FluidosDocumento3 páginasLISTA 1 MEC Fluidoswillian0% (1)
- Entalpias de formação de substâncias químicasDocumento1 páginaEntalpias de formação de substâncias químicasCarolina OliveiraAún no hay calificaciones
- Compressor fracionário DC Elgin - especificações e aplicaçõesDocumento6 páginasCompressor fracionário DC Elgin - especificações e aplicaçõesfabiofgfAún no hay calificaciones
- Pressostato Zurich Modelo - Zpu-Il PDFDocumento2 páginasPressostato Zurich Modelo - Zpu-Il PDFRichard Mayk teodoroAún no hay calificaciones
- FisII 2016 Gases Ideais Lucy IO PDFDocumento24 páginasFisII 2016 Gases Ideais Lucy IO PDFdantravassosAún no hay calificaciones
- Catálogo Técnico: Thechical CatalogueDocumento21 páginasCatálogo Técnico: Thechical CatalogueAndre AssisAún no hay calificaciones
- Capitulo I Bombeamento e Instalacoes Hidraulicas Parte II 1627598911Documento13 páginasCapitulo I Bombeamento e Instalacoes Hidraulicas Parte II 1627598911tauana sorancoAún no hay calificaciones
- Regulador de pressão com SSV para distribuição de gásDocumento6 páginasRegulador de pressão com SSV para distribuição de gásEdilsonAún no hay calificaciones
- INSTRUCAO - TECNICA - 29-2011 - Comercialização, Distribuição e Utilização de Gás Natural PDFDocumento4 páginasINSTRUCAO - TECNICA - 29-2011 - Comercialização, Distribuição e Utilização de Gás Natural PDFEmanuel CalvoAún no hay calificaciones
- Comandos eletropneumáticos e eletrohidráulicosDocumento90 páginasComandos eletropneumáticos e eletrohidráulicospatropi1Aún no hay calificaciones
- Ficha Formativa I - ÁguaDocumento2 páginasFicha Formativa I - ÁguaMaria Purificação Garrido100% (1)
- NR 13 Planilha Calculo PV e VolDocumento51 páginasNR 13 Planilha Calculo PV e Voljos luizAún no hay calificaciones
- Manual Do Ar ComprimidoDocumento77 páginasManual Do Ar ComprimidoPaulo Fernando100% (7)
- Estudo de gases ideal em físicaDocumento4 páginasEstudo de gases ideal em físicaManuela Sampaio0% (1)
- Estática dos Fluidos: Pressão e AlturaDocumento24 páginasEstática dos Fluidos: Pressão e AlturaKaren de SáAún no hay calificaciones
- Equipamentos de Um Sistema de Ar ComprimidoDocumento37 páginasEquipamentos de Um Sistema de Ar ComprimidoRocky LaneAún no hay calificaciones
- Aula 02 - Sistemas PneumaticosDocumento33 páginasAula 02 - Sistemas PneumaticosReginaldo CamposAún no hay calificaciones
- Análise de estabilidade de guindaste Manitowoc M-250 com Max-SpanderDocumento7 páginasAnálise de estabilidade de guindaste Manitowoc M-250 com Max-SpanderValdeirdeMelo100% (1)
- Faculdade Pitágoras de Teixeira de Freitas atividade sala aula termodinâmicaDocumento2 páginasFaculdade Pitágoras de Teixeira de Freitas atividade sala aula termodinâmicaRodrigo Mota40% (10)
- Lei Fundamental Da HidrostáticaDocumento19 páginasLei Fundamental Da HidrostáticaMagda FerreiraAún no hay calificaciones
- Física II N1Documento3 páginasFísica II N1deiverton paivaAún no hay calificaciones
- Lista de Exercícios P2Documento2 páginasLista de Exercícios P2Lilian PaesAún no hay calificaciones
- Máquinas de FluxoDocumento207 páginasMáquinas de FluxoThiago Laurindo 2Aún no hay calificaciones
- Craqueamento CatalíticoDocumento99 páginasCraqueamento CatalíticoAdilson J. de AssisAún no hay calificaciones
- Indústria do NitrogênioDocumento32 páginasIndústria do NitrogênioPriscilla CibelleAún no hay calificaciones