Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Hemo y Hierro
Cargado por
FREYERDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Hemo y Hierro
Cargado por
FREYERCopyright:
Formatos disponibles
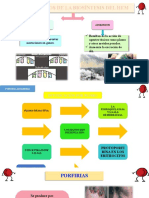
BIOQUMICA METABOLISMO DEL HEMO Y DEL HIERRO SNTESIS DEL HEMO El Hemo est formado por una protoporfirina
a (anillo tetrapirrlico) y 1 tomo de Fe unido a sus nitrgenos. El hgado sintetiza 15% del hemo, que se usa para citocromos y otras hemoprotenas. El otro 85% lo sintetizan las clulas eritroides, para formar la hemoglobina (Hb). Los pasos de la sntesis son los siguientes: 1) ALA: La sntesis de la porfirina (molcula precursora del hemo) comienza con la formacin de cido gamma amino levulnico (ALA), por la condensacin de SuccinilCoA + Glicina. La enzima que participa es la ALA sintetasa (ALA-s), que es mitocondrial, y la reaccin requiere fosfato de piridoxal. Esta reaccin es el paso limitante de la velocidad de la sntesis de porfirinas, y es inhibida por el hemo (producto final de la va). La ALA-s, a pesar de que acta en la mitocondria, se sintetiza en el citosol, y se luego de su sntesis va a la mitocondria por un pptido seal, que la dirige hacia all. 2) PBG: Dos ALA se condensan para formar porfobilingeno (PBG). La reaccin ocurre en el citosol, por la enzima ALA-dehidrasa, que libera dos H2O. Esta enzima contiene Zn en su sitio activo, que puede ser inhibido competitivamente por plomo (Pb). De los dos ALA que forman al PBG, 1 ALA forma el sustituyente propinico y otro el actico. 4 molculas de PBG se condensan y forman porfiringeno (PF). Los pirroles se designan A, B, C y D. Segn el rearreglo de sus sustituyentes, existen varios ismeros, que se designan con nmeros romanos. Las porfirinas, se sintetizan a partir de PF. Se diferencian de ellas en que sus pirroles estn unidos entre s por puentes metenilo en lugar de metileno, y en que tienen resonancia. Como los PF no tienen resonancia entre sus pirroles, son una molcula inestable, y se oxidan fcilmente en presencia de luz, a porfirinas (ms estables). Las porfirinas absorben la luz UV, lo que permite su deteccin en muestras biolgicas. 3) URO III: La condensacin de 4 PBG por puentes metenilo forma el uroporfiringeno I (URO I), por la enzima URO I sintetasa, tambin llamada PBG desaminasa (PBG-D). La PBG-D se asocia con la enzima URO III cosintetasa (URO-Cos), que dirige la sntesis de URO hacia el ismero III. El mecanismo de accin de la PBG-D es el siguiente: La PBG-D utiliza al pirrometano (que tiene dos molculas de PBG). El pirrometano se une a los 4 PBG para formar una secuencia de 6 PBG, sobre el que se produce la reaccin de desaminacin catalizada por la PBG-D. El producto de la desaminacin es el hidroximetilbilano, y sobre ste acta la URO Cos, dirigiendo la sntesis a URO III. Sin la URO CoS, el hidroximetilbilano forma espontneamente URO I. 4) CPP III: URO III es convertido a coproporfiringeno III (CPP III) por la enzima UROdecarboxilasa (URO-D). Esta enzima cataliza la decarboxilacin sucesiva de los grupos acetato unidos a los pirroles, que pasan a metilos. URO-D reconoce tanto al ismero III como al I. Si falla la URO-D se acumulan los intermediarios (hepta, hexa y penta porfiringenos III), que se oxidan y forman las correspondientes porfirinas. Al acumularse en la piel, causan dao a la misma, causando fotosensibilidad (porfiria cutnea tarda). Factores que pueden disminuir la actividad de la URO-D son el alcohol, los estrgenos, el hierro, y el hexaclorobenceno. 5) PP IX: El CPP III pasa del citosol a la mitocondria. En la MMI est la CPP oxidasa, que cataliza la decarboxilacin oxidativa de 2 propinicos laterales del CPP III, pasndolos a vinilo. As se forma el protoporfiringeno III, tambin llamado IX (PP IX). La reaccin requiere O2. La CPP oxidasa slo reconoce al CPP III, lo que explica que no exista el PP I. 6) PPf IX: En MMI, la enzima PP oxidasa cataliza la oxidacin de PP IX a protoporfirina IX (PPf IX), con gasto de O2. 7) Hemo: Finalmente, la enzima ferroquelatasa de la MMI incorpora un Fe2+ a la PPf IX, formando el hemo. Si el hierro es frrico (Fe3+), el producto se llama hematina. El O2 tiene efecto inhibitorio sobre la ferroquelatasa, y tambin los metales pesados, especialmente el Pb, que se combina con los grupos SH de la enzima. Cuando no hay suficiente Fe, ste se sustituye por Zn, y se forma PPf (Zn), que no atraviesa la membrana plasmtica del eritrocito , y por lo tanto no sirve para formar hemoglobina. Una relacin PPf(Zn)/Hb alta es indicadora de anemia ferropnica. REGULACIN DE LA SNTESIS DEL HEMO EN EL HGADO a) Induccin-represin: Hemo y hematina reprimen a la ALA-s, y la inhiben alostricamente. Las sustancias que inducen a la ALA-s son aquellas que pueden disminuir el pool de hemo libre, y son las dorgas liposolubles (esteroides, barbitricos, etc.). Para metabolizar estas drogas se consume cit P450, que requiere hemo para su sntesis. Al bajar los niveles de hemo, se induce ALA-s. b) Control de actividad de ALA-s: El hemo libre inhibe la actividad de la enzima. c) Inhibicin de la traduccin de ALA-s: El hemo libre tambin inhibe la traduccin de ALA-s. d) Transferencia de ALA-s a la mitocondria: Causada por alta concentracin de hemo.
e) Control de actividad de PBG-D: En pacientes con la ALA-s desregulada por algn motivo, PBG-D es el punto de control. Es inhibida por el hemo, por lo tanto estos pacientes se tratan con infusiones de hemo o hematina. f) Control por glucosa: Glucosa inhibe la sntesis del hemo, por mecanismos desconocidos. Por lo tanto, una dieta hipocalrica puede causar porfiria. h) Hormonas esteroides: Algunas HE sufre beta-reduccin, cuyo producto estimula a la ALA-s. Como la beta-reductasa aparece en la pubertad, algunas porfirias surgen en esa etapa. EN EL ERITROCITO Aqu el hemo est formando Hb, unido a globinas, por lo tanto su concentracin no sufre grandes cambios. En el eritrocito la ferroquelatasa y la PBG-D son las enzimas limitantes. El hemo regula su propia sntesis controlando la adquisicin de hierro por la transferrina, ms que regulando a las enzimas. USOS TERAPUTICOS DE LAS PORFIRINAS - Tratamiento de hiperbilirrubinemia: Inhibe la produccin de bilirrubina a partir de hemo, por inhibicin de la hemooxigenasa. - Agente quimioteraputico: Algunos derivados de las porfirinas pueden acumularse en el tejido neoplsico, por motivos desconocidos. Se usan para terapa fotodinmica, en la que se inyecta porfirinas en el tejido tumoral, y se irradia con luz UV. La porfirina, al excitarse con la luz, destruye el tejido que la rodea. PORFIRIAS Son enfermedades causadas por alteraciones en la biosntesis del hemo. Pueden ser hereditarias o adquiridas, y se clasifican tambin como agudas y no agudas. PORFIRIAS AGUDAS En todas las porfirias agudas, el defecto est antes de la formacin de porfiringenos. Siempre se acumulan los intermediarios ALA y PBG, y sus niveles plasmticos y en orina son elevados. - Porfiria Aguda Intermitente (PAI): Es de transmisin autosmica dominante. Hay un dficit en la enzima PBG-D. Al haber un bloqueo parcial de la sntesis de hemo, se desrreprime la ALA-s. Hay alta produccin de PBG y ALA, por lo que hay gran excrecin por orina. El PBG, al contacto con el aire forma porfirina, que hace que la orina se torne oscura. La acumulacin de ALA sera la responsable de los problemas neurolgicos. La PAI es exacerbada por drogas que aumentan el consumo del hemo, como las que requieren metabolizarse por el cit P450, ya que se estimula an ms a la ALA-s. El tratamiento de la PAI es con hematina o arginato de hemo (para inhibir a la ALA-s) - Coproporfiria hereditaria: Hay un dficit en la CPP oxidasa, que causa la acumulacin de CPP III, ya que no se puede oxidar a PP IX. Como se interrumpe la sntesis de hemo, se desrreprime ALA-s, acumulndose tambin ALA y PBG. Los sntomas son similares a los de la PAI, y adems hay fotosensibilidad debido al CPP acumulado en la piel. El tratamiento es con hematina. - Porfiria jaspeada o variegata: La enzima PP oxidasa est al 50% de su concentracin normal. Los pacientes presentan bajos niveles de hemo en situaciones de stress. Se estimulan la ALA-s y se acumula CPP y URO en heces y orina. Las porfirinas acumuladas circulan en el plasma y se depositan en los tejidos, causando fotosensibilidad. Los sntomas son similares a los de la PAI. El PP y el CPP inhiben a la PBG-D, lo que explica la acumulacin de PBG y ALA. PORFIRIAS NO AGUDAS - Porfiria eritropoytica congnita: Ausencia o dficit de URO-Cos, en todas las clulas pero especialmente en tejido eritropoytico. Bajos niveles de hemo por falta de URO III, estimulan a la ALA-s. Los eritrocitos y la MO contienen altos niveles de URO I. Las porfirinas tipo I en exceso son txicas, y causan daos en el SNC y fotosensibilidad al acumularse en la piel. Los sntomas son iguales que los de la PAI, junto con fotosensibilidad. El diagnstico bioqumico es mediante la identificacin de las porfirinas en la orina. - Porfiria cutnea tarda (PCT): Dficit de la URO-D, que convierte URO III en CP III. Por lo tanto se acumulan porfirinas con muchos carboxilos, especialmente uroporfirina y heptaporfirina, tanto en plasma como en orina. La PCT puede ser adquirida (tipo I) o hereditaria (tipo II, con patrn autosmico dominante). En el tipo II, la URO-D tiene una vida media mucho menor, y una actividad del 50% o menos. Las porfirinas acumuladas se depositan en la epidermis, donde absorben rayos UV y se excitan. En estado excitado, las porfirinas reaccionan con las estructuras que las rodean, o con el O2 formando radicales libres, daando al tejido circundante. Los sntomas de PCT son fotosensibilidad, hiperpigmentacin, hipertricosis y fragilidad cutnea.
Generalmente la PCT se asocia a un factor desencadenante, como el alcohol, estrgenos, sobrecarga de hierro, virus como el de la hepatitis, o hidrocarburos como el hexaclorobenceno. - Protoporfiria eritropoytica: Dficit en la ferroquelatasa, en las mitocondrias de todos los tejidos. Se acumula protoporfirina IX en eritroblastos, eritrocitos, y hepatocitos. Los pacientes presentan alta fotosensibilidad, y no hay elevacin de ALA, PBG o porfirinas en orina. La protoporfirina de los eritrocitos puede difundir al plasma, unirse a la albmina, y acumularse en el hgado, causndole dao. PLUMBOPORFIRIA El Pb inhibe a varias enzimas de la biosntesis de hemo, como a la ALA-dehidrasa (la ms afectada), y en menor medida a la PBG-D y a la ferroquelatasa. En pacientes con envenenamiento con Pb, se acumula PP en eritrocitos, y hay excrecin de ALA y CPP por orina. Un tratamiento posible es con quelantes de metales, como el EDTA. METABOLSIMO DEL HIERRO El Fe es necesario para formar hemo y tambin otra protenas no hmicas, como las ferrosulfoprotenas. El 25% del Fe total se almacena en el hgado, bazo, y huesos, en forma de ferritina. Circula en el plasma formando complejos con molculas de bajo PM como ascorbato y citrato, y con protenas transportadoras, principalmente la transferrina. ABSORCIN INTESTINAL DE HIERRO La mayor parte entra como Fe3+. Se absorbe principalmente en duodeno. El jugo gstrico tiene la enzima gastroferrina, que se une al Fe3+ facilitando su posterior absorcin. En el ribete en cepillo del enterocito, el Fe3+ se reduce a Fe2+ por la ferrirreductasa (cit B duodenal). El pH cido del jugo gstrico ayuda a disociar al Fe3+ de sus ligandos, facilitando su reduccin en el duodeno. Una vez reducido, el Fe2+ se une al transportador de metales divalentes (DMBT1) del ribete en cepillo. El DMBT transporta al Fe2+ hacia el citosol, utilizando la disipacin de un gradiente de protones como fuente de energa. En los alimentos de origen animal, el Fe est principalmente en forma de hemo. El hemo pasa a la clula directamente, sin necesidad de un transporte, y en el citoplasma la enzima hemooxigenasa separa la porfirina del Fe. Hay otra va de absorcin, la va de la mobilferrina-paraferritina, por la cual se absorbe directamente una pequea cantidad de Fe3+ sin necesidad de reducirlo. Gran parte del Fe ingerido no se absorbe, por no estar en una forma fcilmente aceptable (baja biodisponibilidad). Por ejemplo, la espinaca contiene mucho Fe, pero ste es muy poco absorbible ya que est unido al fitato, que resiste las acciones qumicas del tracto gastrointestinal. PROCESAMIENTO INTRACELULAR DEL HIERRO Luego de ingresado al enterocito como Fe2+, se oxida de nuevo a Fe3+, por una ferrooxidasa. El Fe3+ puede tener dos destinos: se une a la apoferritina que se halla en el citosol, formando ferritina (molcula de almacenaje), y otra parte sale al LEC, para difundir a los capilares y unirse a la transferrina (molcula transportadora). Cada ferritina puede contener hasta 4000 tomos de Fe. Normalmente, la concentracin plasmtica de ferritina es muy baja, y se deben al proceso natural de recambio celular, en el cual las clulas se lisan y liberan su contenido. Sus niveles son indicadores fieles de la cantidad de hierro en los depsitos corporales (hgado, bazo, enterocitos). Cuando hay un exceso de Fe, la capacidad de almacenamiento puede superarse, formndose depsitos llamados hemosiderina. Su acumulacin daa los rganos, especialmente al hgado, pncreas y bazo, causando al enfermedad llamada hemocromatosis. REGULACIN DEL METABOLISMO DEL HIERRO La regulacin de la absorcin es muy importante, debido a que casi no hay vas de excrecin de Fe. Para poder pasar el Fe a la sangre, el enterocito debe reducir el Fe almacenado como ferritina, por la enzima ferritina-reductasa. Esta usa NADH, FADH2 o FMNH, dando como productos apoferritina y coenzimas oxidadas, y liberando Fe2+. En el plasma, el Fe2+ se oxida por cuproenzimas (ferroxidasas), y el Fe+3+ puede unirse a la transferrina (Tf). La Tf se sintetiza en el hgado, y transporta el 99% del Fe plasmtico. Hay 3 tipos de ferroxidasas: I (ceruloplasmina), II, y III (hefastina). Cada Tf puede unir 2 tomos de Fe3+, pero en condiciones normales la saturacin de la Tf es del 30%. La Tf, debido a su afinidad por el hierro, acta protegiendo de algunos microorganismos que dependen del Fe para sobrevivir. Algunos microorganismos, como la E.Coli, liberan quelantes de Fe, que transfieren al metal de la Tf a la bacteria. Otras protenas involucradas en el metabolismo del Fe son la hemopexina (une hemo libre) y la haptoglobina (une hemoglobina libre).
La Tf ingresa a las clulas por pinocitosis, unida a receptrores especficos (RTf). El complejo Fe3+-Tf-RTf se incorpora y queda dentro de un endosoma (sideroma). En l actan enzimas y un bajo pH, liberando el Fe3+ al citosol, donde se une a la apoferritina formando ferritina. El complejo RTf-ApoTf vuelve a la membrana plasmtica, donde la apoTf se libera al plasma, y el receptor es reciclado. REGULACIN DE LA LIBERACIN DE HIERRO DEL ENTEROCITO AL CAPILAR Se da por la coordinacin opuesta de la sntesis de apoferritina y receptor de transferrina. Por este mecanismo, el Fe absorbido depende del Fe almacenado, y de los requerimientos del organismo. Bajas reservas, hipoxia o anemia, aumentan la absorcin. Los ARNm de DMBT1, ferritina y RTf tienen elementos de respuesta al hierro (IRE). Al aumentar la concentracin de Fe, la clula aumenta la sntesis de apoferritina (para unir al Fe extra) y disminuye la sntesis de RTf y DMBT1 (para disminuir la absorcin). Al disminuir el Fe, ocurre lo contrario. El mecanismo es el siguiente: - En ausencia de hierro: La protena aconitasa se acomoda en el IRE del ARNm de la ferritina (que est cerca de extremo 5) y del RTf (cerca del 3, donde est la cola poly A). La aconitasa, al unirse cerca de la cola poly A del ARNm del RTf, lo estabiliza, alargando su vida media y por lo tanto estimulando su sntesis. Por el contrario, la aconitasa unida al IRE del ARNm de ferritina inhibe su traduccin. - En presencia de hierro: La aconitasa se une a un tomo de Fe, lo que cambia su conformacin, y causa su separacin de los IRE. Entonces, el ARNm del RTf, al perder la estabilidad que le daba la aconitasa, disminuye su vida media, y se inhibe su traduccin. Por el contrario, al liberarse el IRE del ARNm de ferritina, se estimula su traduccin. ALTERACIONES DEL METABOLISMO DEL HIERRO DFICIT DE HIERRO La prdida de Fe causa disminucin de la Hb (anemia ferropnica, con eritrocitos microcticos e hipocrmicos). Si hay hemlisis intravascular, la Hb y hemo se liberan al plasma, y si se supera la capacidad de unin de la hemopexina y haptoglobina, se excretan por el rin, causando prdida de Fe. Si hay deficiencia aguda de Fe, se inactivan las enzimas que lo usan como cofactor, causando varios efectos indeseables. Cuando disminuye la cantidad de Fe corporal, aumenta la transferrina srica. Al disminuir los depsitos de Fe corporal, tambin disminuye la ferritina srica. A medida que baja la concentracin de Fe en el plasma, aumenta el % de saturacin de la Tf. SOBRECARGA DE HIERRO La sobrecarga de Fe puede deberse al aumento patolgico de la absorcin de Fe (hemocromatosis idioptica). Otra causa puede ser las transfusiones constantes (como requieren algunos pacientes con anemia hemoltica), en cuyo caso se trata al paciente con quelantes de Fe. Por ltimo, puede haber sobrecarga de hierro por consumo excesivo del mismo, generalmente acompaado de etanol (que estimula su absorcin). CATABOLISMO DEL HEMO La mayor parte del hemo circulante proviene de la degradacin de los glbulos rojos (GR), y una parte menor de los citocromos y hemoprotenas varias. El GR senil sufre alteraciones qumicas (menor actividad de la glutation reductasa, cambios electrolticos, ec.), que afectan su metabolismo y las caractersticas de su membrana. Esto hace que el GR viejo sea reconocido por los macrfagos del sistema retculo endotelial (SRE) del bazo, hgado y mdula sea. Los macrfagos fagocitan al GR viejo, y lo degradan en un lisosoma. All las protenas se degradan (incluidas las globinas). El hemo liberado va al RE, donde se convierte en pigmentos biliares, y el Fe va a los depsitos de ferritina. Gran parte de la Hb liberada de los GR en tejidos extrahepticos es transportada al hgado por la haptoglobina. El complejo Hb-haptoglobina no filtra por rin, evitando as la prdida de hierro por orina. Otras protenas plasmticas transportan hemo en forma de hemina (con Fe3+), como la albmina o la hemopexina. Hb libre slo aparece en orina cuando la haptoglobina circulante es insuficiente para unirla, como pasa en la hemlisis intravascular. HEMOOXIGENASA El catabolismo del hemo comienza con la enzima hemooxigenasa (HO), en una reaccin que requiere O2 y NADPH. La HO se une al hemo, e interacciona con una enzima NADPH-citP450 reductasa. Esta enzima es la que cataliza la transferencia de electrones del NADPH al cit P450. El O2 se divide, por la introduccin de 2 H+ del NADPH, en sus tomos constituyentes. Un O se incorpora al hemo, y el otro O forma H2O.
El O que se incorpora al hemo lo hace unindose al carbono alfa-meteno (entre los anillos A y B), formando CO (que se libera), abrindose as el anillo tetrapirrlico. El producto de la apertura del anillo se llama verdoglobina, y es de color verdoso. Luego, el terapirrol abierto se separa e la globina, formndose as la biliverdina. La globina se degrada por proteasas. Los aminocidos de la globina y el Fe3+ que se liberaron van a las reservas celulares, o sea utilizan segn las necesidades metablicas. La enzima biliverdina reductasa reduce el puente meteno central de la biliverdina, originando bilirrubina (color amarillo-naranja). As se forma la bilirrubina en el SRE, y pasa a la circulacin. PROCESAMIENTO HEPTICO DE BILIRRUBINA LIBRE La bilirrubina (BRB) tambin se forma por degradacin de otras hemoprotenas, como los citocromos, las peroxidasas, las catalasas, etc. Tambin hay una fraccin que viene de la mdula sea, originada del catabolismo de las clulas eritroblsticas que mueren antes de madurar. - Transporte al hgado: BRB es insoluble, y en el plasma viaja unida a albmina, para captarse en el hgado. Aqu, BRB se separa de la albmina, y entra al hepatocito por difusin facilitada mediante la protena ligandina. - Conjugacin: Una vez en el hepatocito, BRB va al REL, donde se conjuga con cido glucurnico. La conjugacin tambin ocurre en rin e intestino. Esta conjugacin con glucuronato hace a la BRB ms soluble, posibilitando su secrecin al canalculo biliar por un transporte activo. Al estar la BRB conjugada, se evita que la BRB libre, liposoluble, sea reabsorbida por los canalculos biliares. La conjugacin de BRB con glucuronato est catalizada por UDP-glucorinil transferasas, que forman secuencialmente mono y diglucurnidos de BRB. Son estimuladas por fenobarbital. - Conversin a urobilingeno: BRB conjugada se vuelca en el duodeno, con la bilis. En el intestino, principalmente en el leon, las bacterias tienen una enzima (beta-glucuronidasa) que separa al glucuronato de la BRB. Entonces, la BRB se reduce a otros pigmentos, incoloros, llamados urobilingenos. Estos se excretan principalmente por las heces. Algo de urobilingeno se reabsorbe en el intestino, y va a la circulacin portal (circuito enteroheptico del urobilingeno). - Formacin de urobilinas y excrecin: Al entrar en contacto con el aire, estos compuestos se oxidan y se transforman en urobilinas, que son coloreados. Las urobilinas que se hallan en orina, heces y bilis son la d-urobilina, i-urobilina, y estercobilina. Esta ltima da el color marrn de las heces. En el meconio fetal y las heces del recin nacido se encuentran directamente BRB y biliverdina, porque carecen de las enzimas necesarias para la reduccin intestinal de la BRB. REACCIN DE VAN DER BERGH Para determinar las concentraciones de BRB libre (unida a albmina) y BRB conjugada, se usa la reaccin de van der Bergh: ante el agregado de cido sufnico diazotado, la BRB conjugada forma un complejo coloreado (reaccin directa). Por este motivo, a la BRB conjugada tambin se la llama BRB directa. La BRB libre est unida a la albmina, que impide la reaccin coloreada, hasta que es liberada por un solvente orgnico como el etanol (reaccin indirecta). Debido a esto, a la BRB libre tambin se la llama BRB indirecta. PATOLOGAS ASOCIADAS A ICTERICIA Se llama ictericia a la coloracin amarillenta de piel y mucosas, asociada a niveles de BRB plasmtica mayores a 1 mg% (valor normal 0,3 1 mg%). - Obstruccin del conducto biliar: La BRB no puede llegar al intestino, entonces no se forma urobilingeno ni estercobilina. Entonces las heces adquieren color tiza. La BRB conjugada se acumula en el hgado y pasa al plasma, donde su concentracin aumenta mucho. Esto causa que filtre por el glomrulo, dndole color marrn a la orina. Por lo tanto, la presencia de BRB en orina, sin urobilina, sugiere ictericia obstructiva. - Ictericia hemoltica y anemia hemoltica: Hay alta concentracin de urobilina en orina, y de estercobilina en las heces, que provoca su hiperpigmentacin. El hgado no puede metabolizar totalmente el exceso de BRB libre por el proceso hemoltico, aumentando entonces la BRB indirecta ms que nada, y tambin la BRB directa, pero nunca ms que la indirecta. - Ictericia fisiolgica del recin nacido: Los recin nacidos no tienen las enzimas para conjugar la BRB. Si adems el beb tiene incompatibilidad RH, se suman una hemlisis acelerada y un hgado incapaz de conjugar BRB, por lo tanto de eliminarla por las heces. Si la BRB plasmtica supera la capacidad de transporte de la albmina, BRB libre puede depositarse en el SNC causando la encefalopata txica hiperbilirrubinmica, o quernictero. BRB libre tiene alta afinidad por lpidos de membrana, especialmente en el SNC. El tratamiento es con fototerapia, que convierte a la BRB libre en ismeros ms solubles, posibilitando su excrecin. - Lesin heptica (cirrosis, hepatitis, etc.): Al daarse los hepatocitos, el hgado tiene menor capacidad de captacin de BRB libre y de conjugarla. Por lo tanto, aumenta la BRB libre. Como
las clulas daadas permiten que salgan a la sangre algunos glucornidos, tambin puede aumentar la BRB conjugada. - Sndrome de Crgiler-Najjar tipo I (ictericia congnita no hemoltica): Suele verse en nios, hay un dficit en la UDP-glucuronil transferasa, por lo que el hgado no puede conjugar BRB. El tratamiento es con fototerapia exclusivamente, ya que el fenobarbital (que en condiciones normales estimula la conjugacin) no tiene efecto, debido a la mutacin de la enzima. - Sndrome de Gilbert: Hay una baja actividad de la UDP-glucuronil transferasa, y un dficit en la captacin de BRB libre, que causa un aumento de BRB libre en plasma. - Hiperbilirrubinemia txica: Algunas drogas, el virus de la hepatitis, la cirrosis, y algunos hongos, causan falla heptica con aumento de la BRB libre. Usualmente tambin hay cierta obstruccin canalicular, que resulta en algo de aumento de la BRB conjugada. - Sndrome de Dubin-Johnson: Es un dficit en el mecanismo de secrecin de la BRB conjugada a la bilis (que es un transporte activo). La retencin de BRB hace que el hgado adquiera un color negruzco. Para testear la enfermedad se hace la prueba con bromosulfoftalena: Se inyecta el colorante, y si hay falla en la secrecin de BRB conjugada, ste refluye al plasma, indicando que hay enfermedad.
También podría gustarte
- Acceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017De EverandAcceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017Aún no hay calificaciones
- Metabolismo Del Hemo - SolDocumento6 páginasMetabolismo Del Hemo - SolOsvaldo HerraezAún no hay calificaciones
- 2 METABOLISMO de Las PorfirinasDocumento5 páginas2 METABOLISMO de Las PorfirinasEvelyn Guadalupe González BravoAún no hay calificaciones
- Porfirinas y Bilirrubinas - HarveyDocumento6 páginasPorfirinas y Bilirrubinas - HarveyJose MAún no hay calificaciones
- Porfirinas 2004Documento0 páginasPorfirinas 2004CesarAún no hay calificaciones
- Metabolismo HemeDocumento9 páginasMetabolismo Hemefialophora0210Aún no hay calificaciones
- Trabajo Final de Bioquímica II PorfiriaDocumento6 páginasTrabajo Final de Bioquímica II PorfiriaSofia BravoAún no hay calificaciones
- Secreción Biliar2Documento12 páginasSecreción Biliar2Maria Eduarda StevensAún no hay calificaciones
- Metabolismo de las porfirinas y sus defectos: las porfiriasDocumento5 páginasMetabolismo de las porfirinas y sus defectos: las porfiriasAgustin TevesAún no hay calificaciones
- Porfirinas y Pigmentos Biliares (Desgrabaci+ N)Documento7 páginasPorfirinas y Pigmentos Biliares (Desgrabaci+ N)Luisa LopezAún no hay calificaciones
- Metabolismo Grupo HEM (19-11)Documento5 páginasMetabolismo Grupo HEM (19-11)SDNKSJNDJKAún no hay calificaciones
- Sintesis y Degradacion Del HemoDocumento3 páginasSintesis y Degradacion Del HemoLeonel Carlos Rivero MamaniAún no hay calificaciones
- S23. Porfirinas y Pigmntos BiliaresDocumento28 páginasS23. Porfirinas y Pigmntos BiliaresGeraldine AnayaAún no hay calificaciones
- Porfirinas y Pigmentosbiliares (Diapositivas)Documento22 páginasPorfirinas y Pigmentosbiliares (Diapositivas)Jhusleidy España ArroyoAún no hay calificaciones
- PORFIRIA (Autoguardado) 2Documento16 páginasPORFIRIA (Autoguardado) 2Alejo ReyesAún no hay calificaciones
- Apuntes BQDocumento6 páginasApuntes BQJulissa Naomi Troya ToalaAún no hay calificaciones
- Metabolismo Del Grupo Hemo, Química y SíntesisDocumento26 páginasMetabolismo Del Grupo Hemo, Química y SíntesisBryan Pw SC TorresAún no hay calificaciones
- Porfirinas y Pigmentos BiliaresDocumento8 páginasPorfirinas y Pigmentos BiliaresPaola MoncadaAún no hay calificaciones
- Síntesis Del Grupo HemoDocumento9 páginasSíntesis Del Grupo HemoDario TaimalAún no hay calificaciones
- Grupo HemoDocumento20 páginasGrupo HemoDavid RecharteAún no hay calificaciones
- Sintesis Del Grupo Hemo 1Documento4 páginasSintesis Del Grupo Hemo 1tomasAún no hay calificaciones
- Metabolismo Del HemoDocumento3 páginasMetabolismo Del HemoMalena LaroccaAún no hay calificaciones
- Apuntes - Metabolismo de Las Porfirinas y Grupo HemoDocumento5 páginasApuntes - Metabolismo de Las Porfirinas y Grupo HemoLaura AybarAún no hay calificaciones
- Metabolismo Del Grupo HemoDocumento31 páginasMetabolismo Del Grupo HemoYaritza PinargtAún no hay calificaciones
- Catabolismo de Proteinas 2.3SPDocumento8 páginasCatabolismo de Proteinas 2.3SPDavid SanchezAún no hay calificaciones
- Las porfirinas: estructura, composición y aplicacionesDocumento55 páginasLas porfirinas: estructura, composición y aplicacionesMarín GEAún no hay calificaciones
- Proteínas 4Documento17 páginasProteínas 4Quique Villegas NavaAún no hay calificaciones
- Grupo Hemo y Porfirias.Documento32 páginasGrupo Hemo y Porfirias.Sabrina GaleanoAún no hay calificaciones
- Introducción al metabolismo del grupo hemoDocumento49 páginasIntroducción al metabolismo del grupo hemoRodrigo MullisacaAún no hay calificaciones
- Proteínas Plasmáticas e InmunoglobinasDocumento6 páginasProteínas Plasmáticas e InmunoglobinasAna FrancoAún no hay calificaciones
- Tarea Individual CalificadaDocumento8 páginasTarea Individual CalificadaYEYSON ELI SEGOVIA ZABALETAAún no hay calificaciones
- 4 Transtornos de La Biosíntesis Del HemDocumento13 páginas4 Transtornos de La Biosíntesis Del HemJael Fernandez FloresAún no hay calificaciones
- PorfirinasDocumento5 páginasPorfirinasAna Lilyam Rios BayonaAún no hay calificaciones
- Síntesis Del Grupo HemoDocumento4 páginasSíntesis Del Grupo HemoJorge Antonio Pérez Laines100% (1)
- Guia No 31Documento21 páginasGuia No 31Fernando HernandezAún no hay calificaciones
- Bioquimica en La SangreDocumento12 páginasBioquimica en La SangreMario Javier Ganoza MoralesAún no hay calificaciones
- Porfiria AnestesiaDocumento18 páginasPorfiria AnestesiaIrene Cristina100% (1)
- Metabolismo Del HemoDocumento46 páginasMetabolismo Del HemoJoham VegaAún no hay calificaciones
- Porfirinas y pigmentos biliares: importancia biomédicaDocumento34 páginasPorfirinas y pigmentos biliares: importancia biomédicaFrancisco GuerraAún no hay calificaciones
- Metabolismo de La HemoglobinaDocumento3 páginasMetabolismo de La HemoglobinaCharito Belizario ChecyaAún no hay calificaciones
- Dermatosis MetabólicasDocumento10 páginasDermatosis MetabólicasHel Es RoAún no hay calificaciones
- Anemia Sideroblastica TP 2Documento9 páginasAnemia Sideroblastica TP 2Mely MartínezAún no hay calificaciones
- Metabolismo de NucleótidosDocumento22 páginasMetabolismo de NucleótidosAngela gabriela Cometivos lescanAún no hay calificaciones
- Síntesis Del HemoDocumento8 páginasSíntesis Del HemoHenryk BazalarAún no hay calificaciones
- Hematologia. Síntesis y Degradación de Hemoglobina. UDELARDocumento39 páginasHematologia. Síntesis y Degradación de Hemoglobina. UDELARErika LoyarteAún no hay calificaciones
- Metabolismo fosfocálcico: regulación del calcio y fósforoDocumento12 páginasMetabolismo fosfocálcico: regulación del calcio y fósforoMaria Del Carmen Revi HerradAún no hay calificaciones
- Tema 9 BQ Clínica Y Patología MolecularDocumento13 páginasTema 9 BQ Clínica Y Patología MolecularMaría Karla Guerreiro GonzálezAún no hay calificaciones
- Bioquimica Médica. Aciduria OroticaDocumento10 páginasBioquimica Médica. Aciduria OroticaBeatriz A. Cázares33% (3)
- CLASE 4 - Amino Acdos, Peptidicos, ProteinaDocumento28 páginasCLASE 4 - Amino Acdos, Peptidicos, ProteinaAnonymous mAUbwzR2aBAún no hay calificaciones
- Metaolismo Grupo HemoDocumento35 páginasMetaolismo Grupo HemoClauMcClauAún no hay calificaciones
- Bilirrubina y Ácido ÚricoDocumento9 páginasBilirrubina y Ácido ÚricoL. Martin MorenoAún no hay calificaciones
- Porfirinas y Pigmentos BiliaresDocumento70 páginasPorfirinas y Pigmentos BiliaresJael Fernandez FloresAún no hay calificaciones
- Metabolismo de aminoácidos y proteínas: una guía concisaDocumento24 páginasMetabolismo de aminoácidos y proteínas: una guía concisaTeobaldoAún no hay calificaciones
- 2 Sintesis de PorfirinasDocumento6 páginas2 Sintesis de PorfirinasEvelyn Guadalupe González BravoAún no hay calificaciones
- Síntesis del grupo hemoDocumento5 páginasSíntesis del grupo hemoIngrid Alvarez AlvaradoAún no hay calificaciones
- Metabolismo de Nucleotidos.10Documento24 páginasMetabolismo de Nucleotidos.10Edwar Tarrillo Vasquez100% (1)
- BIOSINTESISDocumento8 páginasBIOSINTESISJubencio Anticona CuevaAún no hay calificaciones
- ANEMIA SeminarioDocumento8 páginasANEMIA SeminarioMARIA DLUCASAún no hay calificaciones
- Metabolismo de porfirinas en la UNJBG-TacnaDocumento41 páginasMetabolismo de porfirinas en la UNJBG-TacnaJesenia Fatima Paucar JoveAún no hay calificaciones
- Evaluación de La HemostasiaDocumento6 páginasEvaluación de La HemostasiaRUBY GALINDO SANDOVALAún no hay calificaciones
- TuberculosisDocumento3 páginasTuberculosisFREYER100% (1)
- Guía para La Elaboración Del Marco LógicoDocumento17 páginasGuía para La Elaboración Del Marco LógicoJairo Arosemena PerezAún no hay calificaciones
- Psicopatologia de La MemoriaDocumento19 páginasPsicopatologia de La MemoriaFREYERAún no hay calificaciones
- Ciclo de KrebsDocumento82 páginasCiclo de KrebsFREYERAún no hay calificaciones
- Población y Muestras en La InvestigaciónDocumento18 páginasPoblación y Muestras en La InvestigaciónFREYERAún no hay calificaciones
- Produccion Del CafeDocumento28 páginasProduccion Del CafeFREYER100% (1)
- Historia de El Derecho de Seguros en El PeruDocumento23 páginasHistoria de El Derecho de Seguros en El PeruFREYER100% (1)
- Emergencias ObstetricasDocumento20 páginasEmergencias ObstetricasFREYERAún no hay calificaciones
- El Virreinato Del PerúDocumento2 páginasEl Virreinato Del PerúFREYERAún no hay calificaciones
- RubeolaDocumento4 páginasRubeolaFREYERAún no hay calificaciones
- Como Hacer Un Proyecto PDFDocumento4 páginasComo Hacer Un Proyecto PDFFREYERAún no hay calificaciones
- Población y Muestras en La InvestigaciónDocumento18 páginasPoblación y Muestras en La InvestigaciónFREYERAún no hay calificaciones
- Control de Funciones VitalesDocumento9 páginasControl de Funciones VitalesFREYERAún no hay calificaciones
- Guia para La Administracion Segura de MedicamentosDocumento92 páginasGuia para La Administracion Segura de MedicamentosEfrén Atilano NolascoAún no hay calificaciones
- Primeros AuxiliosDocumento18 páginasPrimeros AuxiliosFREYERAún no hay calificaciones
- HemorragiasDocumento16 páginasHemorragiasFREYERAún no hay calificaciones
- Origen y Evolución Del HombreDocumento8 páginasOrigen y Evolución Del HombreFREYERAún no hay calificaciones
- 2ENZIMAS-I y IIDocumento39 páginas2ENZIMAS-I y IIFREYERAún no hay calificaciones
- Adaptación pulmonar a la altitudDocumento2 páginasAdaptación pulmonar a la altitudFREYERAún no hay calificaciones
- Glucolisis PDFDocumento3 páginasGlucolisis PDFEstefania Arizaga100% (1)
- METODOLOGIADocumento15 páginasMETODOLOGIAFREYERAún no hay calificaciones
- Valores de Referencia InmunoglobulinaDocumento5 páginasValores de Referencia InmunoglobulinaFREYERAún no hay calificaciones
- Biogénesis de RibosomasDocumento2 páginasBiogénesis de RibosomasFREYERAún no hay calificaciones
- Núcleo CelularDocumento11 páginasNúcleo CelularFREYERAún no hay calificaciones
- Manual HematologiaDocumento87 páginasManual Hematologiamiguel angel99% (192)
- Curso EKGDocumento54 páginasCurso EKGdra.hadley100% (7)
- La Aplicaciones A La MedicinaDocumento5 páginasLa Aplicaciones A La MedicinaFREYERAún no hay calificaciones
- II MacromoleculasDocumento42 páginasII MacromoleculasFREYERAún no hay calificaciones
- Hemo, Hierro y PorfiriasDocumento5 páginasHemo, Hierro y PorfiriasFREYERAún no hay calificaciones
- Primer Parcial Estomatologia 2019Documento3 páginasPrimer Parcial Estomatologia 2019Judith PalominoAún no hay calificaciones
- Cuál Es El Momento Indicado para TenerDocumento10 páginasCuál Es El Momento Indicado para TenerYeison castañoAún no hay calificaciones
- Dieta EquilibradaDocumento2 páginasDieta EquilibradaJose Diego PortugalAún no hay calificaciones
- Sedimento UrinarioDocumento10 páginasSedimento UrinarioEsmeraldaAún no hay calificaciones
- Percepción OlfativaDocumento15 páginasPercepción OlfativaFlamingAún no hay calificaciones
- Resveratrol PDFDocumento70 páginasResveratrol PDFMonicaAún no hay calificaciones
- Lesiones Nervios PerifericosDocumento56 páginasLesiones Nervios PerifericosStuart M.100% (1)
- CAPRINOMETRIADocumento5 páginasCAPRINOMETRIAEdson SaavedraAún no hay calificaciones
- Enfermedades de Transmisión SexualDocumento25 páginasEnfermedades de Transmisión SexualClaudia Suárez100% (1)
- Via IntradermicaDocumento22 páginasVia IntradermicaApril LP68% (19)
- El ácido alendrónico y su relación con la esofagitisDocumento29 páginasEl ácido alendrónico y su relación con la esofagitisaprolabgpAún no hay calificaciones
- Cirugia PulmonarDocumento10 páginasCirugia PulmonarErick Incio EsquivesAún no hay calificaciones
- INTRODUCCION-plexo BraquialDocumento7 páginasINTRODUCCION-plexo Braquialmayra894100% (1)
- ENFOQUE DEL MÉTODO DE BRUNNSTROM TotaDocumento73 páginasENFOQUE DEL MÉTODO DE BRUNNSTROM TotaGladis Pinto Mamani67% (6)
- Genética Médica para Médicos VeterinariosDocumento214 páginasGenética Médica para Médicos Veterinariosjm_garciap100% (1)
- Tumores Benignos de OvarioDocumento30 páginasTumores Benignos de OvarioMontse LuqueñoAún no hay calificaciones
- Anomalías Del PuerperioDocumento19 páginasAnomalías Del PuerperioDeisy Marcela Reyes ParraAún no hay calificaciones
- Ecologia de Los Sentidos ETOLOGIADocumento9 páginasEcologia de Los Sentidos ETOLOGIAMariaMarianaCortez0% (1)
- Trauma AbdominalDocumento33 páginasTrauma AbdominalAndrés Eduardo Reyes BelandriaAún no hay calificaciones
- Lectura #5Documento2 páginasLectura #5adri ramirezAún no hay calificaciones
- CircuncisiónDocumento29 páginasCircuncisiónGutiérrez CarlosAún no hay calificaciones
- Heridas MonografiasDocumento13 páginasHeridas MonografiasEveliaColalaClavoAún no hay calificaciones
- Enfermedades Digestivas en El AncianoDocumento28 páginasEnfermedades Digestivas en El AncianoTAnia Gordillo100% (1)
- Crónica de una adicción al fentanylDocumento13 páginasCrónica de una adicción al fentanylCarlos Bohorquez50% (2)
- Farmacos Hemostaticos y AnticoagulantesDocumento35 páginasFarmacos Hemostaticos y AnticoagulantesStephanie Alvarenga75% (4)
- Clase HTPDocumento21 páginasClase HTPapi-3703544100% (1)
- La Cueva TreintaDocumento125 páginasLa Cueva TreintaMelquíades Pérez PérezAún no hay calificaciones
- Informe Cientifico Sobre La Comunicación Materno-Filial en El Embarazo.Documento19 páginasInforme Cientifico Sobre La Comunicación Materno-Filial en El Embarazo.copyfree100% (5)
- Micosis Sistémicas o ProfundasDocumento28 páginasMicosis Sistémicas o ProfundasAna Yautibug0% (1)
- Meningitis Y EpilepsiaDocumento19 páginasMeningitis Y EpilepsiaAngela Mavarez0% (1)