Documentos de Académico
Documentos de Profesional
Documentos de Cultura
UNIDAD 1 Trabajo de Termodinamica
Cargado por
Martha MatuteDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
UNIDAD 1 Trabajo de Termodinamica
Cargado por
Martha MatuteCopyright:
Formatos disponibles
TERMODINAMICA
PRESENTADO POR: MARTHA LIGIA MATUTE PEUELA COD: 37580423
ACT 2 RECONOCIMIENTO GENERAL Y DE ACTORES PARTE INDIVIDUAL
TUTOR: VICTOR JAIRO FONSECA VIGOYA
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD PROGRAMA INGENIERIA INDUSTRIAL BARRANCABERMEJA SANTANDER 2013
CONTENIDO PAGINAS INTRODUCCIN..3 OBJETIVOS4 OBJETIVOS GENERALES..4 OBJETIVOS ESPECFICOS4 RESUMEN DE LOS CONCEPTOS PRINCIPALES.5 CONCLUSIONES..12 BIBLIOGRAFA...13
INTRODUCCION La termodinmica es la ciencia que estudia la energa y sus transformaciones, principalmente la transformada en trabajo, por otro lado en todo proceso fsico o qumico, en nuestra vida laboral y cotidiana existen interacciones energticas que podemos estudiar atreves de la termodinmica Tambin conoceremos cada una de las unidades del mdulo con sus respectivos captulos, lecciones adems como est formado el curso de termodinmica.
OBJETIVO GENERAL Reconocer y hacer un estudio detallado de la termodinmica y cada una de sus aplicaciones.
OBEJTIVOS ESPECIFICOS Identificar las dos unidades que tratara el curso, as mismo como cada uno de sus captulos y lecciones. Cumplir con lo especificado por la gua de actividades Reconocer las ecuaciones principales del modulo
UNIDAD 1 LEY CERO, TRABAJO Y PRIMERA LEY DE LA TERMODINMICA.
CAPTULO 1: LEY CERO DE LA TERMODINMICA.
Leccin 1: Sistema Desde el punto de vista termodinmico es cualquier regin o parte de una materia del universo que se quiera estudiar. El sistema lo define el observador de acuerdo a lo que se requiera estudiar. O analizar desde el punto de vista energtico. Sistemas termodinmicos: sistemas abiertos, cerrados y aislados, estado, equilibrio, procesos, procesos termodinmicos. Leccin 2: Ley cero de la Termodinmica La ley cero de la termodinmica establece que si dos cuerpos se encuentran en equilibrio trmico con un tercero, los dos se encontrarn en equilibrio trmico entre s, esta ley define entonces la temperatura y nos permite afirmar que la temperatura es la propiedad comn a todos los sistemas que se encuentren en equilibrio trmico.
Leccin 3: Calor Es la forma de energa que se transmite a travs del lmite de un sistema que est a una temperatura a otro sistema (o al medio exterior) a una temperatura ms baja, por virtud de la diferencia de temperatura entre los dos sistemas. Leccin 4: Ecuacin de Estado El estado de una sustancia pura se describe en funcin de propiedades intensivas como P v y T, las cuales se relacionan mediante ecuaciones conocidas generalmente como ecuaciones de estado. La ms sencilla de ellas es la muy conocida ecuacin de estado de gas ideal, denominada as porque todo gas cuyas propiedades cumplan con esta relacin se considera que tiene un comportamiento ideal. Leccin 5: Ecuacin de Redlich- Kwong Ecuacin de Redlich - Kwong Soave, Ecuaciones de estado de virial, aplicaciones en la industria de alimentos para sus procesos de transformacin y conservacin de ellos.
CAPTULO 2: TRABAJO.
Leccin 6: TRABAJO El trabajo es una forma particular de energa que corresponde a una magnitud escalar definida como el producto punto de dos magnitudes vectoriales: la fuerza y el desplazamiento realizado en la misma direccin de la fuerza. Leccin 7: DIAGRAMAS TERMODINMICOS Son representaciones en coordenadas cartesianas de las propiedades de un sistema durante el transcurso de un proceso. Se utilizan para visualizar, predecir o analizar los cambios producidos en la medida en que ocurren diferentes procesos termodinmicos. Leccin 8: DIAGRAMA PV, DIAGRAMAS PT, DIAGRAMAS TV, DIAGRAMAS P-V-T Diagrama Pv: Es el estudio del equilibrio entre fases es el volumen especfico, definido por la relacin entre el volumen y la masa de una sustancia pura en cada fase. Diagramas PT: Se trata de una lnea curva de pendiente positiva; una representacin esquemtica de esta lnea para cualquier sustancia pura. Diagramas Tv: Es muy similar al diagrama Pv con la diferencia que las lneas isbaras tienen pendientes positivas tanto en la regin de lquido comprimido como en la regin de vapor sobrecalentado ya que el volumen especfico aumenta con la temperatura. Leccin 9: PROPIEDADES TERMODINMICAS Caractersticas relacionadas con la energa que posee el sistema termodinmico en un determinado estado. Subconceptos: Propiedades intensivas y extensivas, Trayectorias, Funciones de punto y funciones de trayectoria. Intensivas: si no dependen de la masa del sistema Extensivas: si dependen de la masa o extensin del sistema. Trayectorias: A la serie de estados intermedios y sucesivos por los que pasa un sistema para ir de un estado a otro Funciones de punto y funciones de trayectoria: El comprender esta diferencia facilita entender la forma particular de calcular el valor del cambio de las propiedades de un sistema durante una secuencia de procesos y cmo expresar y calcular las cantidades de calor o trabajo intercambiadas entre el sistema y los alrededores durante esos procesos. Leccin 10: CAPACIDAD CALORFICA Es la cantidad de calor transferida que es capaz de modificar su temperatura en un grado. Por tanto, la relacin entre el calor transferido a un sistema y la diferencia de temperatura que ocasiona, constituye la capacidad calorfica
CAPITULO 3: PRIMERA LEY DE LA TERMODINAMICA
Leccin 11: PRIMERA LEY DE LA TERMODINMICA Establecer una relacin entre el calor y el trabajo y definir una importante propiedad termodinmica como es la energa. La energa puede atravesar las paredes de un sistema en forma de calor. Leccin 12: ENTALPIA Propiedad que se representa por la letra H y se define mediante la siguiente ecuacin: H = U + PV La entalpa es una funcin termodinmica, por tanto la variacin de entalpa es independiente del proceso, y se puede calcular teniendo en cuenta el estado final e inicial, su diferencial es exacta y por consiguiente su integral cclica es cero. Estado de Referencia: Se define para los elementos qumicos (hidrgeno, helio, carbono, sodio, etc.) a la temperatura de 25C y a la presin de una atmsfera. Se dice que en estas condiciones su entalpa es nula. Leccin 13: PRIMERA LEY Y REACCIONES QUMICAS Es la transformacin de las sustancias reactantes en otras de naturaleza completamente distinta que se conocen como productos, durante la reaccin se presentan cambios energticos que si el sistema reactante se encuentra aislado trmicamente se manifiestan en un aumento o un descenso de la temperatura. Leccin 14: LEY DE HESS El qumico ruso Germain Henry Hess enunci en 1840 que el cambio de entalpa en una reaccin qumica es igual tanto si la reaccin se realiza en una sola etapa o en varias etapas consecutivas. Leccin 15: CALOR INTEGRAL DE DISOLUCIN Al cambio de entalpa cuando un mol de soluto se disuelve en n moles de solvente a una temperatura de 25C y presin de 1 atmsfera se le denomina calor integral de solucin y se representa generalmente como H s. El valor numrico del calor de disolucin depende por lo tanto del nmero de moles de solvente n.
UNIDAD 2 SEGUNDA LEY Y APLICACIONES DE LA TERMODINMICA CAPTULO 4 SEGUNDA LEY DE LA TERMODINMICA. Leccin 16: APLICACIN DE LA PRIMERA LEY EN GASES IDEALES
Energa Interna como funcin de la temperatura. Experimento de joule, Procesos Adiabticos para un Gas Ideal. Leccin 17: SEGUNDA LEY DE LA TERMODINMICA Enunciado KELVIN-PLANCK Establece que es imposible construir un dispositivo que funcionando en forma cclica su nico efecto sea convertir completamente en trabajo todo el calor procedente de una fuente trmica. El proceso cclico de la mquina de Carnot se conoce como el ciclo de Carnot y su fundamento es el siguiente: trabaja con dos focos de diferente temperatura T y el proceso es totalmente reversible. Leccin 18: SEGUNDA LEY DE LA TERMODINMICA (CONTINUACIN) El refrigerador de carnot, es el proceso contrario al ciclo de carnot que vimos anteriormente y es el proceso de refrigeracin. En la refrigeracin sucede exactamente lo contrario, esto es, se toma calor de un foco fro, se le suministra trabajo al sistema y estas dos energas se ceden a un foco caliente. Leccin 19: ENTROPA El aumento total de la entropa es una medida de la prdida de capacidad para efectuar trabajo. La segunda ley de la termodinmica indica que el calor no puede ser convertido ntegramente en trabajo; siempre habr una fraccin de calor cedida a los alrededores o a otro sistema, segn sea el caso, este calor cedido determina el aumento de entropa Leccin 20: ENTROPA (CONTINUACIN) CALENTAMIENTO IRREVERSIBLE DE UN SISTEMA TERMODINMICO expansin libre de un gas ideal, mezcla de dos gases ideales, clculo de entropa en procesos irreversibles, significado y uso de la funcin termodinmica entropa.
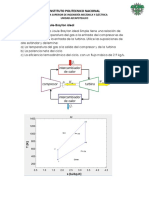
CAPTULO 5 CICLOS TERMODINMICOS. Leccin 21: LA MQUINA DE VAPOR. CICLO DE RANKINE Es aquella donde la generacin del calor se realiza dentro del mismo dispositivo donde se produce la expansin de los gases que genera el trabajo. A este tipo de mquinas pertenecen el motor a gasolina y el motor Diesel. Mquinas de combustin interna: Las mquinas que transforman el calor en trabajo mecnico se diferencian en la forma y lugar donde se genera el calor, para despus ser convertido en movimiento. Leccin 22: MOTORES DE CUATRO TIEMPOS. CICLO DE OTTO El motor de cuatro tiempos fue desarrollado por N.A. Otto, un ingeniero alemn, que en el ltimo tercio del siglo pasado construy la primera mquina con este tipo de motor. Debido al xito alcanzado, el ciclo termodinmico que describe su proceso se conoce con el nombre de ciclo de Otto.
Leccin 23: MOTORES DE IGNICIN POR COMPRESIN. CICLO DIESEL El factor limitante del motor de cuatro tiempos era el valor de la relacin de compresin, necesario para evitar la auto ignicin de la mezcla. Podramos obviar este problema comprimiendo solamente aire y en el momento de su mxima compresin inyectar el combustible para que suceda la combustin y el pistn realice la carrera de trabajo. Leccin 24: CICLO DE BRAYTON Los motores de las turbinas de gas utilizadas en plantas generadoras de corriente elctrica o en la propulsin de aeronaves funcionan mediante el ciclo de Brayton, el cual como en los ciclos estudiados anteriormente, tambin consta de cuatro etapas internamente reversibles. Leccin 25: MQUINAS FRIGORFICAS El caso de una mquina refrigerante podramos decir que es todo lo contrario del motor trmico. La mquina refrigerante o frigorfica utiliza una fuente de en erga externa, generalmente corriente elctrica como en el caso de una nevera o refrigerador comn, para quitar calor de una fuente fra (enfriar) y drselo a una fuente caliente
CAPTULO 6: APLICACIONES DE LA TERMODINMICA Leccin 26: ANLISIS DIMENSIONAL SISTEMA DE UNIDADES Se utilizara es el Sistema Internacional de Unidades (SI)y, tambin otras unidades como: Unidades derivadas del sistema SI que tienen nombres y smbolos especiales, Prefijos del sistema SI, Fracciones y mltiplos decimales que tienen nombre especial en el sistema SI, Unidades no pertenecientes al sistema SI, Valores de la constante de los gases R, en la ecuacin P.V =n.R.T, expresado en funcin de las unidades de producto R.V
Leccin 27: APLICACIN DE LAS LEYES DE LA TERMODINMICA A PROCESOS DE FLUJO CONTINUO CONSERVACIN DE MASA Y VOLUMEN DE CONTROL Un volumen de control es un volumen en el espacio que su tamao y forma son totalmente arbitrarios y estn delimitados de la manera que mejor convenga para el anlisis por efectuar. Leccin 28: APLICACIONES DE LA TERMODINMICA A PROCESOS DE FLUJO ESTABLE En un volumen de control con flujo estable, la masa se mantiene constante con el tiempo, de tal manera que la cantidad de materia que entra al sistema en un intervalo de tiempo dado, debe ser igual a la cantidad de materia que sale del sistema.
Leccin 29: APLICACIN DE LAS LEYES DE LA TERMODINMICA A PROCESOS DE FLUJO ESTABLE (CONTINUACIN) BOMBAS, COMPRESORES, TURBINAS Y VENTILADORES Estos equipos tienen en comn que su proceso termodinmico involucra trabajo de eje ya sea que se realice trabajo sobre el sistema elegido como en el caso de bombas, compresores o ventiladores o bien que el sistema realice trabajo como en las turbinas. Leccin 30: APLICACIN DE LAS LEYES DE LA TERMODINMICA A PROCESOS DE FLUJO TRANSITORIO En un proceso de flujo transitorio al contrario del proceso de flujo estable se presentan cambios en las propiedades del sistema con el tiempo, El intercambio de materia y energa del volumen de control con el medio exterior o alrededores se evala teniendo como referencia un determinado intervalo de tiempo. ECUACIONES . Celsius a Fahrenheit: Tf=1.8*Tc+32 Celsius a Kelvin: Tk=Tc+273.15 . Fahrenheit a Rankine: R=F+459.67 Gases Ideales:PV=nRT . Ley de Boyle: PoVo=Pf-Vf Gases reales:Z=VrealVideal . Videal=RTP Van Der Waals:P=RTv-b-av2 . Redlich Kwong:P=RTv-b-avv+bT0.5 . Redlich Kwong Soave:P=RTv-b-avv+bT0.51+m1-TTc22 . Estado virial: PVRT=A0+A2P2+A3P3+ . Ecuacin: PVRT=B0B1V+B2V2+B3V3+ . Trabajo: W =12PdV Capacidad calrica:C=QdT . Capacidad calrica a presin constante:Cp=HTp . Calor especifico a presin constante:Cp=HmTp=HTp . Primera ley de Termodinmica: Q-W Entalpia:H=U+pV . Proceso adiabtico para un gas ideal: W =dU=n.Cv.dT . Eficiencia de una maquina trmica: =Qc-QfQc==1-QfQc . Primer principio de la termodinmica: U=Q+W
. Coeficiente de operacin COP:COP=QfWs . Compresin adiabtica: Hb=Ha+U.dP . Eficiencia del ciclo de Brayton:=1-1rp-1 . Ecuacin para determinar flujos masivos:mA.h1-h2=mB.h2-h1 . Coeficiente de joule Thomson: =TPH . Ley conservacin de la masa:m1.+m2.=m3. . Ley conservacin de energa: m1.h1+m2.h2=m3.h3 . Ecuacin fluidos incompresibles: Q-W=ec+ep+CpT+VP . Ecuacin de potencia: P=m.W
CONCLUSIONES Concluyendo este trabajo podemos decir que fue de gran ayuda para hacer el reconocimiento del curso y para tener un concepto claro y especfico de lo que es la termodinmica. Llegando as a la conclusin que la termodinmica es pieza clave para el desarrollo tecnolgico en la industria y Por otro lado este trabajo nos permiti conocer la forma en la cual est estructurado el curso y como ser evaluado los conocimientos por parte del estudiante.
BIBLIOGRAFIA Modulo: (2009). Termodinmica UNAD Protocolo termodinmica
También podría gustarte
- Metodo SinteticoDocumento7 páginasMetodo SinteticoMartha MatuteAún no hay calificaciones
- Logica Matematica PDFDocumento219 páginasLogica Matematica PDFKendra100% (4)
- Trabajo Salud OcupacionalDocumento10 páginasTrabajo Salud OcupacionalMartha MatuteAún no hay calificaciones
- Punto 1 ContabilidadDocumento6 páginasPunto 1 ContabilidadMartha MatuteAún no hay calificaciones
- El ErizoDocumento1 páginaEl ErizoMartha MatuteAún no hay calificaciones
- Logica Matematica PDFDocumento219 páginasLogica Matematica PDFKendra100% (4)
- Telematic As 2Documento5 páginasTelematic As 2Enrique Posada PaezAún no hay calificaciones
- Anexo - 1 ErgonomiaDocumento10 páginasAnexo - 1 ErgonomiaMartha MatuteAún no hay calificaciones
- Herramientas TelematicasDocumento2 páginasHerramientas TelematicasMartha MatuteAún no hay calificaciones
- Salud Ocupacional 1Documento8 páginasSalud Ocupacional 1Martha MatuteAún no hay calificaciones
- Guia de Actividades Reconocimiento 2013 II TermodinamicaDocumento3 páginasGuia de Actividades Reconocimiento 2013 II TermodinamicaMartha MatuteAún no hay calificaciones
- Herramientas TelematicasDocumento2 páginasHerramientas TelematicasMartha MatuteAún no hay calificaciones
- CupcakeDocumento5 páginasCupcakeMartha MatuteAún no hay calificaciones
- Herramientas TelematicasDocumento2 páginasHerramientas TelematicasMartha MatuteAún no hay calificaciones
- Formato Guia de Actividades y Rubrica de Evaluacion-ReconocimientoDocumento3 páginasFormato Guia de Actividades y Rubrica de Evaluacion-ReconocimientoKarlita SalazarAún no hay calificaciones
- Delitos InformaticosDocumento4 páginasDelitos Informaticosdhoritha9180Aún no hay calificaciones
- Capitulo 1 y 2 Administracion de Operaciones SabirnaDocumento7 páginasCapitulo 1 y 2 Administracion de Operaciones SabirnaMartha MatuteAún no hay calificaciones
- Capitulo 4 SabirnaDocumento6 páginasCapitulo 4 SabirnaMartha MatuteAún no hay calificaciones
- TurbinasDocumento251 páginasTurbinasRolando RodriguezAún no hay calificaciones
- TFG - Jaime Rodriguez ReyDocumento69 páginasTFG - Jaime Rodriguez ReyJaime Rodríguez ReyAún no hay calificaciones
- Curso Material Turbinas de GasDocumento67 páginasCurso Material Turbinas de GasAntonio Jose OropezaAún no hay calificaciones
- Peak Shaving FinalDocumento58 páginasPeak Shaving FinalAlexis Rkrdo Gonzales Pinto100% (1)
- Motores y Turbinas II - Plan de Trabajo 2021Documento6 páginasMotores y Turbinas II - Plan de Trabajo 2021Wilder MamaniAún no hay calificaciones
- Exposicion Ciclos TermodinamicosDocumento61 páginasExposicion Ciclos TermodinamicosJimmy Erick Luque MamaniAún no hay calificaciones
- Tesis Mah Ugma (Reparado)Documento136 páginasTesis Mah Ugma (Reparado)negrveAún no hay calificaciones
- Turbomaquinas Tema 1 Introduccion A Las TurbomaquinasDocumento47 páginasTurbomaquinas Tema 1 Introduccion A Las TurbomaquinasMariangela NavaAún no hay calificaciones
- Lab3 Termodinamica 2Documento18 páginasLab3 Termodinamica 2Cristhian MatAún no hay calificaciones
- Problemas de Ciclos A GasDocumento3 páginasProblemas de Ciclos A GasHenry Chavez Arias0% (1)
- Ciclo Brayton - El Ciclo Ideal para Los Motores de Turbina de GasDocumento4 páginasCiclo Brayton - El Ciclo Ideal para Los Motores de Turbina de GasAprender20Aún no hay calificaciones
- CICLOS DE POTENCIA DE GASDocumento2 páginasCICLOS DE POTENCIA DE GASJuan Perez SoliñoAún no hay calificaciones
- Thermodynamic Analysis of A Combined Brayton and Rankine Cycle Based On Wind Turbine 2090 4541 1000203Documento7 páginasThermodynamic Analysis of A Combined Brayton and Rankine Cycle Based On Wind Turbine 2090 4541 1000203Eduardo Geraldo Flores MartinezAún no hay calificaciones
- Brayton Con Interenfriamiento, Recalentamiento y RegeneraciónDocumento5 páginasBrayton Con Interenfriamiento, Recalentamiento y RegeneraciónAlvaro ChacònAún no hay calificaciones
- Ciclos de Potencia Sin Cambio de FaseDocumento5 páginasCiclos de Potencia Sin Cambio de Fasejorge valverde olivaAún no hay calificaciones
- Seminario N°2 - Ingeniería de Procesos 2022-1Documento4 páginasSeminario N°2 - Ingeniería de Procesos 2022-1Juan IzarraAún no hay calificaciones
- Cuestionario Termo UnadDocumento60 páginasCuestionario Termo UnadJuan Carlos Moreno Ortiz100% (1)
- El Ciclo BraytonDocumento21 páginasEl Ciclo BraytonLeonel Suarez AlejandroAún no hay calificaciones
- Fundamentos turbINAS ADocumento32 páginasFundamentos turbINAS ACarlos J Alvarado MAún no hay calificaciones
- Termodinamica Act1 - Act9Documento37 páginasTermodinamica Act1 - Act9Carlos Carvajal100% (1)
- MAQUINAS TERMICAS - Ciclo de Brayton teórico y real en turbinas de gasDocumento50 páginasMAQUINAS TERMICAS - Ciclo de Brayton teórico y real en turbinas de gasMatiasAún no hay calificaciones
- 1 t2 Maquinas Termicas 18-19 PDFDocumento25 páginas1 t2 Maquinas Termicas 18-19 PDFRubén Barroso BlazqezAún no hay calificaciones
- Termo 2.1Documento10 páginasTermo 2.1Kevin DieguezAún no hay calificaciones
- Problemas Ciclo Joule-BraytonDocumento12 páginasProblemas Ciclo Joule-BraytonEduardoCatañoGonzález100% (1)
- Ciclos TermodinamicosDocumento12 páginasCiclos TermodinamicosJade ChuiAún no hay calificaciones
- Termodinamica Ii PDFDocumento3 páginasTermodinamica Ii PDFARLENA BRACHOAún no hay calificaciones
- Grupo 1 (Turbinas de Gas)Documento56 páginasGrupo 1 (Turbinas de Gas)Eduv Torres GutierrezAún no hay calificaciones
- Ciclos TermodinámicosDocumento26 páginasCiclos TermodinámicosJonathan Largo94% (18)
- Informe de La Segunda Ley de TermodinamicaDocumento45 páginasInforme de La Segunda Ley de TermodinamicaCristhian Ruiz Idrogo100% (1)