Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Frontotemp 0 Oral
Cargado por
Lu OrdóñezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Frontotemp 0 Oral
Cargado por
Lu OrdóñezCopyright:
Formatos disponibles
REVISIN
Clasificacin clnica y biomolecular de las demencias frontotemporales. Revisin de la bibliografa
M.E. Toribio-Daz, J. Morera-Guitart
CLASIFICACIN CLNICA Y BIOMOLECULAR DE LAS DEMENCIAS FRONTOTEMPORALES. REVISIN DE LA BIBLIOGRAFA Resumen. Introduccin. El trmino demencia lobar frontotemporal (DLFT) agrupa un conjunto de enfermedades neurodegenerativas muy heterogneo en su expresin clnica, componente gentico y caractersticas histopatolgicas, lo que tradicionalmente ha dificultado su estudio y clasificacin. Los pacientes presentan de forma habitual un cambio progresivo en su conducta asociado a alteracin del lenguaje y prdida de memoria, lo que constituye la segunda causa de demencia en personas menores de 65 aos. La caracterstica ms relevante a nivel histopatolgico es la presencia de agregados o acmulos de protenas anmalas en las neuronas o la gla, cuya identificacin ha contribuido, por una parte, al conocimiento de los mecanismos patognicos y, por otra, ha permitido la clasificacin de este tipo de demencia. Desarrollo y conclusiones. En las dos ltimas dcadas, se ha producido un notable progreso en el conocimiento de este grupo de enfermedades, gracias a los avances genticos relacionados con el descubrimiento del gen MAPT y el gen de la progranulina, as como de sus mutaciones, responsables de un porcentaje elevado de las DLFT hereditarias; igualmente, el desarrollo de nuevas tcnicas inmunohistoqumicas ha permitido caracterizar algunas protenas anmalas, como la protena TDP-43, como principal integrante de las inclusiones neuronales en las DLFT tau negativas. Todo ello ha permitido establecer una nueva clasificacin de las DLFT. En el presente trabajo se realiza una revisin exhaustiva de dichos avances, adems de considerar las posibles correlaciones clnicas, histolgicas, genticas y biomoleculares de los distintos subtipos de DLFT. [REV NEUROL 2008; 47: 588-98] Palabras clave. Clasificacin. Demencia frontotemporal. Progranulina. Tardopatas. Taupatas. TDP-43. Ubiquitinopatas.
INTRODUCCIN El trmino demencia lobar frontotemporal (DLFT) alude a un grupo de enfermedades neurodegenerativas muy heterogneo por su presentacin clnica, componente gentico y caractersticas histopatolgicas. Constituye la tercera causa de demencia degenerativa, despus de la enfermedad de Alzheimer (EA) y la demencia con cuerpos de Lewy; la segunda en personas menores de 65 aos. La edad de comienzo se sita entre los 45 y los 65 aos, y presenta una distribucin similar entre hombres y mujeres, con una historia familiar positiva entre un 30-45% de los casos [1]. Clnicamente, se caracteriza por alteracin del comportamiento con cambio en la personalidad, alteracin de la conducta social y afectacin del lenguaje [2]. De forma adicional, algunos pacientes pueden presentar un cuadro de parkinsonismo o de enfermedad de motoneurona asociados [3]. El concepto de DLFT pone de manifiesto la marcada atrofia de los lbulos frontales y temporales asociada a prdida neuronal y gliosis. PERSPECTIVA HISTRICA El conocimiento moderno de las DLFT podemos situarlo el ao 1892, cuando Arnold Pick realiz la descripcin de un paciente varn de 71 aos con un cuadro progresivo de deterioro mental al que se asociaba una afasia grave, en cuya necropsia se pudo constatar una marcada atrofia cortical del lbulo temporal izquierdo. La importancia de este paciente vino determinada por ser la primera vez en plantearse la posibilidad de un sndrome
Aceptado tras revisin externa: 14.10.08. Unidad de Neurologa de la Conducta y Demencias (CDP-ALZ). Hospital San Vicente. San Vicente del Raspeig, Alicante, Espaa. Correspondencia: Dra. M. Elena Toribio Daz. Unidad de Neurologa de la Conducta y Demencias (CDP-ALZ). Hospital San Vicente. Lillo Juan, 137. E-03690 San Vicente del Raspeig (Alicante). E-mail: etoribiod@hotmail.com 2008, REVISTA DE NEUROLOGA
demencial originado por una atrofia cerebral focal, y no por una atrofia generalizada segn las tendencias de la poca. En los aos siguientes, continuaron las descripciones de pacientes similares por parte de diferentes autores (Pick, Liepmann, Stransky y Spielmeyer), si bien se consideraron formas atpicas de EA. En 1911, el propio Alois Alzheimer realiz la descripcin de las alteraciones histolgicas que se encontraban en estos casos, denominndolas cuerpos y clulas de Pick. Gans (1923) y Onari y Spatz (1926) fueron los primeros en utilizar el trmino enfermedad de Pick. Por su parte, Carl Schneider, en 1927, describi las tres fases clnicas que caracterizan este tipo de demencia: alteracin inicial del juicio y la conducta, aparicin de sntomas focales como la afasia y desarrollo posterior de una demencia generalizada. En los aos siguientes se perdi el inters por la enfermedad de Pick y se consider una variante de la EA [4]. A partir de los aos ochenta renace de nuevo el inters por esta entidad: Lund, Brun y Gustafson la denominaron degeneracin lobar frontotemporal [5,6], y Neary et al, demencia de tipo frontal [7]. Paulatinamente, se fueron aadiendo nuevas entidades clinicopatolgicas a este heterogneo grupo de demencias tipo no Alzheimer, como la degeneracin corticobasal, la DLFT con parkinsonismo o la DLFT asociada a enfermedad de motoneurona. En 1982, Mesulam [8] describi una serie de pacientes con un trastorno del lenguaje en forma de afasia lentamente progresiva sin afectacin cognitiva o conductual, al que denomin afasia lentamente progresiva sin demencia. Con la evolucin de la enfermedad, estos pacientes acabaron desarrollando una demencia de tipo frontal, como se pudo comprobar posteriormente. En 1989, Snowden et al [9] describieron la demencia semntica como un cuadro de afasia progresiva causado por un dficit selectivo en la memoria semntica, y se completaron as los cuadros clnicos principales de la DLFT. No obstante, es en los ltimos 20 aos donde se sita el mayor progreso en la investigacin en este tipo de demencia, gracias, en primer lugar, a los avances genticos con el descubri-
588
REV NEUROL 2008; 47 (11): 588-598
DEMENCIAS FRONTOTEMPORALES
miento del gen MAPT [10] y el gen de la progranulina (PGRN) [11,12], as como de sus mutaciones, responsables de un porcentaje elevado de las DLFT hereditarias; en segundo lugar, al desarrollo de nuevas tcnicas inmunohistoqumicas con la deteccin de la protena TDP-43 [13] como principal integrante de las inclusiones neuronales en las DLFT tau negativas; y, finalmente, al desarrollo de nuevas tcnicas de neuroimagen, como la resonancia magntica funcional, la tomografa simple por emisin de fotn nico o la tomografa por emisin de positrones [14]. OBJETIVO El objetivo de nuestro trabajo es la revisin de los avances ms importantes descritos recientemente en la bibliografa en relacin con el conocimiento del grupo de DLFT, condensar toda esta informacin de una forma ordenada en un texto que refleje el estado del arte en esta materia, y proponer una clasificacin inteligible desde un punto de vista clnico, gentico e histolgico de este grupo de enfermedades. FENOTIPOS CLNICOS La caracterstica principal de la DLFT es su gran heterogeneidad, lo que, a nivel clnico, se traduce en la existencia de varios sndromes con unos sntomas comunes, como son los cambios en la personalidad o en la conducta social del paciente asociados a una afectacin del lenguaje. Se describen tres subtipos clnicos principales en funcin de la predominancia de cada uno de estos sntomas o de su momento de aparicin a lo largo de la evolucin de la enfermedad: demencia frontotemporal variante frontal (DFT), demencia semntica y afasia primaria progresiva no fluente (APPNF) [2]. La DFT constituye el sndrome clnico ms frecuente. Su caracterstica principal es un cambio insidioso en la personalidad del paciente, que adopta un comportamiento inusual como si fuera otra persona, o, por el contrario, acenta de manera ostensible ciertos rasgos de su carcter. Las alteraciones son variables y dependen de las reas prefrontales afectas [15], conformando tres sndromes prefrontales o frontosubcorticales tpicos: Dorsolateral: tipo disejecutivo, pseudodepresivo o de la convexidad dorsal. Orbitomedial, orbitofrontal: tipo desinhibido, tipo pseudomanaco o tipo pseudopsicoptico. Mesiofrontal: tipo aptico, hipocintico o de la circunvolucin cingulada. El cuadro clnico en la DFT se completa con una prdida progresiva de la capacidad para la expresin del lenguaje con ecolalia, perseveracin y alteracin tanto de la nominacin como de la escritura. De forma tpica, se produce una preservacin de la memoria hasta etapas algo ms avanzadas. En la demencia semntica se produce una desintegracin de la base de conocimientos que sostienen el lenguaje, la memoria semntica, por lo que los pacientes son incapaces de reconocer los objetos, hechos, palabras o su significado. Dado que los aspectos fonolgicos y sintcticos permanecen intactos, se produce un lenguaje espontneo fluente, pero con escaso contenido informativo, un dficit tanto de la nominacin como de la comprensin y parafasias semnticas [16]. En la APPNF hay una alteracin de los aspectos fonolgicos y sintcticos del lenguaje, por lo que la alteracin en la fluidez
ser muy marcada, con parafasias fonticas, comprensin conservada en fases iniciales, agramatismo y anomia, que acaba por evolucionar al mutismo. Finalmente, cabe resear un tercer subtipo de trastorno del lenguaje en las DLFT, denominado por Gorno-Tempini et al [17] variante logopnica, caracterizada por una grave afectacin de la nominacin, la fluidez, la repeticin y la comprensin sintctica compleja, con un preservacin caracterstica de la comprensin de la palabra aislada, con escasa presencia de parafasias. De forma tpica, el trastorno progresivo del lenguaje constituye la nica manifestacin durante los primeros dos aos, con el desarrollo posterior de la afectacin conductual [18] y de la memoria [2]. CRITERIOS DIAGNSTICOS La heterogeneidad de los distintos sndromes englobados en la DLFT justifica la necesidad de definir unos criterios diagnsticos que faciliten su identificacin. Los grupos de Lund y Manchester [19] elaboraron los primeros criterios clinicopatolgicos, cuya principal aportacin era una buena discriminacin frente a la EA. Sin embargo, no establecan el nmero de sntomas necesarios o la importancia relativa de cada uno de ellos en el diagnstico, como tampoco aportaban una definicin operativa de los mismos. Estas limitaciones llevaron al desarrollo de nuevos criterios por parte del grupo de Neary [2], con la definicin de las caractersticas clnicas especficas de los tres sndromes principales de la DLFT: DFT, APPNF y demencia semntica. La precisin diagnstica ante mortem de estos criterios se ha podido confirmar y ha mostrado una sensibilidad del 85% y una especificidad del 99% [20]. No obstante, para algunos autores se haca necesaria la simplificacin de unos criterios poco funcionales para el clnico no especializado, por lo que Mackhann et al [21] agruparon en el concepto demencia frontotemporal a aquellos sndromes caracterizados por un cuadro precoz de cambio en la personalidad o de alteracin del lenguaje, pero con el inconveniente de no poder discriminar aquellas formas de EA con afectacin circunscrita de este ltimo. Finalmente, en los ltimos criterios diagnsticos propuestos por el grupo de Cairns [22] en el ao 2007, se establece una nueva clasificacin, atendiendo a los recientes avances en gentica molecular, bioqumica y neuropatologa. CLASIFICACIN HISTOPATOLGICA Y GENTICA Tradicionalmente, se ha considerado la DLFT como un conjunto de procesos neuropatolgicos con degeneracin predominante de los lbulos frontales y temporales que comparten un fenotipo clnico similar con algunas diferencias en funcin de la distribucin topogrfica del trastorno patolgico subyacente [23]. A nivel histopatolgico, se ha podido constatar la presencia de agregados o acmulos de protenas anmalas en las neuronas o la gla [24], cuya identificacin ha contribuido al conocimiento de los mecanismos patognicos, adems de facilitar la clasificacin de este tipo de demencias. El grupo de Cairns establece cuatro grupos principales [22] (Tabla I). En ms del 40% de los casos, las inclusiones contienen formas insolubles e hiperfosforiladas de la protena tau, que dan lugar a las denominadas taupatas [10]. Hasta fechas recientes se consideraba que una proporcin no desdeable de DLFT careca de un fenotipo histolgico distintivo, por lo que este grupo
REV NEUROL 2008; 47 (11): 588-598
589
M.E. TORIBIO-DAZ, ET AL
fue denominado como demencia sin cambios histolgicos especficos (DLDH) [25]. No obstante, la reevaluacin posterior de muchos de estos casos ha puesto de manifiesto cmo en su mayora presentaban inclusiones ubiquitina positivas (UBI); se denominan DLFT ubiquitina positivas (DLFT-U) [26,27] y representan algo ms del 50% del total de las demencias frontales. Recientemente, se han descrito varios subtipos de DLFT-U tras el reconocimiento de la protena TDP-43 como el principal integrante de las UBI [13], as como algunas formas de DLFT-U TDP-43 negativas [22]. Por ltimo, existe un cuarto grupo muy espordico caracterizado por la presencia de inclusiones de neurofilamentos -internexina positivas, denominadas demencia con acmulo de filamentos intermedios [28,29]. Una vez establecida la clasificacin histopatolgica de Cairns et al, pasaremos a describir los distintos tipos de DLFT, con sus caractersticas histolgicas, genticas y clnicas especficas. Taupatas El citoesqueleto celular formado por microtbulos, microfilamentos y filamentos intermedios constituye un elemento esencial para el mantenimiento de la estructura neuronal. El ensamblaje y estabilizacin de los microtbulos se ve favorecido por una protena soluble, la protena tau, y, en concreto, por su grado de fosforilacin [30]. Existen diversas enfermedades denominadas taupatas en las que esta protena aparece hiperfosforilada formando parte de agregados insolubles, lo que permite su deteccin por mtodos bioqumicos e histopatolgicos. Estos agregados se acumulan a nivel de las neuronas o las clulas gliales y conforman depsitos o inclusiones con una morfologa tpica segn las distintas enfermedades. Si el mecanismo inicial es la mutacin del gen de la protena tau, sta se producir de forma anmala, lo que dar lugar a las denominadas taupatas primarias (DLFT ligada al cromosoma 17, por ejemplo). Ahora bien, si tras la produccin de una protena tau normal sta se ve alterada por una serie de mecanismos secundarios, estaremos ante las taupatas secundarias (EA, por ejemplo), en las que, de igual forma, se producir una hiperfosforilacin y agregacin en acmulos [30]. La protena tau se encuentra en el cerebro adulto en seis isoformas diferentes en funcin de la inclusin o exclusin de ciertos exones durante el procesamiento del ARN mensajero (ARNm). Tres de ellas, con una carencia del exn 10 del gen tau, presentan tres repeticiones de una regin de unin a microtbulos (tau 3R). Las otras tres isoformas que s incluyen el exn 10 contienen cuatro repeticiones de esta regin (tau 4R) [31]. Segn el predominio de cada una de estas isoformas, se ha establecido la siguiente clasificacin de las taupatas [22] (Tablas II y III). Sndrome corticobasal En 1967, Rebeiz et al [32] describieron la denominada degeneracin corticodentatongrica con acromasia en varios pacientes con un sndrome rigidoacintico y apraxia. Las descripciones posteriores de nuevos casos han permitido definir un cuadro clnico, la degeneracin corticobasal (DCB), caracterizado por rigidez y apraxia asimtricas progresivas con signos de afectacin cortical (fenmeno del miembro ajeno, alteracin sensitiva cortical, mioclonas o movimientos especulares) y de los ncleos de la base (distona, temblor o bradicinesia). No obstante, la tendencia actual es referirse a esta enfermedad como sndrome corticobasal, debido a la existencia de casos con manifestacio-
Tabla I. Clasificacin histopatolgica de las demencias lobares frontotemporales. Taupatas Enfermedad de Pick/demencia con cuerpos de Pick Degeneracin corticobasal Parlisis supranuclear progresiva Demencia con granos argirfilos Taupata multisistmica Taupatas inclasificables Demencia con predominio de ovillos Demencia ligada al cromosoma 17 con parkinsonismo por mutacin del gen MAPT Ubiquitinopatas TDP-43 proteinopatas o tardopatas DLFT por mutacin del gen de la progranulina DLFT asociada al cromosoma 9 Por mutacin del gen VCP (valosin-containing protein) DLFT y enfermedad de motoneurona DLFT y esclerosis lateral amiotrfica Formas TDP-43 negativas DLFT ligada al cromosoma 3 Enfermedad con cuerpos de inclusin basfilos Demencia sin cambios histopatolgicos especficos Enfermedad por inclusin neuronal de filamentos intermedios
DLFT: demencia lobar frontotemporal; MAPT: protena asociada a los microtbulos tau; TDP-43: protena fijadora del ADN TAR 43.
Tabla II. Clasificacin de las taupatas segn la isoforma de la tau acumulada. Depsito de tau 3R Depsito de tau 4R Enfermedad de Pick/ demencia con cuerpos de Pick Degeneracin corticobasal Parlisis supranuclear progresiva Demencia con granos argirfilos Taupata multisistmica Taupatas inclasificables Depsito de tau 4R/3R Depsito de tau 3R o 4R o 3R/4R Demencia con predominio de ovillos Demencias ligadas al cromosoma 17 con parkinsonismo por mutacin del gen MAPT
MAPT: protena asociada a los microtbulos tau.
nes parecidas, en las que el estudio neuropatolgico posterior no ha permitido su confirmacin. Es decir, el conjunto de sntomas clnicos descritos no es especfico de la DCB, por lo que es ms adecuado hablar de sndrome [33].
590
REV NEUROL 2008; 47 (11): 588-598
DEMENCIAS FRONTOTEMPORALES
ligada al cromosoma 17q21, caracterizada por desinhibicin, demencia, parkinsonismo y Enfermedad Taupata amiotrofia [36], lo que posteriormente se denominara demencia frontotemporal ligada al croTipo Distribucin mosoma 17 con parkinsonismo (DLFT-17). El Enfermedad de Pick 3R Clulas de Pick gen MAPT, encargado de la codificacin de la o DLFT con cuerpos de Pick protena asociada a los microtbulos, se localiClulas no piramidales del giro za en este cromosoma en el ao 1998, y se esdentado y del rea CA1 del hipocampo tablece su relacin con la DLFT-17 [10]. CualNeuronas piramidales de los lbulos quier mutacin de este gen determina la formafrontales y temporales (capas II y VI) cin de agregados insolubles de protena tau Degeneracin corticobasal 4R Ovillos redondeados en neuronas hiperfosforilada en las neuronas y en la gla en y gla con predominio cortical forma de patologa tau 3R, 4R o 3R/4R. Hasta Depsito tau en astrocitos la fecha se han descrito 41 mutaciones en ms en forma de corona o placa glial de 100 familias [37], de modo que las DLFT-17 suponen del 5 al 10% de las formas hereditaDepsitos en oligodendrocitos: coiled bodies rias de la DLFT. Las mutaciones del gen MAPT Parlisis supranuclear progresiva 4R Ovillos redondeados en neuronas pueden dividirse en dos grupos, dependiendo y gla con predominio subcortical del mecanismo primario implicado: en el priAstrocitos en forma de penacho mero se produce una alteracin del balance normal de ensamblaje del exn 10, con un inDemencia con granos argirfilos 4R Depsito en espinas dendrticas cremento de ste, lo que determina un aumento Depsitos en oligodendrocitos: coiled bodies en la ratio 4R/3R tau [23]; el segundo mecanismo determina una alteracin en la funcin de Taupata multisistmica 4R Neocrtex de los lbulos frontales, la protena tau, con la disminucin en su capatemporales y parietales cidad para unirse a los microtbulos, lo que faGanglios basales y tronconcefalo vorece su agregacin [37]. El depsito de protena tau constituye el Demencia con 3R/4R Ovillos neurofibrilares corticales predominio de ovillos en ausencia de placas de amiloide principal marcador histopatolgico de las DLFT por mutaciones del gen MAPT, con una DLFT ligada al cromosoma 17 3R Marcada heterogeneidad morfologa diferente en funcin del depsito por mutacin del gen MAPT 4R de protena tau 3R/4R, 4R o 3R. Clnicamente, los pacientes presentan un trastorno conductual 3R/4R tpico de la DFT, al que suele asociarse un cuaDLFT: demencia lobar frontotemporal; MAPT: protena asociada a los microtbulos tau. dro de parkinsonismo. Sin embargo, el espectro es muy amplio, y pueden presentar sntomas similares a la esclerosis lateral amiotrfica Sndrome de parlisis supranuclear progresiva (ELA), DCB o PSP, con una marcada variabilidad intra e interEn 1964, Steel et al describieron por primera vez un cuadro cl- familiar [37]. nico caracterizado por rigidez y acinesias simtricas con empeoramiento progresivo, parlisis supranuclear de la mirada y DLFT-U: histopatologa y gentica trastorno de la marcha grave, al que denominaron parlisis su- El proteosoma constituye el principal sistema de degradacin pranuclear progresiva (PSP) [34]. Al igual que ocurre con la de protenas de las clulas. Ahora bien, para que una protena DCB, se tiende a utilizar el trmino sndrome de PSP, debido a anmala sea reconocida y degradada, ha de marcarse previaque se ha podido comprobar cmo un pequeo porcentaje de mente con ubiquitina. Fallos en este sistema se producen en dipacientes con sintomatologa propia de la PSP tienen enferme- ferentes enfermedades neurodegenerativas, en las que el excedades con sustrato histopatolgico diferente [35]. sivo acmulo de protenas ubiquitinadas sirve como marcador Los ovillos neuronales de la DCB y la PSP reaccionan de al presentar una reaccin inmunohistoqumica altamente poforma especfica contra los anticuerpos dirigidos contra tau 4R, sitiva a la ubiquitina. Es precisamente esta caracterstica la adems de contra los anticuerpos genricos de esta protena. Se que ha permitido diferenciar las DLFT en dos grandes subgrulocalizan de forma predominante a nivel cortical en la DCB y pos: el primero, con inclusiones tau positivas o taupatas (vasubcortical en la PSP. Los depsitos de tau en las clulas gliales se el apartado anterior); y el segundo, con inclusiones UBI, tau son abundantes en ambas enfermedades, y varan nicamente y -sinuclena negativas [26] (DLFT-U), como se describir a en su morfologa. En la DCB, forman una corona en forma de continuacin. placa glial como imagen patognomnica, mientras que los astrocitos en penacho son caractersticos de la PSP. En la DCB, Biologa y patologa de la TDP-43 se encuentran, adems, los denominados coiled bodies o dep- A pesar de los estudios exhaustivos realizados utilizando tcnisitos de protena tau en los oligodendrocitos. cas similares a las empleadas en otras enfermedades neurodegenerativas, como las taupatas o las sinucleopatas, la identidad DLFT-17 con parkinsonismo de la protena acumulada en las inclusiones UBI de las DLFT-U En 1994, se describi por primera vez una enfermedad familiar ha permanecido desconocida hasta hace poco tiempo. En el ao
Tabla III. Clasificacin histopatolgica de las taupatas.
REV NEUROL 2008; 47 (11): 588-598
591
M.E. TORIBIO-DAZ, ET AL
2006, Neumann et al [13] identificaron la TDP-43 como la principal protena acumulada en estas inclusiones. La TDP-43 (protena fijadora del ADN TAR 43) es una protena nuclear localizada en mltiples tejidos del organismo, incluyendo el corazn, pulmn, bazo, rin, msculo o cerebro [38], codificada por el gen TARDBP, localizado en el cromosoma 1. Sus funciones son mltiples y est implicada en mecanismos reguladores tanto de la transcripcin del ARNm como del ensamblaje de diversas protenas. El secuestro de la TDP-43 en inclusiones ubiquitinadas citoplasmticas o intranucleares produce una prdida de la funcin de esta protena, lo que, en ltima instancia, se traduce en una alteracin de la transcripcin del ARNm y un ensamblaje aberrante del pre-ARNm. Recientemente, se ha puesto de manifiesto cmo la alteracin patolgica de la TDP-43 desempea un papel muy relevante en la disfuncin neuronal de un grupo heterogneo de enfermedades, como la DLFT-U espordica y familiar con y sin enfermedad de motoneurona asociada, as como en formas familiares y espordicas de ELA. La bioqumica en estos trastornos muestra cmo la TDP-43 es anormalmente fosforilada, ubiquitinada y dividida para generar fragmentos C-terminales, y cmo slo se detectan las inclusiones con inmunorreactividad positiva para la ubiquitina en algunas zonas del cerebro, como el hipocampo, el neocrtex y la mdula espinal. La neuropatologa de estas enfermedades se caracteriza por la presencia de inclusiones neuronales citoplasmticas (NCI), inclusiones neuronales intranucleares (NII), neuritas distrficas (DN) e inclusiones citoplasmticas gliales, cuya caracterstica distintiva es que presentan inmunorreactividad positiva para la ubiquitina y la protena TDP-43, y negativa para tau, -sinuclena, -amiloide, filamentos neuronales intermedios y poliglutaminas. La variabilidad de los tipos morfolgicos de las inclusiones, su distribucin, densidad y perfil inmunohistoqumico han llevado a proponer una clasificacin de las DLFT-U en cuatro subtipos patolgicos [38-41], que, a su vez, responden a dos modelos histolgicos de DLFT-U: el elaborado por Sampathu et al [41], que se basa nicamente en la distribucin de la patologa cortical; y el elaborado por Mackenzie et al [42], que considera las inclusiones tanto corticales como en la fascia dentada (Tabla IV). La protena TDP-43 constituye, por tanto, la principal protena anmala localizada en las UBI caractersticas de casi todos los subtipos de DLFT-U [13], y su deteccin es negativa en algunos tipos de DLFT-U, en otros tipos de DLFT (DFT con cuerpos de Pick, DCB, PSP, DLFT-17 con mutaciones del gen MAPT, enfermedad con inclusiones neuronales de filamentos intermedios, demencia con cuerpos de inclusin basfilos y demencia con granos argirfilos) u otras demencias degenerativas (EA, enfermedad de Parkinson, demencia con cuerpos de Lewy y atrofia multisistmica) [39]. Este hecho ha permitido establecer una nueva clasificacin de las DLFT-U, que da lugar a las denominadas TDP-43 proteinopatas o tardopatas [43], en las que parece existir una correlacin clinicopatolgica (Tabla V). Progranulina y TDP-43 Desde la descripcin original de las mutaciones del gen MAPT, ha sido creciente el nmero de artculos sobre familias con DLFT y herencia autosmica dominante, en las que, a pesar de estar ligadas genticamente a la misma regin del cromosoma 17q21 que contiene el gen MAPT, no se pudo encontrar ninguna de las mutaciones descritas para l [44]. En estas familias se pudo constatar la presencia de una protena tau normal, adems
Tabla IV. Clasificacin histopatolgica de las inclusiones TDP-43. Subtipo histopatolgico Sampathu Tipo 1 Mackenzie Tipo 2 Abundantes DN en la lmina cortical superficial (capas II y III) Pocas o ninguna NCI o NII Numerosos NCI en las capas corticales superficial y profunda Escasas NII y DN Afectacin predominante de las capas corticales ms superficiales Abundantes NCI y DN NII en nmero variable (cat eyes) Numerosas NII e infrecuentes NCI y DN Afectacin predominante de las reas neocorticales Escasa afectacin del hipocampo Caractersticas
Tipo 2
Tipo 3
Tipo 3
Tipo 1
Tipo 4
Tipo 4
DN: neuritas distrficas; NCI: inclusiones intracitoplasmticas; NII: inclusiones intraneurales.
de inclusiones ubiquitina/TDP-43 positivas. La ausencia de mutaciones del gen MAPT y la presencia de una histopatologa DLFT-U apuntaba a la existencia de un segundo gen en la misma regin del cromosoma 17. En el ao 2006, Baker et al demostraron cmo el gen de la PGRN, situado a 1,7 Mb del gen MAPT, era el responsable de este subtipo de DLFT [11]. La PGRN [45] es una protena con un peso molecular de 68,5 kDa, codificada por un nico gen localizado en el cromosoma 17q21, expresada en mltiples tejidos e implicada en diversas funciones. A nivel perifrico, se encuentra presente en las clulas epiteliales (piel, tracto gastrointestinal y epiddimo) y en las clulas hematopoyticas, y desarrolla un importante papel en los procesos inflamatorios, de curacin de las heridas o de la tumorognesis. En condiciones normales, existe un equilibrio entre la PGRN y su principal metabolito, la granulina. Este pptido se libera por la accin proteoltica de la elastasa, enzima cuya accin se encuentra, a su vez, inhibida por la proteasa inhibitoria de la secrecin de leucocitos [46]. Si este equilibrio se altera en favor de la produccin de granulina, se desencadena una reaccin inflamatoria, debido a la liberacin de sustancias proinflamatorias (citocinas y TNF) (Fig. 1). Si este proceso adquiere una intensidad adecuada, ser til ante cualquier tipo de herida, donde, adems, la PGRN, debido a sus propiedades trficas, activa la produccin de fibroblastos, clulas endoteliales, macrfagos y neutrfilos. Mediante un efecto paracrino, favorecer, asimismo, al proceso de epitelizacin, granulacin y vascularizacin de las heridas. Sin embargo, este mismo efecto trfico presenta su expresin ms negativa en la tumorognesis, donde la presencia de PGRN favorece su desarrollo y crecimiento [47]. En el sistema nervioso central, la PGRN se encuentra en las neuronas piramidales, neuronas del hipocampo y clulas cerebelosas de Purkinje, si bien se ha podido comprobar una prdida progresiva en la expresin de esta protena en el cerebro humano desde su etapa de embrin (clulas neuroepiteliales) y feto (tronco del encfalo, bulbo olfatorio, retina y mdula espinal) a la de adulto, lo que sugiere un papel como factor estimulante del desarrollo y diferenciacin del sistema nervioso central. Es de especial relevancia la presencia de PGRN en la microgla, debido a que estas clulas se activan ante cualquier situacin que induzca un posible dao neuronal: traumatismos, infeccio-
592
REV NEUROL 2008; 47 (11): 588-598
DEMENCIAS FRONTOTEMPORALES
Tabla V. Correlacin clinicopatolgica entre las TDP-43 proteinopatas o tardopatas. Enfermedades Subtipos histopatolgicos Sampathu Formas familiares y espordicas de DLFT-U Formas espordicas de DLFT-U Formas familiares ligadas al cromosoma 9: asociacin de DFT/EMN Formas espordicas de DLFT-U Formas familiares ligadas al cromosoma 17 por mutacin del gen de la progranulina Formas familiares ligadas al cromosoma 9 por mutacin del gen VCP (valosin-containing protein) Tipo 1 Tipo 2 Mackenzie Tipo 2 Tipo 3 Abundantes DN Pocas/ninguna NCI o NII Numerosas NCI Escasss NII/DN Abundantes NCI y DN NII variable: cat eyes Numerosas NII e infrecuentes NCI y DN Caractersticas histolgicas
Tipo 3
Tipo 1
tina/TDP-43 positivas. Sin embargo, son las NII su principal caracterstica, debido a su forma lenticular o en ojos de gato (cat eyes) [51,52]. De acuerdo con la clasificacin histopatolgica de las TDP-43 proteinopatas, la DLFT-U por mutacin del gen de la PGRN se correspondera con el subtipo 3 de Sampathu [41] o el subtipo 1 de Mackenzie [42].
Fenotipo clnico en las progranulopatas La DLFT-U por mutacin de la PGRN representa algo ms del Formas espordicas de ELA Inclusiones de las TDP-43 en 50% del total de DLFT, y hasta Formas familiares de ELA no SOD1 el citoplasma de las neuronas un 60% de las formas hereditamotoras rias. Con una transmisin autosDFT/EMN: demencia frontotemporal asociada a la enfermedad de la motoneurona; DLFT-U: demencia lobar frontotemmica dominante y una elevada poral ubiquitina positiva; DN: neuritas distrficas; ELA: esclerosis lateral amiotrfica; NCI: inclusiones intracitoplasmtipenetrancia, sita en torno a los cas; NII: inclusiones intraneurales; SOD1: superxido dismutasa 1; TDP-43: protena fijadora del ADN TAR 43. 60 aos la edad de inicio de los sntomas. El fenotipo clnico es Tabla VI. Correlacin histolgica de las TDP-43 y el fenotipo clnico. normalmente una combinacin de trastorno conductual y de la personalidad, con afectacin del lenguaje en forma de APPNF. Sampathu DFT APPNF DS DFT/EMN Un cuadro de parkinsonismo asociado es muy frecuente ya desde las etapas iniciales, y la asociacin de una enfermedad de Tipo 1 5% 15% 90% 0% motoneurona es excepcional [50]. Cabe destacar una marcada Tipo 2 40% 10% 0% 100% variabilidad no slo entre familias, sino entre los componentes de una misma familia, circunstancia esta que dificulta enormeTipo 3 55% 75% 10% 0% mente predecir cul de las formas familiares de DLFT tendr APPFN: afasia primaria progresiva no fluente; DFT: demencia frontotemporal, vacomo causa una mutacin del gen de la PGRN [53]. No obstanriante frontal; DFT/EMN: demencia frontotemporal asociada a enfermedad de mote, en aquellos casos de DLFT-U sin mutaciones del gen de la toneurona; DS: demencia semntica; TDP-43: protena fijadora del ADN TAR 43. PGRN, la prevalencia de trastorno del lenguaje o parkinsonismo es mucho menor [54], lo que s permitira aventurar un diagnes, etc. La consecuencia es la liberacin, por una parte, de sus- nstico diferencial entre estos dos subtipos de DLFT-U. tancias proinflamatorias (citocinas y TNF), y, por otra, de elastasa, enzima que favorecer la produccin de granulina en Gen VCP-cromosoma 9/TDP-43 detrimento de la PGRN, incrementando la intensidad del proce- La miopata con cuerpos de inclusin asociada a enfermedad de so inflamatorio y favoreciendo, as, la neurodegeneracin. Si Paget sea y demencia frontotemporal es una rara enfermedad por cualquier motivo la funcin o la produccin de PGRN se ve autosmica dominante causada por una mutacin del gen VCP disminuida, tambin lo har su efecto inhibitorio sobre la infla- (valosin-containing protein), localizado en el cromosoma 9p21macin, y se ver favorecido, por tanto, el proceso neurodege- 12 [55]. El VCP forma parte de la superfamilia de genes AAAnerativo [47] (Fig. 2). ATPasa (ATPasa asociada con diversas actividades celulares) En el ltimo ao se han descrito ms de 44 mutaciones del [56], cuyas funciones son mltiples e incluyen su participacin gen de la PGRN en ms de 82 familias [48,49]. En todas ellas se en la degradacin de las protenas mediante su interaccin con producen alelos nulos, que dan lugar a una terminacin prema- el sistema ubiquitina-proteosoma, en la reparacin del ADN, en tura de la secuencia de codificacin con la produccin de un la respuesta al estrs o en la muerte celular programada. El paARNm mutado sin capacidad para producir una protena fun- trn neuropatolgico de este tipo de demencia muestra una imcional [50]. Como consecuencia, no se produce una protena portante afectacin de las regiones corticales del neocrtex, que mutada ni un acmulo de sta en las inclusiones neuronales, si- es menor a nivel subcortical, junto con la presencia en estas no una disminucin de su funcin o haploinsuficiencia, lo que, localizaciones de numerosos NII y relativamente escasos NCI a su vez, condiciona un aclaramiento anormal, ubiquitinacin y y DN, ubiquitina/TDP-43 positivas y VCP negativas [57]. De acmulo de la protena TDP-43 en las inclusiones neuronales. acuerdo con la clasificacin histopatolgica de las TDP-43 proTodas las familias con mutaciones del gen de la PGRN presen- teinopatas, se correspondera con el subtipo 4 de Sampathu tan un patrn neuropatolgico tpico, caracterizado por una [41] y Mackenzie [42]. En la biopsia muscular de forma tpica, marcada atrofia a nivel frontal, ncleo caudado, sustancia negra aparecen los cuerpos de inclusin miopticos. y regin medial del tlamo. Todas muestran, adems, un subtipo Clnicamente, la miopata con cuerpos de inclusin asociahistolgico caracterstico, con afectacin predominante de las da a enfermedad de Paget sea y demencia frontotemporal se capas corticales ms superficiales del neocrtex frontotemporal caracteriza por un cuadro de debilidad en individuos adultos y del estriado, con la presencia de abundantes NCI ubiqui- semejante al que aparece en la distrofia de las cinturas, una enTipo 4 Tipo 4
REV NEUROL 2008; 47 (11): 588-598
593
M.E. TORIBIO-DAZ, ET AL
fermedad de Paget sea que se presenta con una penetrancia variable y una demencia frontal que afecta al 30% de los pacientes con un inicio precoz. Esclerosis lateral amiotrfica y TDP-43 La ELA es una enfermedad neurodegenerativa en la que, como consecuencia de la afectacin de las neuronas motoras, se produce una debilidad progresiva, que llega a la parlisis y muerte del paciente en unos 3 a 5 aos [58]. La mayor parte de los casos de ELA es espordica, si bien un 10% presenta una historia familiar positiva, de los cuales en torno a un 20% se debe a una mutacin en el gen de la superxido dismutasa (SOD1) [58,59]. Clnicamente, un 20% de casos de ELA asocia una demencia de tipo frontal, y en torno al 50% presentar deterioro cognitivo en mayor o menor grado a lo largo de su evolucin [60]. Los hallazgos neuropatolgicos incluyen una marcada prdida de neuronas motoras superiores e inferiores, degeneracin de los tractos corticoespinales, cuerpos de Bunina [61] y la presencia de UBI en el citoplasma de las neuronas motoras daadas. Tanto en las formas de ELA espordicas como familiares SOD1 negativas, estos NCI presentan tpicamente forma de madeja (skein-like inclusions), y son TDP-43 positivas [13]. En definitiva, tanto las formas de ELA espordica como familiares formaran parte de las TDP-43 proteinopatas o tardopatas, excepto aquellas formas familiares por mutacin del gen SOD1, en cuyas inclusiones se encuentra de forma caracterstica SOD1 [62].
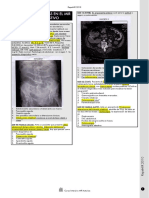
Figura 1. Accin de la progranulina sobre el sistema nervioso perifrico. GRN: granulina; PGRN: progranulina; SLPI: proteasa inhibidora de la secrecin de leucocitos; TNF: factor de necrosis tumoral alfa.
Enfermedad de motoneurona y TDP-43 Las enfermedades que afectan a la motoneurona (EMN) son clnica y patognicamente muy heterogneas. Suelen clasificarse de acuerdo con la afectacin de la primera motoneurona, de la segunda o de ambas, y la ELA es la forma ms fre- Figura 2. Accin de la progranulina sobre el sistema nervioso central. GRN: granulina; PGRN: progranulina; TNF: factor de necrosis tumoral alfa. cuente. Algunas formas de EMN afectan inicialmente a las neuronas de la mdula espinal y del tronco del encfalo, mientras que en otras se produce una afec- Cromosoma 9-DLFT-EMN/TDP-43 tacin en todos los niveles del neuroeje. A pesar de los avances Se han descrito varias familias con miembros afectos de DLFT, genticos, la posible asociacin entre las distintas formas de EMN o DLFT/EMN con herencia ligada al cromosoma 9p21EMN ha permanecido sin aclarar hasta que Neumann et al [13] 13 [64-66]. Todas ellas presentaban un patrn neuropatolgico demostraron la presencia de la protena TDP-43 no slo en las correspondiente a la DLFT-U con abundantes NCI y escasos UBI de la DLFT-U, sino tambin en las inclusiones neuronales DN/NII, de acuerdo con el subtipo histolgico tipo 2 de Sampade la ELA. Posteriormente, estas mismas inclusiones se han thu [41] o 3 de Mackenzie [42]. descrito en la DLFT asociada a EMN (DLFT/EMN), en algunos En una nica familia con herencia ligada al cromosoma 9p, casos de esclerosis lateral primaria y en las neuronas motoras de se ha implicado a una mutacin al gen de la protena 74 para el hasta un 10% de las DLFT en las que no haba sntomas clnicos transporte intraflagelar (IFT74) como responsable [65]. La IFT74 o afectacin neuropatolgica sugestiva de EMN [63]. Estos ha- es una protena localizada en el compartimento vesicular intrallazgos parecen confirmar que la DLFT-U asociada a EMN y la celular y forma parte del sistema de transporte intraflagelar imELA formaran parte del mismo espectro clinicopatolgico de plicado en el transporte vesicular de material sintetizado desde una enfermedad degenerativa ligada a la patologa de la prote- el soma neuronal hacia las dendritas y el axn. na TDP-43 [13]. De igual modo, la presencia de inclusiones TDP-43 positivas permitira establecer el diagnstico diferencial Formas negativas de TDP-43 de ELA y DLFT/EMN de aquellas otras enfermedades de moto DLFT ligada al cromosoma 3. La DLFT con mutacin del neurona o de DLFT con formas subclnicas de EMN. gen charged multivesicular body protein 2B (CHMP2B) es
594
REV NEUROL 2008; 47 (11): 588-598
DEMENCIAS FRONTOTEMPORALES
Tabla VII. Correlacin histopatolgica, gentica y clnica de las DLFT-U. Histologa Cromosoma Gen/protena Enfermedad DFT DLFT-U TDP-43 positivas Sampathu/Mackenzie 1/2 2/3 3/1 9 17 PGRN Formas familiares y espordicas Formas espordicas Formas familiares de DFT/EMN Formas espordicas Formas familiares por mutacin del gen de la progranulina Miopata con cuerpos de inclusin asociada a enfermedad de Paget sea y DLFT Formas espordicas de ELA Formas familiares de ELA no SOD1 Fenotipo clnico APPNF DS DFT/EMN
4/4 Inclusiones en motoneuronas DLFT-U TDP-43 negativas NCI en hipocampo TDP-43 negativas Inclusiones P62 positivas Inclusiones -internexina positivas
VCP
3 10
CHMP2B
??? / P62 -internexina
Forma familiar danesa Enfermedad con cuerpos de inclusin basfilos Enfermedad por inclusin de filamentos intermedios
APPNF: afasia primaria progresiva no fluente; CHMP2B: charged multivesicular body protein 2B; DFT: demencia frontotemporal, variante frontal; DFT/EMN: demencia frontotemporal asociada a enfermedad de motoneurona; DLFT-U: demencia lobar frontotemporal ubiquitina positiva; DS: demencia semntica; NCI: inclusiones intracitoplasmticas; PGRN: progranulina; SOD1: superxido dismutasa 1; VCP: valosin-containing protein.
la causa de la DFT ligada al cromosoma 3 detectada en una nica familia danesa [67,68]. Este gen codifica un componente del complejo secretor endosmico tipo III necesario para la formacin de cuerpos multivesiculares implicados en la degradacin de las protenas. El patrn neuropatolgico caracterstico est constituido por la presencia de abundantes NCI ubiquitina positivas limitadas al hipocampo, y en las que, a pesar del empleo de diferentes tcnicas inmunohistoqumicas, no se ha podido demostrar reactividad frente a la protena TDP-43, por lo que esta enfermedad formara parte de las DLFT-U, pero no de las TDP-43 proteinopatas [39]. Clnicamente, la DLFT-U ligada al cromosoma 3 se caracteriza por un inicio de los sntomas en la sexta dcada de la vida, con cambios en la personalidad y el comportamiento, as como por una afasia progresiva. Enfermedad con cuerpos de inclusin basfilos. Es una enfermedad caracterizada por una sintomatologa atpica al inicio, con debilidad, disartria y prdida de memoria. La demencia sobreviene en torno al ao de evolucin y asocia signos de afectacin de las neuronas motoras superior e inferior, parkinsonismo, sntomas parietales y movimientos anormales. Existe una grave atrofia de la corteza, ganglios basales, sustancia negra y tractos piramidales, con mnima afectacin de la motoneurona inferior. Las inclusiones neuronales son tpicamente negativas para tau, -sinuclena, -internexina y neurofilamentos, pero positivas para ubiquitina y protena P62 [69]. Demencia sin cambios histolgicos especficos La clasificacin histopatolgica de las DLFT se realiza aten-
diendo a la composicin histobioqumica de las inclusiones neuronales cerebrales [22]. En la denominada DLDH, no se ha podido determinar mediante diferentes tcnicas inmunohistoqumicas cambios neuropatolgicos tpicos, y su principal caracterstica es la ausencia de depsitos anmalos de protena tau, inmunorreactividad positiva frente a la ubiquitina o presencia de cualquier otro tipo de inclusin neuronal [25]. Hasta fechas recientes se consideraba que una proporcin importante de DLFT careca de un fenotipo histolgico distintivo, pero muchos de estos casos pasaron a formar parte del grupo de DLFT-U, gracias al descubrimiento de genes como el de la PGRN [11] o al desarrollo de nuevas tcnicas que, en ltima instancia, han llevado al descubrimiento de la protena TDP-43 [13] como principal elemento integrante de las UBI. Presumiblemente, el porcentaje de casos de DLDH continuar disminuyendo en la medida en que aparezcan nuevas protenas o genes responsables de las inclusiones neuronales en las DLFT. Enfermedad por inclusin neuronal de filamentos intermedios La enfermedad por inclusin de filamentos intermedios es una enfermedad neurodegenerativa muy infrecuente, caracterizada por una importante variabilidad clnica en la que se incluye una demencia de perfil frontotemporal de inicio precoz, junto con la presencia de signos piramidales y extrapiramidales. Macroscpicamente, se pone de manifiesto una marcada atrofia de los lbulos frontales y, en menor grado, de los temporales y parietales. A nivel microscpico, la caracterstica fundamental es la presencia de inclusiones neuronales de filamentos intermedios tau y -sinuclena negativas [28,29,70].
REV NEUROL 2008; 47 (11): 588-598
595
M.E. TORIBIO-DAZ, ET AL
Los filamentos intermedios estn compuestos por tres subunidades proteicas fosforiladas denominadas light (NL-F), medium (NL-M) y heavy (NL-H). Existe, adems, una cuarta protena integrante de estos neurofilamentos, la -internexina, codificada por un gen localizado en el cromosoma 10. Esta protena la expresa la prctica totalidad de las neuronas en su etapa de diferenciacin de forma previa al triplete de protenas anterior, lo que favorece su ensamblaje, pero con un descenso muy significativo de su presencia en el cerebro adulto. Su sobreexpresin se traduce en un acmulo anormal de los neurofilamentos y da lugar a las inclusiones -internexina positivas caractersticas de la demencia con acmulo de filamentos intermedios. Si bien es el marcador histopatolgico de este tipo de demencia, se han podido encontrar pequeos acmulos de esta protena en las inclusiones neuronales de otras enfermedades neurodegenerativas, como la EA, la demencia con cuerpos de Lewy o la EMN [71]. CORRELACIN CLINICOPATOLGICA Y EVOLUCIN La bsqueda de tratamientos etiolgicos en la DLFT supone la necesidad de desarrollar biomarcadores que permitan un diagnstico lo ms exacto posible de la enfermedad subyacente. Sin embargo, la heterogeneidad clnica y neuropatolgica, as como la inestabilidad evolutiva de los distintos sndromes, han supuesto una enorme dificultad para el logro de este objetivo. Tradicionalmente, se ha considerado a las DLFT un grupo heterogneo de enfermedades neurodegenerativas en las que resultaba extraordinariamente difcil establecer una relacin entre la presentacin clnica y el proceso patolgico subyacente. Tampoco era posible, conociendo el diagnstico patolgico, deducir la naturaleza de las manifestaciones clnicas. En el momento actual, y gracias a los avances en gentica molecular, bioqumica y neuropatologa de las DLFT, se puede aproximar no slo una correlacin clinicopatolgica, sino tambin clnica, histolgica, gentica y biomolecular. La patologa tau positiva suele ir asociada a la presencia de sntomas extrapiramidales hasta en dos tercios de los casos, a sndromes como la DCB, o a un trastorno del lenguaje en forma de APPNF con una marcada afectacin de las funciones visuoconstructivas. La patologa tau negativa se asocia a una mayor afectacin del comportamiento y del lenguaje, con una superior dificultad en la nominacin [72]. Snowden et al [73] examinaron los cerebros de 79 pacientes seguidos longitudinalmente a lo largo de su vida, y en los que el anlisis post mortem evidenci una DLFT segn criterios histopatolgicos. Estos autores han podido comprobar cmo el fenotipo clnico no slo tiene una relacin predecible con la presencia o ausencia de patologa tau, sino que en el grupo de DLFT-U tambin es posible establecer una relacin entre el fenotipo clnico y el subtipo histolgico de TDP-43. Los pacientes con taupata representaron el 38% de la muestra, con la siguiente correlacin fenotpica: el 50% de las DFT y el 10% de las APPNF. En el 62% de los casos, se constat ausencia de patologa tau, con una distribucin fenotpica muy caracterstica: en el 100% de los pacientes con demencia semntica y DFT/EMN, en el 90% de los pacientes con APPNF, y hasta en el 50% de los pacientes con DFT. En relacin con el subtipo histolgico
de TDP-43 [41], pusieron de manifiesto cmo la demencia semntica se corresponda con el tipo 1 en el 90% de los casos, la DFT/EMN con el tipo 2 en el 100%, la DFT con el tipo 2 en el 40%, y el tipo 3 era el ms frecuente en el 75% de las APPNF y el 55% de las DFT (Tabla VI) [73]. En la tabla VII quedan reflejadas las correlaciones histopatolgicas, fenotipos clnicos, cromosomas y genes implicados en las distintas formas de DLFT-U). Los sndromes clnicos agrupados en el concepto de DLFT se caracterizan por su inestabilidad, debido a los cambios desarrollados a lo largo de la evolucin de la enfermedad. De forma habitual, suele ser un solo sndrome el que predomina durante los cuatro aos iniciales, y evoluciona posteriormente a otro [74]. Kertesz et al [75] constataron la aparicin de un segundo e incluso un tercer sndrome en un estudio prospectivo de 262 pacientes con criterios clnicos de DLFT: la DFT desarroll hasta en un 50% de los casos una APPNF, un 22,5% present un sndrome de DCB/PSP, y en torno al 16% una demencia semntica. Algo ms del 50% de las APPNF desarrollaron una DFT, un tercio un sndrome DCB/PSP, y el resto no evolucion a ningn otro cuadro clnico. La demencia semntica desarroll como segundo sndrome una DFT en tres cuartas partes de los casos, o ningn otro cuadro clnico en el grupo restante. Finalmente, los casos con el sndrome DCB/PSP presentaron como segundo sndrome una DFT (50%) o una APPNF (50%). Este solapamiento entre los distintos sndromes clnicos caractersticos de la DLFT nos lleva a considerar que realmente no sean entidades independientes entre s, teniendo en cuenta la posible aparicin de diferentes expresiones clnicas en un mismo paciente a medida que la enfermedad progresa. Podra afirmarse que un mismo tipo histopatolgico podra generar la aparicin de distintos cuadros clnicos por mecanismos etiolgicos o neuropatolgicos no completamente dilucidados en el momento actual. Adems, esta variabilidad fenotpica puede ocurrir tanto entre pacientes diferentes como en un mismo paciente a lo largo de la evolucin de la enfermedad. Por otra parte, esta heterogeneidad hace imprescindible la bsqueda de biomarcadores que permitan un diagnstico etiolgico lo ms preciso posible a fin de poder desarrollar tratamientos especficos. CONCLUSIONES Los avances producidos en los ltimos aos en el conocimiento clnico, gentico, histolgico y biomolecular de las DLFT requieren una redefinicin de las ideas previas en este campo del conocimiento. Revisamos los hallazgos ms relevantes publicados en la bibliografa y proponemos una clasificacin de las DLFT basada en la caracterstica histolgica principal (taupatas, ubiquitinopatas, DLFT sin hallazgos histolgicos distintivos y enfermedad por filamentos intermedios), conjugando los elementos genticos y biomoleculares que especficamente distinguen las distintas subformas de DLFT. Igualmente, proponemos una aproximacin fenotpica a cada una de las formas y sealamos, sin embargo, la capacidad pleomrfica de estas enfermedades para manifestarse aun con el mismo patrn histolgico, biomolecular y gentico con distintas expresiones clnicas, tanto entre pacientes diferentes como en un mismo paciente a lo largo de la enfermedad.
596
REV NEUROL 2008; 47 (11): 588-598
DEMENCIAS FRONTOTEMPORALES
BIBLIOGRAFA 1. Ikeda M, Ishikawa T, Tanabe H. Epidemiology of frontotemporal lobar degeneration. Dement Geriatr Cogn Disord 2004; 17: 265-8. 2. Neary D, Snowden JS, Gustafson L, Passant U, Stuss D, Black S, et al. Frontotemporal lobar degeneration: a consensus on clinical diagnostic criteria. Neurology 1998; 51: 1546-54. 3. Lomen-Hoerth C, Anderson T, Miller B. The overlap of amyotrophic lateral sclerosis and frontotemporal dementia. Neurology 2002; 59: 1077-9. 4. Serra-Mestres J. Sndromes degenerativos focales. In Lpez-Pousa S, Vilalta-Franch J, Llins-Regl J, eds. Manual de demencias. Barcelona: Prous Science; 1996. p. 374-83. 5. Brun A. Frontal lobe degeneration of non-Alzheimer type. I. Neuropathology. Arch Gerontol Geriatr 1987; 6: 193-208. 6. Gustafson L. Frontal lobe degeneration of non-Alzheimer type. I. Clinical picture and differential diagnosis. Arch Gerontol Geriatr 1987; 6: 209-23. 7. Neary D, Snowden JS, Northern B, Gouldin P. Dementia of frontal lobe type. J Neurol Neurosurg Psychiatry 1988; 51: 353-61. 8. Mesulam M. Slowly progressive aphasia without dementia. Ann Neurol 1982; 11: 592-8. 9. Snowden JS, Goulding PJ, Neary D. Semantic dementia: a form of circumscribed cerebral atrophy. Behav Neurol 1989; 2: 167-82. 10. Hutton M, Lendon CL, Rizzu P, Baker M, Froelich S, Houlden H, et al. Association of missense and 5-splice-site mutations in tau with the inherited dementia FTDP-17. Nature 1998; 393: 702-5. 11. Baker M, Mackenzie IR, Pickering-Brown SM, Gass J, Rademakers R, Lindholm C, et al. Mutations in progranulin cause tau-negative frontotemporal dementia linked to chromosome 17. Nature 2006; 442: 916-9. 12. Cruts M, Gijselinck I, Van der Zee J, Engelborghs S, Wils H, Pirici D, et al. Null mutations in progranulin cause ubiquitine-positive frontotemporal dementia linked to chromosome 17. Nature 2006; 442: 920-4. 13. Neumann M, Sampathu DM, Kwong LK, Truax AC, Micsenyi Mc, Chou TT, et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science 2006; 314: 130-3. 14. Alonso-Navarro H, Jabbour-Wadih T, Ayuso-Peralta L, Jimnez-Jimnez FJ. Neuroqumica y neurofarmacologa de la demencia frontotemporal. Rev Neurol 2006; 42: 556-61. 15. Mega M, Cummings JL. Frontal-subcortical circuits and neuropsychiatric disorders. J Neuropsychiatry Clin Neurosci 1994; 6: 358-70. 16. ONeill S, Andreotti M, De Simone V. Demencia semntica, una enfermedad de muchas palabras. Rev Neurol 2006; 43: 685-9. 17. Gorno-Tempini ML, Dronkers NF, Rankin DP, Ogar JM, Phengrasamy L, Rosen HJ, et al. Cognition and anatomy in three variants primary progressive aphasia. Ann Neurol 2004; 55: 335-46. 18. Serrano C, Martelli M, Haris P, Tufr G, Ranalli C, Taragano F, et al. Afasia progresiva primaria: variabilidad clnica. Anlisis de 15 casos. Rev Neurol 2005; 41: 527-30. 19. Lund & Manchester Groups. Consensus statement. Clinical and neuropathological criteria for frontotemporal dementia. J Neurol Neurosurg Psychiatry 1994; 57: 416-8. 20. Knopman DS, Boeve BF, Parisi JE, Dickson DW, Smith GE, Ivnik RJ, et al. Antemortem diagnosis of frontotemporal lobar degeneration. Ann Neurol 2005; 57: 480-8. 21. Mackhann GM, Albert MS, Grossman M, Miller B, Dickson D, Trojanowski JQ. Clinical and pathological diagnosis of frontotemporal dementia. Report of the Work Group on frontotemporal dementia and Picks disease. Arch Neurol 2001; 58: 1803-9. 22. Cairns NJ, Bigio EH, Mackenzie IRA, Hatanpaa KJ, White CL, Schneider JA, et al. Neuropathological diagnostic criteria and nosology of the frontotemporal lobar degenerations: consensus criteria of the Consortium for frontotemporal lobar degeneration. Acta Neuropathol 2007; 114: 5-22. 23. Neary D, Snowden JS, Mann DD. Frontotemporal dementia. Lancet Neurol 2005; 4: 771-9. 24. Trojanowski JQ, Dickson D. Update on the neuropathological diagnosis of frontotemporal dementia. J Neuropathol Exp Neurol 2001; 60: 1123-6. 25. Mann DM, McDonagh AM, Snowden J, Neary D, Pickering-Brown SM. Molecular classification of the dementias. Lancet 2000; 355: 626. 26. Josephs KA, Holton JL, Rossor MN, Godbolt AK, Ozawa T, Strand K, et al. Frontotemporal lobar degeneration and ubiquitin immunohistochemistry. Neuropathol Appl Neurobiol 2004; 30: 369-73. 27. Mackenzie IR, Shi J, Shaw CL, Duplessis D, Neary D, Snowden JS, et al. Dementia lacking distinctive histology (DLDH) revisited. Acta Neuropathol 2006; 112: 551-9. 28. Cairns NJ, Zhukareva V, Uryu K, Zhang B, Bigio E, Mackenzie IR, et al. Alpha-internexin is present in the pathological inclusions of neuronal intermediate filament inclusion disease. Am J Pathol 2004; 164: 2153-61. 29. Armstrong RA, Kerty E, Skullerud K, Cairns NJ. Neuropathological changes in ten cases of neuronal intermediate filament inclusion disease (NIFID): a study using alpha-internexin immunohistochemistry and principal components analysis (PCA). J Neural Transm 2006; 113: 1207-15. 30. Delacourte A, Buee L. Normal and pathological tau proteins as factors for microtubule assembly. Int Rev Cytol 1997; 171: 167-224. 31. Delacourte A, Sergeant N, Wattez A, Robitaile Y. The biochemistry of the cytosketon in Pick complex. In Kertesz A, Muoz DG, eds. Picks disease and Pick complex. New York: Wiley-Liss; 1998. p. 243-58. 32. Rebeiz J, Kolodny E, Richardson E. Corticodentatonigral degeneration with neuronal achromasia: a progressive disorder of late adult life. Trans Am Neurol Assoc 1967; 92: 23-6. 33. Boeve B. Corticobasal degeneration: the syndrome and the disease. In Litvan I, ed. Atypical parkinsonism disorders. Totawa: Humana Press; 2005. p. 309-34. 34. Steel J, Richardson J, Olszewski J. Progressive supranuclear palsy: a heterogeneous degeneration involving the brainstem, basal ganglia and cerebellum with vertical gaze and pseudobulbar palsy, nuchal dystonia and dementia. Arch Neurol 1964; 2: 473-86. 35. Josephs K, Dickson D. Diagnostic accuracy of progressive supranuclear palsy in the Society for Progressive Supranuclear Palsy brain bank. Mov Disord 2003; 18: 1018-26. 36. Wilhelmsen KC, Lynch T, Pavlou E, Higgins M, Nygaard TG. Localization of disinhibition-dementia-parkinsonism-amyotrophy complex 17q21-22. Am J Hum Genet 1994; 55: 1159-65. 37. Rademakers R, Cruts M, Van Broeckhoven C. The role of tau (MAPT) in frontotemporal dementia and related taupathies. Hum Mutat 2004; 24: 277-95. 38. Buratti E, Dork T, Zuccato E, Pagani F, Romano M, Baralle FE. Nuclear factor TDP-43 and SR proteins promote in vitro and in vivo CFTR exon skipping. EMBO J 2001; 20: 1774-8. 39. Cairns NJ, Neumann M, Bigio EH, Holm IE, Troost D, Hatanpaa KJ, et al. TDP-43 in familial and sporadic frontotemporal lobar degeneration with ubiquitin inclusions. Am J Pathol 2007; 171: 227-40. 40. Neumann M, Kwong LK, Truax AC, Vanmassenhove B, Kretzxchmar HA, Van Deerlin, et al. TDP-43 positive white matter pathology in frontotemporal lobar degeneration with ubiquitin-positive inclusions. J Neuropathol Exp Neurol 2007; 66: 177-83. 41. Sampathu DM, Neumann M, Kwong LK, Chou TT, Micsenyi M, Truax A, et al. Pathological heterogeneity of frontotemporal lobar degeneration with ubiquitin-positive inclusions delineated by ubiquitin inmunohistochemistry and novel monoclonal antibodies. Am J Pathol 2006; 169: 1343-52. 42. Mackenzie IR, Baboire A, Pickering-Brown S, Plessis DD, Jaros E, Perry RH, et al. Heterogeneity of ubiquitin in frontotemporal lobar degeneration: classification and relation to clinical phenotype. Acta Neuropathol 2006; 112: 539-49. 43. Kwong L, Neumann M, Sampathu D, Lee V, Trojanowski J. TDP-43 proteinopathy: the neuropathology underlying major forms of sporadic and familial frontotemporal lobar degeneration and motor neuron disease. Acta Neuropathol 2007; 114: 63-70. 44. Rademakers R, Cruts M, Dermaut B, Sleegers K, Rosso SM, Van den Broeck M, et al. Tau negative frontal lobe dementia at 17q21: significant finemapping of the candidate region to a 4.8 cM interval. Mol Psychiatry 2002; 7: 1064-74. 45. He Z, Batemann A. Progranulin (granulin-epithelin precursor, PC-cellderived growth factor, acrogranin) mediates tissue repair and tumorigenesis. J Mol Med 2003; 81: 600-12. 46. Zhu J, Nathan C, Jin W, Sim D, Ashcroft GS, Wahl SM, et al. Conversion of proepithelin to epithelins: roles of SLPI and elastase in host defense and wound repair. Cell 2002; 11: 867-878. 47. Ahmed Z, Mackenzie IRA, Hutton M, Dickson D. Progranulin in frontotemporal lobar degeneration and neuroinflammation. J Neuroinflammation 2007; 4: 7. 48. Pickering-Brown S. Progranulin and frontotemporal lobar degeneration. Acta Neuropathol 2007; 114: 39-47. 49. Alzheimer Disease & Frontotemporal Dementia Mutation Database. URL: http://www.molgen.ua.ac.be/FTDMutations. [01.05.2008]. 50. Gass J, Cannon A, Mackenzie IR, Boeve B, Baker M, Adamson J, et al. Mutations in progranulin are a major cause of ubiquitin-positive frontotemporal lobar degeneration. Hum Mol Genet 2006; 15: 2988-3001. 51. Mackenzie IRA, Baker M, Pickering-Brown S, Hsiung GYR, Lindholm C, Dwosh E, et al. The neuropathology of frontotemporal lobar degeneration caused by mutations in the progranuline gene. Brain 2006; 129: 3081-90. 52. Josephs KA, Ahmed Z, Katsuse O, Parisi JF, Boeve Bf, Knopman DS, et al. Neuropathologic features of frontotemporal lobar degeneration
REV NEUROL 2008; 47 (11): 588-598
597
M.E. TORIBIO-DAZ, ET AL
with ubiquitin-positive inclusions with progranulin gene (PGRN) mutations. J Neuropathol Exp Neurol 2007; 66: 142-51. 53. Snowden JS, Pickering-Brown SM, Mackenzie IM, Richardson AMT, Varma A, Neary D, et al. Progranulin gene mutations associated with frontotemporal dementia and progressive non-fluent aphasia. Brain 2006; 129: 3115-23. 54. Mackenzie IAR, Rademakers R. The molecular genetics and neuropathology of frontotemporal lobar degeneration: recent developments. Neurogenetics 2007; 8: 237-48. 55. Watts GD, Wymer J, Kovach MJ, Mehta SG, Mumm S, Darvish D, et al. Inclusion body miopathy associated with Paget disease of bone and frontotemporal dementia is caused by mutant valosin-containing protein. Nat Genet 2004; 36: 377-81. 56. Wang Q, Song C, Li CC. Molecular perspectives on p97-VCP: progress understanding its structure and diverse biological functions. J Struct Biol 2004; 146: 44-57. 57. Neumann M, Mackenzie IR, Cairns NJ, Boyer PJ, Markesbery WR, Smith CD, et al. TDP-43 in the ubiquitin pathology of frontotemporal dementia with VCP mutations. J Neuropathol Exp Neurol 2007; 66: 152-7. 58. Pasinelli P, Brown RH. Molecular biology of amyotrophic lateral sclerosis: insights from genetics. Nat Rev Neurosci 2006; 7: 710-23. 59. Gros-Louis F, Gaspar C, Rouleau GA. Genetics of familial and sporadic amyotrophic lateral sclerosis. Biochim Biophys Acta 2006; 1762: 956-72. 60. Talbot K, Ansorge O. Recent advances in the genetics of amyotrophic lateral sclerosis and frontotemporal dementia: common pathways in neurodegenerative disease. Hum Mol Genet 2006; 15: R182-7. 61. Tomonga M. Selective appearance of Bunina bodies in amyotrophic lateral sclerosis. A study of the distribution in midbrain and sacral cord. J Neurol 1980; 223: 259-67. 62. Shibata N, Hirano A, Kobayashi M, Siddique T, Deng HX, Hung WY, et al. Intense superoxide dismutase-1 immunoreactivity in intracytoplasmatic hyaline inclusions of familial amyotrophic lateral sclerosis with posterior column involvement. J Neuropathol Exp Neurol 1996; 55: 481-90. 63. Dickson DW, Josephs KA, Amador-Ortiz C. TDP-43 in differential diagnosis of motor neuron disorders. Acta Neuropathol 2007; 114: 71-9. 64. Morita M, Al Chalabi A, Andersen PM, Soler B, Sapp P, Englund E, et
al. A locus on chromosome 9p confers susceptibility to ALS and frontotemporal dementia. Neurology 2006; 66: 839-44. 65. Momeni P, Schymick J, Jain S, Cookson MR, Cairns NJ, Gregio, E et al. Analysis of IFT74 as candidate for chromosome 9p-linked ALSFTD. BMC Neurol 2006; 6: 44. 66. Valdmanis PN, Dupre N, Bouchard JP, Camu W, Meininger V, Strong M, et al. Three families with amyotrophic lateral sclerosis and frontotemporal dementia with evidence linkage to chromosome 9p. Arch Neurol 2007; 64: 240-5. 67. Brown J, Ashworth A, Gydesen S, Sorensen A, Rossor M, Hardy J, et al. Familial non-specific maps to chromosome 3. Hum Mol Genet 1995; 4: 1625-8. 68. Skibinski G, Parkinson NJ, Brown JM, Chakrabarti L, Lloyd SL, Hummerich H, et al. Mutations in the endosomal ESCRTIII-complex subunit CHMP2B in frontotemporal dementia. Nat Genet 2005; 37: 806-8. 69. Yokota O, Tsuchiya K, Terada S, Ishizu H, Uchikado H, Ikeda M, et al. Basophilic inclusion body disease and neuronal intermediate filament inclusion disease: a comparative clinicopathological study. Acta Neuropathol 2008; 115: 561-75. 70. Molina-Porcel L, Llad A, Rey MJ, Molinuevo JL, Martnez-Lage M, Esteve FX, et al. Clinical and pathological heterogeneity of neuronal intermediate filament inclusion disease. Arch Neurol 2008; 65: 272-5. 71. Cairns NJ, Uryu K, Bigio E, Mackenzie IRA, Gearing M, Duyckaerts C, et al. Alpha-internexin aggregates are abundant in neuronal intermediate filament inclusions disease (NIFID) but rare in other neurodegenerative diseases. Acta Neuropathol 2004; 108: 213-23. 72. Bian H, Grossman M. Frontotemporal lobar degeneration: recent progress in antemortem diagnosis. Acta Neuropathol 114: 23-9. 73. Snowden J, Neary D, Mann D. Frontotemporal lobar degeneration: clinical and pathological relationships. Acta Neuropathol 2007; 114: 31-8. 74. Boeve B. Relationship between frontotemporal dementia, corticobasal degeneration, progressive supranuclear palsy and amyotrophic lateral sclerosis. Alzheimer Dis Assoc Disord 2007; 21: S31-8. 75. Kertesz A, Blair M, McMonagle P, Muoz D. The diagnostic and evolution of frontotemporal dementia. Alzheimer Dis Assoc Disord 2007; 21: 155-63.
CLINICAL AND BIOMOLECULAR CLASSIFICATION OF THE FRONTOTEMPORAL DEMENTIAS. A REVIEW OF THE LITERATURE Summary. Introduction. The term frontotemporal lobar dementia (FTLD) covers a group of neurodegenerative diseases that are very heterogeneous in their clinical expression, genetic component and histopathological features, and this has traditionally made it difficult to study and classify them. Patients usually present a progressive change in their behaviour associated with language disorders and loss of memory, which constitutes the second most important cause of dementia in persons under the age of 65. The most significant characteristic at the histopathological level is the presence of abnormal aggregates or accumulations of proteins in neurons or glial cells; their identification has, on the one hand, helped further our knowledge of the pathogenic mechanisms and, on the other hand, has allowed this type of dementia to be classified. Development and conclusions. In the last two decades a remarkable amount of progress has been made in our knowledge of this group of diseases, thanks to the genetic advances related to the discovery of the MAPT gene and the progranulin gene, as well as their mutations, which are responsible for a high percentage of cases of hereditary FTLD. Likewise, the development of new immunohistochemical techniques has made it possible to characterise some abnormal proteins, such as the protein TDP-43, as the main component of the neuronal inclusions in tau-negative FTLD. All this has led to a new classification of the FTLD. This work includes a thorough review of said advances and the possible clinical, histological, genetic and biomolecular correlations of the different subtypes of FTLD are also considered. [REV NEUROL 2008; 47: 588-98] Key words. Classification. Frontotemporal dementia. Progranulin. Tardopathies. Tauopathies. TDP-43. Ubiquitinopathies.
598
REV NEUROL 2008; 47 (11): 588-598
También podría gustarte
- 100 Acertijos para NiñosDocumento8 páginas100 Acertijos para Niñossusana_arroyoAún no hay calificaciones
- Formato Adopcion Perros y GatosDocumento3 páginasFormato Adopcion Perros y GatosKar Perez Melo46% (13)
- Alimentación consciente: la mejor dietaDocumento20 páginasAlimentación consciente: la mejor dietaMás Allá de las PalabrasAún no hay calificaciones
- Derrida Jacques El Animal Que Luego Estoy SiguiendoDocumento198 páginasDerrida Jacques El Animal Que Luego Estoy Siguiendoφιλοσοφία100% (2)
- MARTINEZ-OLIVE 1997 Epistemologia EvolucionistaDocumento302 páginasMARTINEZ-OLIVE 1997 Epistemologia EvolucionistaTallersociologia100% (4)
- Fundamentos de Neurolinguística. A. R. LuriaDocumento335 páginasFundamentos de Neurolinguística. A. R. LuriaLu Ordóñez94% (31)
- Re Pi TeDocumento58 páginasRe Pi TeJuan Carlos MTAún no hay calificaciones
- AlpacaDocumento47 páginasAlpacaJairon Terres QuispeAún no hay calificaciones
- Manual Procedimientos CEDAMDocumento181 páginasManual Procedimientos CEDAMMariana MnAún no hay calificaciones
- Redes que previenenDocumento76 páginasRedes que previenenCarlos Simrhy Andrade GirónAún no hay calificaciones
- Sesión 45-Cuadros ArtísiticosDocumento11 páginasSesión 45-Cuadros ArtísiticosLu OrdóñezAún no hay calificaciones
- Manual Prevencion Del Delito UnodcDocumento132 páginasManual Prevencion Del Delito UnodcCoco Flores100% (1)
- Redes que previenenDocumento76 páginasRedes que previenenCarlos Simrhy Andrade GirónAún no hay calificaciones
- Trastornos Del Lenguaje Por Lesion en El HemisferioDocumento14 páginasTrastornos Del Lenguaje Por Lesion en El HemisferioLu OrdóñezAún no hay calificaciones
- Sindromes Del Hemisferio No DominanteDocumento8 páginasSindromes Del Hemisferio No DominanteShirleuy GonçalvesAún no hay calificaciones
- Seguridad en CentroaméricaDocumento369 páginasSeguridad en CentroaméricaaguevarameAún no hay calificaciones
- Dislexia PDFDocumento7 páginasDislexia PDFLu OrdóñezAún no hay calificaciones
- Glosario Psicológico-Jurídico, Dzib & OrdóñezDocumento297 páginasGlosario Psicológico-Jurídico, Dzib & OrdóñezLu Ordóñez100% (3)
- DislexiaDocumento7 páginasDislexiaLu OrdóñezAún no hay calificaciones
- Guía Magazine Octubre 2013Documento69 páginasGuía Magazine Octubre 2013Marisa OjedaAún no hay calificaciones
- Tratamiento de Jóvenes Agresores SexualesDocumento100 páginasTratamiento de Jóvenes Agresores SexualesLu OrdóñezAún no hay calificaciones
- Núcleo Acumbens y Sist MotivacionalDocumento9 páginasNúcleo Acumbens y Sist MotivacionalLu OrdóñezAún no hay calificaciones
- Glosario Psicológico-Jurídico, Dzib & OrdóñezDocumento297 páginasGlosario Psicológico-Jurídico, Dzib & OrdóñezLu Ordóñez100% (3)
- Transtorno de Espectro Autista PDFDocumento10 páginasTranstorno de Espectro Autista PDFinmasibonAún no hay calificaciones
- El Mito Del ProgresoDocumento37 páginasEl Mito Del ProgresoShivoham Tlacatecolotl100% (1)
- BIOLOGIA Cazadores de Microbios ResumenDocumento14 páginasBIOLOGIA Cazadores de Microbios ResumenJosehp Guerra ToledoAún no hay calificaciones
- 01 LaMarabuntaDIGITALDocumento16 páginas01 LaMarabuntaDIGITALoscarstveAún no hay calificaciones
- Variaciones Naturales de La Conciencia - Psicología GeneralDocumento43 páginasVariaciones Naturales de La Conciencia - Psicología GeneralZarzuela10960% (1)
- Interpretaciòn RadiogràficaDocumento5 páginasInterpretaciòn RadiogràficaCarlos ChatoAún no hay calificaciones
- BEBIDAS Energeticas ExposicionDocumento17 páginasBEBIDAS Energeticas ExposicionDaniela Terrazas VargasAún no hay calificaciones
- Brief de Los PreservativosDocumento7 páginasBrief de Los Preservativosandiemelecc0% (1)
- Cómo Controlar Las Moscas en Las Granjas de ConejosDocumento4 páginasCómo Controlar Las Moscas en Las Granjas de ConejosYaina Ivanova100% (1)
- Toxicología de Las Avermectinas y Milbemicinas (Lactonas Macrocílicas)Documento23 páginasToxicología de Las Avermectinas y Milbemicinas (Lactonas Macrocílicas)Selene Urcia100% (1)
- Unidad 1 Tejidos, Membranas, Piel y DerivadosDocumento14 páginasUnidad 1 Tejidos, Membranas, Piel y DerivadosLaura KarolineAún no hay calificaciones
- Sindrome de Barraquer SimonsDocumento3 páginasSindrome de Barraquer Simonsapi-3697492Aún no hay calificaciones
- SistemaVestibularAnatomíaFunciónDocumento3 páginasSistemaVestibularAnatomíaFunciónmoon0% (1)
- El Embarazo NormalDocumento4 páginasEl Embarazo NormalWilkersón Paúl Morante LozadaAún no hay calificaciones
- Manejo de Carnet Materno y Formulario Perinatalexpodosrupo3Documento35 páginasManejo de Carnet Materno y Formulario Perinatalexpodosrupo3Diana Letamendi100% (2)
- Monografía de MicologíaDocumento4 páginasMonografía de MicologíaMezarthimAún no hay calificaciones
- Manejo de ComponentesSanguineosDocumento11 páginasManejo de ComponentesSanguineosLuiz Gustavo N. Dos SantosAún no hay calificaciones
- Medicina Indígena en El GuáricoDocumento4 páginasMedicina Indígena en El GuáricoJavier Saldivia CardozoAún no hay calificaciones
- Glaucoma de Angulo Abierto Primario y SecundarioDocumento26 páginasGlaucoma de Angulo Abierto Primario y SecundarioAlfredo PerezAún no hay calificaciones
- Taquipnea Transitoria Del Recién NacidoDocumento1 páginaTaquipnea Transitoria Del Recién NacidoD'l RosaAún no hay calificaciones
- Ventroversión Y Ventroflexión DosDocumento2 páginasVentroversión Y Ventroflexión DosJohnny CornejoAún no hay calificaciones
- Guia #4 Biología Grado 8° 2do PeriodoDocumento12 páginasGuia #4 Biología Grado 8° 2do PeriodoBiologiaFaustinistaAún no hay calificaciones
- Esclerosis Sistémica ProgresivaDocumento36 páginasEsclerosis Sistémica ProgresivaPANKEKASAún no hay calificaciones
- Plantas y Tratamientos 1Documento21 páginasPlantas y Tratamientos 1ladyguinev100% (1)
- Practica #2 Analogías 1-2Documento2 páginasPractica #2 Analogías 1-2Richard Lenin0% (2)
- Tecnicas Anestesicas y Exodonticas en o InfantilDocumento7 páginasTecnicas Anestesicas y Exodonticas en o InfantilItai E. Euan AguilarAún no hay calificaciones