Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tipos de Enlaces Químicos
Tipos de Enlaces Químicos
Cargado por
Halcon PeregrinoDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Tipos de Enlaces Químicos
Tipos de Enlaces Químicos
Cargado por
Halcon PeregrinoCopyright:
Formatos disponibles
Tipos de enlaces qumicos
Los tomos se unen entre s para formar molculas mediante fuerzas de enlace. Los
tipos fundamentales de enlace son el inico, el covalente y el metlico. A continuacin
se describen cada uno de los tipos de enlace y sus caractersticas principales.
Enlace inico
El enlace inico consiste en la atraccin electrosttica entre tomos con cargas
elctricas de signo contrario. Este tipo de enlace se establece entre tomos de
elementos poco electronegativos con los de elementos muy electronegativos. Es
necesario que uno de los elementos pueda ganar electrones y el otro perderlo, y como
se ha dicho anteriormente este tipo de enlace se suele producir entre un no metal
(electronegativo) y un metal (electropositivo).
Un ejemplo de sustancia con enlace inico es el cloruro sdico. En su formacin tiene
lugar la transferencia de un electrn del tomo de sodio al tomo de cloro. Las
configuraciones electrnicas de estos elementos despus del proceso de ionizacin
son muy importantes, ya que lo dos han conseguido la configuracin externa
correspondiente a los gases nobles, ganando los tomos en estabilidad. Se produce
una transferencia electrnica, cuyo dficit se cubre sobradamente con la energa que
se libera al agruparse los iones formados en una red cristalina que, en el caso del
cloruro sdico, es una red cbica en la que en los vrtices del paraleleppedo
fundamental alternan iones Cl- y Na+. De esta forma cada ion Cl- queda rodeado de
seis iones Na+ y recprocamente. Se llama ndice de coordinacin al nmero de iones
de signo contrario que rodean a uno determinado en una red cristalina. En el caso del
NaCl, el ndice de coordinacin es 6 para ambos
Propiedades de los compuestos inicos
Las sustancias inicas estn constituidas por iones ordenados en el retculo cristalino;
las fuerzas que mantienen esta ordenacin son fuerzas de Coulomb, muy intensas.
Esto hace que las sustancias inicas sean slidos cristalinos con puntos de fusin
elevados. En efecto, para fundir un cristal inico hay que deshacer la red cristalina,
separar los iones. El aporte de energa necesario para la fusin, en forma de energa
trmica, ha de igualar al de energa reticular, que es la energa desprendida en la
formacin de un mol de compuesto inico slido a partir de los correspondientes iones
en estado gaseoso. Esto hace que haya una relacin entre energa reticular y punto de
fusin, siendo ste tanto ms elevado cuanto mayor es el valor de aquella.
Por otra parte, la aparicin de fuerzas repulsivas muy intensas cuando dos iones se
aproximan a distancias inferiores a la distancia reticular (distancia en la que quedan en
la red dos iones de signo contrario), hace que los cristales inicos sean muy poco
compresibles. Hay sustancias cuyas molculas, si bien son elctricamente neutras,
mantienen una separacin de cargas. Esto se debe a que no hay coincidencia entre el
centro de gravedad de las cargas positivas y el de las negativas: la molcula es un
dipolo, es decir, un conjunto de dos cargas iguales en valor absoluto pero de distinto
signo, separadas a una cierta distancia. Los dipolos se caracterizan por su momento;
producto del valor absoluto de una de las cargas por la distancia que las separa. Un de
estas sustancias polares es, por ejemplo el agua.
Cuando un compuesto inico se introduce en un disolvente polar, los iones de la
superficie de cristal provocan a su alrededor una orientacin de las molculas
dipolares, que enfrentan hacia cada ion sus extremos con carga opuesta a la del
mismo. En este proceso de orientacin se libera una energa que, si supera a la
energa reticular, arranca al ion de la red. Una vez arrancado, el ion se rodea de
molculas de disolvente: queda solvatado. Las molculas de disolvente alrededor de
los iones se comportan como capas protectoras que impiden la reagrupacin de los
mismos. Todo esto hace que, en general, los compuestos inicos sean solubles en
disolventes polares, aunque dependiendo siempre la solubilidad del valor de la energa
reticular y del momento dipolar del disolvente. As, un compuesto como el NaCl, es
muy soluble en disolventes como el agua, y un compuesto como el sulfato de bario,
con alta energa reticular, no es soluble en los disolventes de momento dipolar muy
elevado.
Enlace covalente
Lewis expuso la teora de que todos los elementos tienen tendencia a conseguir
configuracin electrnica de gas noble (8 electrones en la ltima capa). Elementos
situados a la derecha de la tabla peridica ( no metales ) consiguen dicha
configuracin por captura de electrones; elementos situados a la izquierda y en el
centro de la tabla ( metales ), la consiguen por prdida de electrones. De esta forma la
combinacin de un metal con un no metal se hace por enlace inico; pero la
combinacin de no metales entre s no puede tener lugar mediante este proceso de
transferencia de electrones; por lo que Lewis supuso que deban compartirlos.
Es posible tambin la formacin de enlaces mltiples, o sea, la comparticin de ms
de un par de electrones por una pareja de tomos. En otros casos, el par compartido
es aportado por slo uno de los tomos, formndose entonces un enlace que se llama
coordinado o dativo. Se han encontrado compuestos covalentes en donde no se
cumple la regla. Por ejemplo, en BCl3, el tomo de boro tiene seis electrones en la
ltima capa, y en SF6, el tomo de azufre consigue hasta doce electrones. Esto hace
que actualmente se piense que lo caracterstico del enlace covalente es la formacin
de pares electrnicos compartidos, independientemente de su nmero.
Fuerzas intermoleculares
A diferencia que sucede con los compuestos inicos, en las sustancias covalentes
existen molculas individualizadas. Entre estas molculas se dan fuerzas de cohesin
o de Van der Waals, que debido a su debilidad, no pueden considerarse ya como
fuerzas de enlace. Hay varios tipos de interacciones: Fuerzas de orientacin (aparecen
entre molculas con momento dipolar diferente), fuerzas de induccin (ion o dipolo
permanente producen en una molcula no polar una separacin de cargas por el
fenmeno de induccin electrosttica) y fuerzas de dispersin (aparecen en tres
molculas no polares).
Propiedades de los compuestos covalentes
Las fuerzas de Van der Waals pueden llegar a mantener ordenaciones cristalinas, pero
los puntos de fusin de las sustancias covalentes son siempre bajos, ya que la
agitacin trmica domina, ya a temperaturas bajas, sobre las dbiles fuerzas de
cohesin. La mayor parte de las sustancias covalentes, a temperatura ambiente, son
gases o lquidos de punto de ebullicin bajo (por ejemplo el agua). En cuanto a la
solubilidad, puede decirse que, en general, las sustancias covalentes son solubles en
disolventes no polares y no lo son en disolventes polares. Se conocen algunos slidos
covalentes prcticamente infusibles e insolubles, que son excepcin al
comportamiento general descrito. Un ejemplo de ellos es el diamante. La gran
estabilidad de estas redes cristalinas se debe a que los tomos que las forman estn
unidos entre s mediante enlaces covalentes. Para deshacer la red es necesario
romper estos enlaces, los cual consume enormes cantidades de energa
Electrovalencia y covalencia
Teniendo presenta las teoras de los enlaces inicos y covalentes, es posible deducir
la valencia de un elemento cualquiera a partir de su configuracin electrnica.
La electrovalencia, valencia en la formacin de compuestos inicos, es el
nmero de electrones que el tomo tiene que ganar o perder para conseguir la
configuracin de los gases nobles.
La covalencia, nmero de enlaces covalentes que puede formar un tomo, es
el nmero de electrones desapareados que tiene dicho tomo. Hay que tener
presente que un tomo puede desaparecer sus electrones al mximo siempre
que para ello no haya de pasar ningn electrn a un nivel energtico superior.
ENLACE METLICO
Los elementos metlicos sin combinar forman redes cristalinas con elevado ndice de
coordinacin. Hay tres tipos de red cristalina metlica: cbica centrada en las caras,
con coordinacin doce; cbica centrada en el cuerpo, con coordinacin ocho, y
hexagonal compacta, con coordinacin doce. Sin embargo, el nmero de electrones
de valencia de cualquier tomo metlico es pequeo, en todo caso inferior al nmero
de tomos que rodean a un dado, por lo cual no es posible suponer el establecimiento
de tantos enlaces covalentes.
En el enlace metlico, los tomos se transforman en iones y electrones, en lugar de
pasar a un tomo adyacente, se desplazan alrededor de muchos tomos.
Intuitivamente, la red cristalina metlica puede considerarse formada por una serie de
tomos alrededor de los cuales los electrones sueltos forman una nube que mantiene
unido al conjunto.
POLARIDAD DE LOS ENLACES
En el caso de molculas heteronucleares, uno de los tomos tendr mayor
electronegatividad que el otro y, en consecuencia, atraer mas fuertemente hacia s al
par electrnico compartido. El resultado es un desplazamiento de la carga negativa
hacia el tomo ms electronegativo, quedando entonces el otro con un ligero exceso
de carga positiva. Por ejemplo, en la molcula de HCl la mayor electronegatividad del
cloro hace que sobre ste aparezca una fraccin de carga negativa, mientras que
sobre el hidrgeno aparece una positiva de igual valor absoluto. Resulta as una
molcula polar, con un enlace intermedio entre el covalente y el inico.
También podría gustarte
- Espanol 3 - Adriana de Teresa OchoaDocumento276 páginasEspanol 3 - Adriana de Teresa OchoaEva Xochitl Corona Lopez59% (29)
- La InteractividadDocumento4 páginasLa InteractividadSebastian Alejandro Flores RetamalAún no hay calificaciones
- RECUPERACIONDocumento2 páginasRECUPERACIONRoyer Florez ValdezAún no hay calificaciones
- Carrillo Alvarez..Documento3 páginasCarrillo Alvarez..Jerson E. CarrilloAún no hay calificaciones
- Examen Cartas de Control Am - 22019Documento3 páginasExamen Cartas de Control Am - 22019Nicolás Aguirre GrisalesAún no hay calificaciones
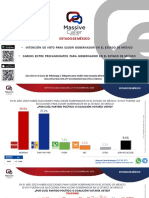
- Elecciones Del Estado de MéxicoDocumento12 páginasElecciones Del Estado de MéxicoMakiseAún no hay calificaciones
- Guia de Actividades y Rubrica de Evaluacion-Paso 1-Conceptualizar El Proceso de Gestión de Las AdquisicionesDocumento7 páginasGuia de Actividades y Rubrica de Evaluacion-Paso 1-Conceptualizar El Proceso de Gestión de Las AdquisicionesBriyith Soraya ALVAREZ MORAAún no hay calificaciones
- 1.perforacion Direccional EJERCICIOSDocumento42 páginas1.perforacion Direccional EJERCICIOSMelisaAún no hay calificaciones
- FLUORITADocumento11 páginasFLUORITANatalia ValdesAún no hay calificaciones
- Radiologia Grupo 1 RXDocumento16 páginasRadiologia Grupo 1 RXMaría Fernanda LamusAún no hay calificaciones
- Marco MetodologicoDocumento3 páginasMarco MetodologicoDolores TovarAún no hay calificaciones
- Enfoque MixtoDocumento2 páginasEnfoque MixtoJesus Pablo ObandoAún no hay calificaciones
- A.K. Naten - Nueva VidaDocumento89 páginasA.K. Naten - Nueva VidaSilvina100% (8)
- Formularios Proyectos 2 CompletoDocumento16 páginasFormularios Proyectos 2 CompletoGeiner CubasAún no hay calificaciones
- 01 Proc. Armado de TorretasDocumento5 páginas01 Proc. Armado de Torretasjosd061Aún no hay calificaciones
- Ley 18834 - 23 Sep 1989Documento56 páginasLey 18834 - 23 Sep 1989Rodrigo RexAún no hay calificaciones
- 11° Evaluación Física - Formularios de GoogleDocumento5 páginas11° Evaluación Física - Formularios de GoogleJesus M Ayala VarelaAún no hay calificaciones
- Universidad Nacional Abierta y A Distancia Unad Introducción A Ingeniería de SistemasDocumento23 páginasUniversidad Nacional Abierta y A Distancia Unad Introducción A Ingeniería de SistemasRichard Corena SimancasAún no hay calificaciones
- Motobomba para Lucha Contra IncendiosDocumento17 páginasMotobomba para Lucha Contra IncendiosJuancci EchevarriaAún no hay calificaciones
- Factoresbioticosabioticos 4 CienDocumento4 páginasFactoresbioticosabioticos 4 CienRulo DexAún no hay calificaciones
- El Texto ArgumentativoDocumento11 páginasEl Texto ArgumentativojosenycastilloAún no hay calificaciones
- 2016 Products Catalogue ofDocumento58 páginas2016 Products Catalogue ofMjcmjcAún no hay calificaciones
- Periodos en La Historia Del ArteDocumento4 páginasPeriodos en La Historia Del Artekarinadogchaoo100% (1)
- Consola Central R32 IV, Manual de InstalaciónDocumento8 páginasConsola Central R32 IV, Manual de InstalaciónManuel RosuAún no hay calificaciones
- Guía de Trabajos Prácticos Cálculo IIDocumento28 páginasGuía de Trabajos Prácticos Cálculo IIDamian ZabalaAún no hay calificaciones
- Taller SaroDocumento3 páginasTaller SaroMateo Largacha Rojas100% (1)
- Catalogo Técnico Carretilla Retractil Jungheinrich ETV ETM 214 216Documento8 páginasCatalogo Técnico Carretilla Retractil Jungheinrich ETV ETM 214 216AngelQuispeAún no hay calificaciones
- Guía Actividades Prácticas - Hidraulica (2020-I)Documento5 páginasGuía Actividades Prácticas - Hidraulica (2020-I)Gonzalo Leon de los RiosAún no hay calificaciones
- Patron Macetero Colgante Macrame Felina CreativaDocumento6 páginasPatron Macetero Colgante Macrame Felina CreativaPaulina Danae Maturana AstudilloAún no hay calificaciones
- INTRODUCCIONDocumento9 páginasINTRODUCCIONCesar ObregonAún no hay calificaciones