Documentos de Académico
Documentos de Profesional
Documentos de Cultura
TermoquÍmica
TermoquÍmica
Cargado por
minmacullf0 calificaciones0% encontró este documento útil (0 votos)
60 vistas1 páginaDerechos de autor
© Attribution Non-Commercial (BY-NC)
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Attribution Non-Commercial (BY-NC)
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
60 vistas1 páginaTermoquÍmica
TermoquÍmica
Cargado por
minmacullfCopyright:
Attribution Non-Commercial (BY-NC)
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
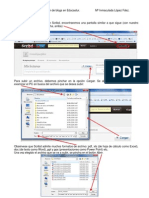
TERMOQUÍMICA PAU ASTURIAS 2009
1. (PAU 09) En el laboratorio se desea determinar la variación de entalpía correspondiente a la
reacción: HCl(ac) + Na(OH)(ac) → Na+ (ac) + Cl-(ac) + H2O
a) Dibuja el montaje experimental necesario indicando los nombres de los instrumentos que se
deben utilizar.
b) Al mezclar 50 ml de HCl (ac) 2M, a 20 ºC, con otros 50 ml de Na(OH) (ac) 2 M, a 20 ºC, la
temperatura del sistema varía de 20 ºC a 39,5 ºC. Calcula el valor de ΔH para la reacción, en
kJ/mol, e indica si la reacción será endotérmica o exotérmica.
Datos: c(disolución) ≈ c(agua) = 4,18 kJ/kg.K; Equivalente calorífico en agua del calorímetro =
3,8x10-2 kJ/K. Considera las disoluciones de HCl(ac) y Na(OH) (ac) como diluidas y su densidad
igual a la del agua (1,0x103 kg/m3).
También podría gustarte
- Crear Cuenta en ScribdDocumento2 páginasCrear Cuenta en Scribdminmacullf40% (10)
- Poema 14. Neruda.Documento1 páginaPoema 14. Neruda.minmacullfAún no hay calificaciones
- Taller Rueda de AlimentosDocumento9 páginasTaller Rueda de AlimentosminmacullfAún no hay calificaciones
- Reglas Estructuras de LewisDocumento6 páginasReglas Estructuras de Lewisminmacullf100% (2)
- Subir ScribdDocumento2 páginasSubir Scribdminmacullf0% (1)
- Soluciones Redox Pau Asturias-10Documento4 páginasSoluciones Redox Pau Asturias-10minmacullfAún no hay calificaciones
- Prácticas PAU 2011Documento10 páginasPrácticas PAU 2011minmacullfAún no hay calificaciones
- PAU Química Asturias Hasta10Documento17 páginasPAU Química Asturias Hasta10minmacullf67% (3)
- Estructura Atomica PAU AsturiasDocumento11 páginasEstructura Atomica PAU AsturiasminmacullfAún no hay calificaciones
- Quimica Del Carbonopau Asturias-SolucionesDocumento14 páginasQuimica Del Carbonopau Asturias-SolucionesminmacullfAún no hay calificaciones
- Rredox PAU ASTURIAS05-09Documento11 páginasRredox PAU ASTURIAS05-09minmacullfAún no hay calificaciones
- Soluciones Acido-Base Pau AsturiasDocumento13 páginasSoluciones Acido-Base Pau Asturiasminmacullf100% (1)
- Equilibrio PAU ASTURIASDocumento14 páginasEquilibrio PAU ASTURIASminmacullf100% (1)