Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Procesos Desarrollados en Las Plantas de Amoniaco y Urea
Cargado por
DairoAndresTrillosPuentes100%(1)100% encontró este documento útil (1 voto)
132 vistas8 páginasamoniaco urea
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoamoniaco urea
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
100%(1)100% encontró este documento útil (1 voto)
132 vistas8 páginasProcesos Desarrollados en Las Plantas de Amoniaco y Urea
Cargado por
DairoAndresTrillosPuentesamoniaco urea
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 8
Procesos desarrollados en las Plantas de Amoniaco y Urea
DAIRO TRILLOS PUENTES
MSTER EN GESTIN DE LA INDUSTRIA DE LOS HIDROCARBUROS
13 de abril de 2014
NDICE
Tabla de contenido
INTRODUCCIN
Proceso de produccin de urea
Obtencin de CO2
Obtencin de amonaco
Formacin de carbamato
Degradacin del carbamato reciclado
Sntesis de Urea
Deshidratacin, concentracin y granulacin
Proceso Haber-Bosch
Demanda de Urea en Latinoamrica
CONCLUSIONES
REFERENCIA
INTRODUCCIN
El amonaco es un gas incoloro, que tiene olor intenso y es sumamente
irritante, es muy soluble en agua, alcohol y ter, y se lica fcilmente por
presin, convirtindose en combustible, se produce usando el proceso
Haber-Bosch a partir del gas natural. El gas natural es una de las varias e
importantes fuentes de energa no renovables formada por una mezcla de
gases ligeros que se encuentra en yacimientos de petrleo, disuelto o
asociado con el petrleo (acumulacin de plancton marino) o en depsitos
de carbn.
La materia prima de la cual se obtiene la urea es a partir del amoniaco
(NH3) y el dixido de carbono (CO2), para formar un compuesto intermedio,
el cual es el que va a producir la urea. La sntesis de urea a nivel industrial
se realiza a partir de amonaco (NH3) lquido y anhdrido carbnico (CO2)
gaseoso.
La utilizacin de fertilizantes de urea y fosfato permite que las plantaciones
se vuelvan ms fuertes y pueden sobrellevar, con la ayuda de los productos
agroqumicos necesarios, distintos tipos de insectos, bacterias y virus que
pueden llegar a afectarlas durante el tiempo que dure la maduracin de sus
frutos.
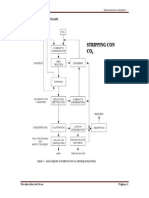
PROCESO DE PRODUCCIN DE UREA
La sntesis de urea a nivel industrial se realiza a partir de amonaco (NH3)
lquido y anhdrido carbnico (CO2) gaseoso. La reaccin se verifica en 2
pasos. En el primer paso, los reactivos mencionados forman un producto
intermedio llamado carbamato de amonio y, en la segunda etapa, el
carbamato se deshidrata para formar urea.
Surge un problema dado que las velocidades de las reacciones son
diferentes. La primera etapa es mucho ms rpida que la segunda, con lo
cual el carbamato intermedio se acumula. Adems, la primera reaccin no
se verifica por completo, por lo que tambin quedan amonaco y dixido
libres. En adicin a esto, debe mencionarse que el carbamato es un
producto altamente corrosivo, por lo cual lo que se hace es degradar la
parte de carbamato no convertida a urea en sus reactivos de origen, y luego
volver a formarlo.
El proceso completo de produccin de la urea puede separarse en las
siguientes etapas:
1. Obtencin de CO2
2. Obtencin de amonaco
3. Formacin de carbamato
4. Degradacin del carbamato y reciclado.
5. Sntesis de urea
6. Deshidratacin, concentracin y granulacin
1. El CO2 se obtiene a partir de gas natural, mediante la reaccin conocida
como reforming. Antes del reforming, deben separarse las impurezas del
gas, tales como gotas de aceite, partculas de polvo, y sobre todo desulfurar
el gas, ya que el azufre interfiere con la accin de los catalizadores.
Luego de purificar el gas, se procede a la obtencin de CO2 mediante dos
etapas de reforming cataltico con vapor de agua. El calor necesario para la
reaccin, la cual es endotrmica, proviene de la combustin del gas natural
y de los gases parcialmente reformados. Se deja entrar aire al reactor para
obtener la relacin necesaria de H2/N2 para la posterior obtencin del
amonaco. La reaccin es la siguiente:
2 CH4 + 3 H2O flecha CO + CO2 + 7 H2
Las dos etapas de reforming se verifican segn la reaccin expuesta, y a la
salida de la segunda etapa, se obtiene un gas con las siguientes
proporciones: 56% H2, 12% CO, 8% CO2, 23% N2 y menos de 0,5% CH4.
Para eliminar el CO y convertirlo en CO2, se realiza la conversin de CO
haciendo que reaccione catalticamente con vapor de agua para formar CO2
y H2 usando hierro y cobre como catalizadores.
Del gas resultante se separa el CO2 mediante una solucin de mono etanol
amina (MEA), mediante la siguiente reaccin:
MEA (CO2) flecha MEA + CO2
2. El otro reactivo necesario para la produccin de urea es el amonaco. ste
se obtiene a partir del gas reformado separado del CO2. Se produce
primeramente una etapa de metanacin para convertir a metano las bajas
proporciones que quedan de CO y CO2 en circulacin, dado que stos
interferiran en la accin del catalizador en la etapa final de sntesis del
amonaco:
CO + 3 H2 CH4 + H2O
CO2 + 4 H2 CH4 + 2 H2O
Luego de la metanacin, el gas circulante se compone de aire, metano y
vapor de agua, los cuales reaccionan con catalizador de hierro para formar
amonaco en estado gaseoso segn:
7 CH4 + 10 H2O + 8 N2 + 2 O2 16 NH3 + 7 CO2
El amonaco gaseoso se condensa por enfriamiento y se separa del gas para
almacenarlo a presin de unas 13 atmsferas. El amonaco gaseoso
remanente es recirculado al loop de sntesis.
3. La reaccin de sntesis de Urea se lleva a cabo a altas presiones (200 bar)
y el nivel trmico ptimo (190C) en un reactor construido en acero
inoxidable especial. La reaccin se produce entre el amonaco, el CO2 y la
solucin reciclada de carbamato, proveniente de la etapa de absorcin. El
carbamato de amonio se forma a partir de CO2 y NH3 segn la siguiente
reaccin (esta reaccin genera calor):
2NH3 (g) + CO2 (g) NH2 COONH4(l)
?H= -117 kJ/mol
Amoniaco + Gas Carbnico Carbamato de Amonio
Antes de ingresar al reactor, el CO2 es comprimido hasta 200 atm, mediante
un compresor elctrico y el amonaco hasta 145 atm.
El NH3 y el CO2 reaccionan rpida y exotrmicamente, en una primera
etapa, para formar el carbamato, que luego se deshidrata a urea + agua.
Esta reaccin logra cerca del 100% en condiciones normales.
4. No todo el Carbamato de Amonio se descompone en Urea y Agua. La
fraccin que se descompone para formar Urea en relacin a la cantidad total
que ingresa al reactor se denomina conversin. La conversin de Carbamato
en Urea en el reactor est en el orden de 70%. Es decir que de cada 100 Kg
de carbamato que se forman, slo 70 Kg pasan a Urea. El
resto debe reciclarse permanentemente y en forma continua al reactor para
lograr una conversin total.
Como habamos visto, el carbamato se forma mucho ms rpido que la
urea. Al ser altamente corrosivo, su manejo es muy difcil. Por sta razn, lo
que se hace es degradarlo nuevamente a NH3 y CO2 para luego volver a
formarlo. La reaccin de descomposicin:
NH2 COONH4 (l) 2NH3 (g) + CO2 (g)
5. El carbamato se deshidrata a urea mediante la reaccin:
NH2 COONH4 (l) NH2 CO NH2 (l) + H2O (l)
?H= +15.5 kJ/mol
Como se ve, la reaccin es endotrmica, y habamos dicho que es mucho
ms lenta que la de produccin de carbamato. La cintica de la reaccin
aumenta con la temperatura, con una mayor relacin NH3/CO2 y disminuye
con una mayor presencia de agua.
La produccin de la Urea se realiza en un reactor vertical, que opera a 188
190C y 160 Kgf/cm2 absoluta, una relacin N/C de 3,6 3,8, un tiempo de
residencia de alrededor de 45 minutos y un grado de conversin (en un
paso) del 65 70 %.
Esta operacin combina la formacin de carbamato (exot., rpida) en su
parte inferior, por la alimentacin de CO2 y NH3 en exceso y la
descomposicin del carbamato en urea (ms lenta y endotrmica).
6. La corriente de Urea y agua obtenida en las etapas de Descomposicin, la
cual contiene aproximadamente 70% de Urea, es concentrada al 80% en un
concentrador de vaco mediante la aplicacin de calor externo utilizando
vapor de agua. Esta corriente se denomina Urea de Sntesis, y es bombeada
hacia la unidad de Evaporacin.
Luego se pasa al perlado de Urea (formacin de pequeas perlas del orden
de 2 4 mm de dimetro) se realiza en la Torre de Perlado (Torre de Prilling).
La Urea fundida es bombeada a la parte superior de la torre de 80 mts de
altura y 16 mts. de dimetro. Mediante un canasto giratorio con unas 6000
pequeas perforaciones se logra obtener una lluvia de Urea fundida, cuyas
gotas se van solidificando primero y enfriando luego durante su cada libre,
a la vez que se hace circular aire en sentido contrario mediante grandes
ventiladores ubicados en la parte superior de la torre.
Se obtiene de este modo el producto final, a unos 40 50 C de
temperatura, el cual es transportado mediante elevadores y cintas a los
silos de almacenaje.
Proceso Haber Bosch Amoniaco
En qumica, el proceso de Haber - Bosch es la reaccin de nitrgeno e
hidrgeno gaseosos para producir amonaco. La importancia de la reaccin
radica en la dificultad de producir amonaco a un nivel industrial.
Alrededor del 78,1% del aire que nos rodea es nitrgeno molecular, N2. El
elemento como molcula diatmica gaseosa es muy estable y relativamente
inerte debido al enlace triple que mantiene los dos tomos fuertemente
unidos. No fue sino hasta los primeros aos del siglo XX cuando este
proceso fue desarrollado para obtener nitrgeno del aire y producir
amonaco, que al oxidarse forma nitritos y nitratos. stos son esenciales en
los fertilizantes.
Como la reaccin natural es muy lenta, se acelera con un catalizador de
hierro (Fe3+) y xidos de aluminio (Al2O3) y potasio (K2O). Los factores que
aumentan el rendimiento, al desplazar el equilibrio de la reaccin hacia los
productos (Principio de Le Chtelier), son las condiciones de alta presin
(150-300 atmsferas) y altas temperaturas (400-500 C), resultando en un
rendimiento del 10-20%.
N2 (g) + 3H2(g) 2NH3(g) + H
H representa el calor generado, tambin llamado entalpa, y equivale a 92,4
kj/mol. Como libera calor, la reaccin es exotrmica.
A partir de amoniaco (NH3) lquido y anhdrido carbnico (CO2) gaseoso. Se
realiza en un reactor vertical, que opera a 188 190C y 160 Kgf/cm2
absoluta, una relacin N/C de 3,6 3,8, un tiempo de residencia de
alrededor de 45 minutos y un grado de conversin (en un paso) del 65 70
%.
Combina la formacin de carbomato (exotrmica, rpida) en su parte
inferior, por la alimentacin de CO2 y NH3 en exceso y la descomposicin
del carbomato en urea (mucho ms lenta y endotrmica).
Demanda de Urea en Latinoamrica
PAIS
ARGENTINA
VENEZUELA
ARGENTINA
BRASIL
LUGAR
BAHA BLANCA
JOS
NEUQUN
CAMACARI
BRASIL
LARANJEIRAS
MXICO
VENEZUELA
COLOMBIA
PER
CUBA
CONCLUSIONES
COSOLEACAQUE
EL TABLAZO
CARTAGENA
PISCO
CIENFUEGOS
EMPRESA
PROFERTIL
FERTINITRO
ENSI
PETROBRAS
FAFEN
PETROBRAS
FAFEN
PEMEX
PEQUIVEN
ABOCOL
CFI
CUVENPEQ
CONTENIDO
2050 MTPD
2X1850 MTPD
2X2250 MTPD
1500 MTPD
1100 MTPD
4X1500 MTPD
2X1050 MTPD
700 MTPD
2600MTPD
1800MTPD
El gas natural es un combustible que tiene un impacto medioambiental
mnimo comparado con el resto de los combustibles fsiles y cuya
utilizacin contribuye a reducir la emisin de gases de efecto invernadero.
Para la elaboracin de Urea, se fabrica primero el amonaco a partir de gas
de sntesis y aire. El gas sntesis se obtiene descomponiendo mediante
catalizadores el gas natural mezclado con vapor de agua. El gas de sntesis
tiene bsicamente H2 y CO2, los que son separados con el hidrgeno se
sintetiza amonaco NH3, utilizando el nitrgeno de aire. Luego, se reacciona
el NH3 con CO2 del gas de sntesis y se obtiene la Urea.
La fabricacin de Urea y amonaco facilitan principalmente al agro que
necesita y se ha vuelto dependiente de elementos qumicos que genera que
plantaciones y productos se desarrollen con mayor velocidad y con mejor
calidad.
En Latinoamrica est en auge la creacin y construccin de plantas de
Urea debido al boom agropecuario que existe al momento. Esto beneficia los
productores para que los costos de los productos qumicos se reduzcan y
ampla la tecnologa petroqumica en estos pases productores de
hidrocarburos de varios tipos.
REFERENCIA
Calle Martnez, Marco Antonio. (Enero 2012), Proyectos Petroqumicos, Tomo
III, Cuarta edicin. Coleccin: Maestra en Gestin en la Industria de los
Hidrocarburos. U VIRTUAL Centro de excelencia. Bolivia.
http://es.wikipedia.org/wiki/Urea
http://www.textoscientificos.com/quimica/urea
http://www.isquisa.com/site/files/productos/Urea.pdf
http://www.textoscientificos.com/quimica/urea/produccion
http://es.scribd.com/doc/141484609/Tarea-Semana-4
También podría gustarte
- Producción de UREADocumento10 páginasProducción de UREARaul Roque YujraAún no hay calificaciones
- Proceso de Obtención de La Urea y AmoniacoDocumento9 páginasProceso de Obtención de La Urea y AmoniacoDavid Briceño Gonzalez100% (1)
- Producción urea balance masa energíaDocumento7 páginasProducción urea balance masa energíaJose Luis Cedeño CevallosAún no hay calificaciones
- Producción urea NH3 CO2Documento23 páginasProducción urea NH3 CO2Luis Coronado100% (1)
- UREA de Grado AutomotrízDocumento8 páginasUREA de Grado AutomotrízIrvingAún no hay calificaciones
- Urea NweaaaasDocumento9 páginasUrea NweaaaasMagaly Gutierrez VelaAún no hay calificaciones
- Operaciones Unitarias IDocumento18 páginasOperaciones Unitarias IEvens CruzAún no hay calificaciones
- Producción Industrial de UreaDocumento9 páginasProducción Industrial de UreaAnderson David Valencia100% (1)
- PROCESO DE ELABORACIÓN DE FERTILIZANTE UREADocumento3 páginasPROCESO DE ELABORACIÓN DE FERTILIZANTE UREAVeronica Ayala CarhuatoctoAún no hay calificaciones
- Proceso de obtención de urea a partir de amoniaco y CO2Documento11 páginasProceso de obtención de urea a partir de amoniaco y CO2Omar Jesus Monasterios LaimeAún no hay calificaciones
- Obtención de CO2Documento5 páginasObtención de CO2esc_21laqm6365Aún no hay calificaciones
- SÍNTESIS DE LA UREA COMO FERTILIZANTEDocumento13 páginasSÍNTESIS DE LA UREA COMO FERTILIZANTEsamanthaAún no hay calificaciones
- Producción de urea en 2 etapasDocumento19 páginasProducción de urea en 2 etapasRocio Mamani CastroAún no hay calificaciones
- Producción industrial ureaDocumento14 páginasProducción industrial ureaMauro PalumboAún no hay calificaciones
- La Síntesis de Urea A Nivel Industrial Se Realiza A Partir de AmoníacoDocumento6 páginasLa Síntesis de Urea A Nivel Industrial Se Realiza A Partir de AmoníacoluisanamontAún no hay calificaciones
- Catalizadores en La UreaDocumento19 páginasCatalizadores en La UreaLizeth AstudilloAún no hay calificaciones
- Tecnologías de Obtención de La Urea Y SYNGASDocumento19 páginasTecnologías de Obtención de La Urea Y SYNGASmtdescargaAún no hay calificaciones
- Elaboración de Fertilizantes NitrogenadosDocumento4 páginasElaboración de Fertilizantes NitrogenadosOscar Eduardo Cobo NarváezAún no hay calificaciones
- AMONIACODocumento2 páginasAMONIACOKatherine SalazarAún no hay calificaciones
- Planta UreaDocumento13 páginasPlanta UreaRocio Guadalupe Ortega SanchezAún no hay calificaciones
- Procesos petroquímicos y síntesis de ureaDocumento5 páginasProcesos petroquímicos y síntesis de ureaalbertoramadianAún no hay calificaciones
- Obtencion de Urea Del Gas Natural 1Documento5 páginasObtencion de Urea Del Gas Natural 1Diana SujeyAún no hay calificaciones
- Producción ureaDocumento32 páginasProducción ureaNicandroGonzalesAún no hay calificaciones
- Obtencion de UreaDocumento21 páginasObtencion de UreaEfrenC.CalvoAún no hay calificaciones
- Obtencion Del AmoniacoDocumento40 páginasObtencion Del AmoniacoXio RojasAún no hay calificaciones
- Amoniaco Haber BoschDocumento6 páginasAmoniaco Haber BoschYELSENAún no hay calificaciones
- Estructura de La Operación CDM Urea Sin ContraparteDocumento20 páginasEstructura de La Operación CDM Urea Sin ContraparteJohnny Jala QuirozAún no hay calificaciones
- TEMA. - UreaDocumento32 páginasTEMA. - UreaEdson EcosAún no hay calificaciones
- AMONIACODocumento22 páginasAMONIACOFreshya Oviedo MartinezAún no hay calificaciones
- Obtencion de UreaDocumento10 páginasObtencion de UreaHernan Campos MamaniAún no hay calificaciones
- Presentacion Obtencion de AmoniacoDocumento31 páginasPresentacion Obtencion de AmoniacoALVARO HUALLPA ALVAREZAún no hay calificaciones
- Proceso Haber BoschDocumento5 páginasProceso Haber BoschKarla HerediaAún no hay calificaciones
- Procesos de Produccion Del AmoniacoDocumento5 páginasProcesos de Produccion Del AmoniacoJezz JuAún no hay calificaciones
- Proceso de producción de amoníaco y ureaDocumento14 páginasProceso de producción de amoníaco y ureaelelefanterozadoAún no hay calificaciones
- AMONÍACODocumento11 páginasAMONÍACOLiliana Beatriz FigueredoAún no hay calificaciones
- Síntesis y usos del amoniacoDocumento35 páginasSíntesis y usos del amoniacoIvan TrigoAún no hay calificaciones
- DP Planta AmoniacoDocumento17 páginasDP Planta AmoniacojluisvasquezcAún no hay calificaciones
- Producción de amoniaco y ácido nítricoDocumento15 páginasProducción de amoniaco y ácido nítricoDanny AndradeAún no hay calificaciones
- Proceso de Producción de Amoníaco - Textos CientíficosDocumento5 páginasProceso de Producción de Amoníaco - Textos CientíficosZobyAún no hay calificaciones
- AmoniacoDocumento18 páginasAmoniacoHéctor José GonzálezAún no hay calificaciones
- Procesos Petroq Fertilizantes - Marco CalleDocumento27 páginasProcesos Petroq Fertilizantes - Marco CallearmynboliviaAún no hay calificaciones
- Informe AmoniacoDocumento36 páginasInforme AmoniacoIvan TrigoAún no hay calificaciones
- Obtencion de UreaDocumento17 páginasObtencion de UreaFernandoAmésquitaAún no hay calificaciones
- Proceso de Producción de AmoníacoDocumento4 páginasProceso de Producción de AmoníacoDiego SuarezAún no hay calificaciones
- Amoniaco DerivadosDocumento16 páginasAmoniaco DerivadosLeandro Uscata QuirozAún no hay calificaciones
- Proceso de Producción de AmoníacoDocumento15 páginasProceso de Producción de AmoníacocitlaliAún no hay calificaciones
- Proceso de Producción de Amoníaco 01Documento6 páginasProceso de Producción de Amoníaco 01Melani Marca CopaliAún no hay calificaciones
- AMONIACODocumento15 páginasAMONIACONayra Estefany Salguero PerezAún no hay calificaciones
- AmoniacoDocumento4 páginasAmoniacoMarco Salazar CortésAún no hay calificaciones
- Producción de amoníaco mediante reformado con vaporDocumento5 páginasProducción de amoníaco mediante reformado con vaporOmarRomarioMartinesAún no hay calificaciones
- Obtencion Del AmoniacoDocumento4 páginasObtencion Del AmoniacoAndres R. Añez100% (1)
- Diagrama de Produccion de AmoniacoDocumento8 páginasDiagrama de Produccion de AmoniacoSoraya Ochoa VillamizarAún no hay calificaciones
- Obtención de amoníaco mediante reformado con vaporDocumento15 páginasObtención de amoníaco mediante reformado con vaporNayra Estefany Salguero PerezAún no hay calificaciones
- Balance de materia orientado a procesosDe EverandBalance de materia orientado a procesosAún no hay calificaciones
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADe EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSAAún no hay calificaciones
- Reutilización de aguas residuales en la industria azucarera y AlcoholeraDe EverandReutilización de aguas residuales en la industria azucarera y AlcoholeraAún no hay calificaciones
- MF1165_3 - Instalaciones de ventilación-ExtracciónDe EverandMF1165_3 - Instalaciones de ventilación-ExtracciónAún no hay calificaciones
- Automotive Repair Service QualityDocumento10 páginasAutomotive Repair Service QualityDairoAndresTrillosPuentes100% (1)
- CAR DIAGNOSIS CENTERS SERVICE EVALUATIONDocumento30 páginasCAR DIAGNOSIS CENTERS SERVICE EVALUATIONManuel FernandoAún no hay calificaciones
- Tipos de OrganizacionesDocumento1 páginaTipos de OrganizacionesDairoAndresTrillosPuentesAún no hay calificaciones
- Licencias Ambientales Petroleras en ColombiaDocumento3 páginasLicencias Ambientales Petroleras en ColombiaDairoAndresTrillosPuentesAún no hay calificaciones
- Paradigmas de MantenimientoDocumento10 páginasParadigmas de MantenimientoDairoAndresTrillosPuentesAún no hay calificaciones
- Urea AmoniacoDocumento7 páginasUrea AmoniacoDairoAndresTrillosPuentesAún no hay calificaciones
- Fact Ura CreditoDocumento1 páginaFact Ura CreditoDairoAndresTrillosPuentesAún no hay calificaciones
- ISO 9001 9002 9 Organizacion de EstandarizacionDocumento19 páginasISO 9001 9002 9 Organizacion de EstandarizacionDairoAndresTrillosPuentesAún no hay calificaciones
- CodigoNacionalTransito PDFDocumento118 páginasCodigoNacionalTransito PDFJuanSerranoAún no hay calificaciones
- ISO 9001 9002 9 Organizacion de EstandarizacionDocumento19 páginasISO 9001 9002 9 Organizacion de EstandarizacionDairoAndresTrillosPuentesAún no hay calificaciones
- Proyecto Oleoducto PetrodtpDocumento9 páginasProyecto Oleoducto PetrodtpDairoAndresTrillosPuentesAún no hay calificaciones
- Aspectos Considerar en Una FermentaciónDocumento10 páginasAspectos Considerar en Una FermentaciónYudhid LiRaAún no hay calificaciones
- By-Pass EnsayoDocumento12 páginasBy-Pass EnsayoDanielita SolAún no hay calificaciones
- Informe Final Trabajo de GradoDocumento6 páginasInforme Final Trabajo de GradoCheminar ValitaAún no hay calificaciones
- Pisos de Madera y LaminadoDocumento21 páginasPisos de Madera y LaminadoNaty Paola Torres RojasAún no hay calificaciones
- PRÁCTICA DE LABORATORIO 12: Caramelización en medios ácidos y alcalinos, y obtención de cristales de sacarosaDocumento9 páginasPRÁCTICA DE LABORATORIO 12: Caramelización en medios ácidos y alcalinos, y obtención de cristales de sacarosaRobinho TanAún no hay calificaciones
- Aminoacidos y ProteinasDocumento46 páginasAminoacidos y ProteinasNelson Choque MamaniAún no hay calificaciones
- Nitrilos 090815132837 Phpapp01Documento3 páginasNitrilos 090815132837 Phpapp01Lia Nails Rojas VizcarraAún no hay calificaciones
- Micronutrientes en La Fisiología de Las PlantasDocumento7 páginasMicronutrientes en La Fisiología de Las PlantasGiovanaAún no hay calificaciones
- Materiales de SuturaDocumento7 páginasMateriales de SuturaWendy OviedoAún no hay calificaciones
- Glucósidos cardiotónicos y sus ensayos fitoquímicosDocumento8 páginasGlucósidos cardiotónicos y sus ensayos fitoquímicosPaul AndreiAún no hay calificaciones
- Desnaturalización de ProteínasDocumento6 páginasDesnaturalización de ProteínasAriel PedrozoAún no hay calificaciones
- AnálisisAperitivoVínicoMoscatelDocumento4 páginasAnálisisAperitivoVínicoMoscatelJhon RamirezAún no hay calificaciones
- Célula procariota: estructura y característicasDocumento18 páginasCélula procariota: estructura y característicasPaulino RodriguezAún no hay calificaciones
- OrganohalurosDocumento13 páginasOrganohalurosYarely AlvarezAún no hay calificaciones
- Segundo MensajeroDocumento3 páginasSegundo MensajeroJhonatan AltamiranoAún no hay calificaciones
- Previo Practica 10Documento9 páginasPrevio Practica 10Eduardo Trejo100% (1)
- Cidelsa - Una Nueva Visión Del MundoDocumento5 páginasCidelsa - Una Nueva Visión Del MundoGerardo Revelo SanchezAún no hay calificaciones
- Extracción de ADN de plátano en casaDocumento2 páginasExtracción de ADN de plátano en casaLeonardoAún no hay calificaciones
- HeterociclosDocumento4 páginasHeterociclosGabrielaAún no hay calificaciones
- Síntesis de poliestireno a partir de la polimerización del estirenoDocumento11 páginasSíntesis de poliestireno a partir de la polimerización del estirenoDianna Laura SGAún no hay calificaciones
- Bio AbonosDocumento19 páginasBio AbonosluisAún no hay calificaciones
- Termoplásticos: Propiedades y AplicacionesDocumento27 páginasTermoplásticos: Propiedades y AplicacionesReyna Contreras0% (1)
- Clase 8 EncurtidosDocumento3 páginasClase 8 EncurtidosJulio Marcelo Cuadros SaavedraAún no hay calificaciones
- Analisis de BiomoleculasDocumento5 páginasAnalisis de BiomoleculasAbraham Camilo Montes HumanezAún no hay calificaciones
- Resuelto Por Banco de Preguntas Previo ADocumento5 páginasResuelto Por Banco de Preguntas Previo AjholvyAún no hay calificaciones
- Fibra PoliésterDocumento15 páginasFibra PoliésterivantexAún no hay calificaciones
- Ensayo HERENCIA YEVOLUCIONDocumento15 páginasEnsayo HERENCIA YEVOLUCIONWalescka CutéAún no hay calificaciones
- Práctica - NaranjaII Anaranjado de Metilo EQUIPO 10 4IM53Documento12 páginasPráctica - NaranjaII Anaranjado de Metilo EQUIPO 10 4IM53Osvaldo LagunaAún no hay calificaciones
- ALDEHIDOS Y CETONAS Clase 2020Documento137 páginasALDEHIDOS Y CETONAS Clase 2020Geraldine Gonzalez PatinoAún no hay calificaciones
- Monografia Fases Del EnsilajeDocumento10 páginasMonografia Fases Del EnsilajeAuristela Gómez SalvadorAún no hay calificaciones