Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Fisicoquimica Ambiental
Cargado por
GARKTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Fisicoquimica Ambiental
Cargado por
GARKCopyright:
Formatos disponibles
1
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA
ESCUELA DE CIENCIAS AGRICOLA, PECUARIAS Y DEL MEDIO AMBIENTE
ECAPMA
PROTOCOLO DE PRCTICAS PARA LA ESCUELA
FISICOQUMICA AMBIENTAL
Cdigo: 358115
Director Nacional
JAIRO ENRIQUE GRANADOS MORENO., MSc.
2014
2
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
I ACTIVIDADES PARA EL ESTUDIANTE
PRACTICAS DE LABORATORIO
1. IDENTIFICACION DE LA PRCTICA
Nombre de curso
Fisicoqumica Ambiental
Cdigo de curso 358115
Valor de esta
actividad prctica
Se asignar un valor en puntos segn la rbrica de evaluacin
Nombre del director
de curso
Jairo Enrique Granados Moreno
CEAD al que
pertenece
Sede Nacional Jos Celestino Mutis
Contacto del director
de curso
jairo.granados@unad.edu.co
Tel:3443700-Ext: 374. Cel.3202280647
Espacio donde se
debe desarrollar la
prctica
Laboratorios de Bioqumica y Nutricin Sede Nacional JCM,
Laboratorios de Nutricin y qumica, sede Valledupar
Laboratorios de Nutricin y Qumica, sede Tunja
CEAD instituciones en convenio que dispongan de la
infraestructura para el desarrollo de los protocolos
Objetivos de la
prctica
Estudiar procesos fisicoqumicos ambientales que involucren
conceptos como: capacidad calorfica, entalpa molar de
disolucin, gases, cintica de reacciones y adsorcin en suelos y
soluciones
Justificacin de la
prctica
La fisicoqumica dedica su principal atencin a estudiar las
teoras, leyes, principios y conceptos, relacionados con los
procesos qumicos que ocurren en el tiempo y con el equilibrio
qumico, teniendo en cuenta la accin de potenciales como la
energa libre molar (potencial qumico) y la entropa (potencial
termodinmico) .Cuando este enfoque se da en el anlisis de
procesos a nvel de la biosfera (suelo, agua y atmsfera) ,se
aterriza en la fisicoqumica ambiental. Las leyes de cmo las
3
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
reacciones qumicas ocurren comienzan a entenderse ms en la
interaccin concreta de iones, tomos y molculas con otras y
con radiacin (fotoqumica). La tarea principal y general de la
fsico qumica ser entonces predecir como ocurrir una reaccin
qumica en el tiempo y el resultado final (el estado de equilibrio)
en diferentes condiciones ambientales, teniendo en cuenta datos
de la estructura y propiedades de las molculas de las sustancias
formadas del sistema estudiado.
Competencias a
desarrollar
El estudiante comprende los elementos conceptuales,
procedimentales y metodolgicos que estn involucrados en la
cuantificacin de: capacidad calorfica, entalpa molar de
disolucin, constante universal de los gases, parmetros cinticos
y variables de adsorcin en suelos y soluciones
Duracin de la
prctica.
12 horas
Mecanismo mediante
el cual se evaluar la
prctica:
A travs de la rbrica de evaluacin la cual va adjunta al final de
del presente protocolo (la misma que est en el aula virtual)
2. METODOLOGIA
PRCTICA 1. DETERMINACIN DE LA ENTALPA MOLAR DE DISOLUCIN (H
sn
) Y
ENTROPA DE UNA MEZCLA BINARIA (Sm)
OBJETIVOS:
1. Hallar la capacidad calorfica de un calormetro (C) mediante el balance de calor
establecido en la mezcla de masas de agua a diferente temperatura
2. Determinar el calor de producido en la disolucin de Hidrxido de Sodio en agua
3. Calcular la entalpa de molar de disolucin y el cambio entrpico molar de la mezcla en
el proceso anterior
4. Encontrar el porcentaje de error del Hsn encontrado en esta experiencia.
4
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
FUNDAMENTO TERICO
La capacidad calorfica (C), como propiedad extensiva de una sustancia, indica la
cantidad de calor que se requiere para elevar un grado Celsius la temperatura de una
determinada cantidad de sustancia, su valor se halla mediante la ecuacin: C=mc
e
,
ahora, Si se conoce el calor especfico (c
e
) y la cantidad de una sustancia, entonces el
cambio en la temperatura de la muestra (t) indicar la cantidad de calor (q)
1
que se ha
absorbido o liberado en un proceso en particular. La ecuacin para calcular el cambio de
calor es:
q =mct
donde m es la masa de la muestra y t es el cambio de la temperatura:
t = t
final
t
inicial
El calor liberado o absorbido por reacciones que se mantienen bajo presin constante
puede relacionarse a una propiedad que se llama entalpa y se le da el smbolo de H, es
una propiedad extensiva y depende de la cantidad de materia.
Para una disolucin mezcla de dos componentes, La entalpa molar de disolucin
(Hsn), corresponde al calor que libera absorbe un sistema cuando se aade a
temperatura y presin constantes, 1 mol de soluto a una cantidad suficiente de un
disolvente para producir una solucin de la concentracin deseada (Levine I.,1996); esta
magnitud se expresa as:
Hsn=
Donde Q
sn
es el calor de disolucin y n representa el nmero de moles del soluto aadido.
1
q es positivo para procesos endotrmicos y negativo para procesos exotrmicos
5
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
En esta prctica, se evaluar Hsn, en un proceso de disolucin acuosa de NaOH.
Para este propsito se aadir una cantidad conocida de hidrxido de sodio en un
volumen fijo de agua .Midiendo subsecuentemente las temperaturas final e inicial del
sistema y Con base en los datos del calormetro, se realizar un balance de calor para
determinar la entalpa molar de disolucin, de acuerdo a la siguiente ecuacin :
Q
liberado
= -(Q
calormetro
+ Q
sn
)
Donde :
Q
calormetro=
C.T = C (T
2
-T
1
) y Q
sn
= m
sn
C
sn
T
C, representa la capacidad calorfica del calormetro vaso Dewar y se halla:
C=m
c
c
e
(m
c
indica la masa del calormetro y c
e
= calor especfico del recipiente ,
el cual se determina en la etapa de calibracin)
Finalmente, la entalpa molar se halla as: Hsn=
Adicionalmente con base en este procedimiento, se puede calcular el valor de la entropa
de mezcla(S
m
) de solucin , de la siguiente forma:
S
m
=2,303.n
sto
C
sn
log
Recordando que C
sn
es el calor especfico de la solucin, el cual habitualmente es muy
parecido al del agua pura
MATERIALES
6
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Calormetro (Vaso Dewar, termo recipiente de icopor), Beaker (vaso de precipitado),
Probeta graduada de 100mL , Termmetro, Balanza analtica
REACTIVOS: Hidrxido de sodio en lentejas, Agua destilada, muestra de agua de ro,
quebrada de origen industrial, agrcola pecuaria.
PROCEDIMIENTO:
1. Calibracin del calormetro vaso Dewar
Lavar y secar el vaso Dewar (dejarlo secar al aire libre para que tome la temperatura
ambiente), pesarlo en la balanza y registrar como :m
c
En un beaker calentar 100 mL de agua hasta alcanzar 80C (T
1
)
Alistar 100mL de agua en otro beaker, medir su temperatura (T) y adicionarla al
calormetro vaso Dewar, taparlo y tomar lecturas de la temperatura del agua cada
minuto, durante 5 minutos, hasta que permanezca constante ,registrar como T
0
Despus de transcurrido este tiempo , agregar los 100mL de agua que estn a 80C,
tapar inmediatamente el vaso Dewar, agitar y leer la temperatura de la mezcla cada
minuto durante 5min ,verificando que la temperatura de equilibrio ,permanece
constante ; registrar este ltimo valor como : T
eq
TABLA DE DATOS
Sustancia
TEMPERATURA (C)
T T
1
T
0
T
eq
Agua(ambiente)
___ ___
Agua caliente
____ ____ ___
Mezcla
____ ____ ____
Calormetro
m
c
=
7
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
CLCULOS
A partir de las temperaturas T y T
1
y utilizando la siguiente ecuacin:
d=
encontrar la densidad de las masas de agua utilizadas en la mezcla
Teniendo en cuenta el volumen de agua, adicionado al calormetro y la densidad,
hallar la masa en gramos de cada muestra . registrar as: m
1
para el agua a temperatura
ambiente ( T ) y m
2
para el agua caliente( T
1
)
Con base en la ecuacin de balance de calor:
Q
ganado
=-Q
cedido
donde:
Q
ganado
= es el calor ganado por el calormetro y la masa de agua a temperatura
ambiente
Q
cedido
= es el calor perdido por la masa de agua caliente.
Se tiene que:
m
c
C
e
(T
eq
- T
0
) + m
1
C
H2O
(T
eq
- T
0
)=-m
2
C
H2O
(T
eq
- T
1
)
De esta expresin se debe despejar C
e
y luego reemplazar los datos obtenidos.
Con el valor de C
e
y la masa del calormetro, calcular su capacidad calorfica C
2. Calor Especfico de una muestra de agua de origen industrial agrcola
pecuaria, etc.
Lavar y secar el vaso Dewar (dejarlo secar al aire libre para que tome la temperatura
ambiente), pesarlo en la balanza y registrar como : m
c
8
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
En un beaker calentar 100 mL de agua destilada, hasta alcanzar 80C (T
1
)
Alistar 100mL de la muestra de agua industrial, pecuaria agrcola, etc, en otro
beaker, medir su temperatura (T) y adicionarla al calormetro vaso Dewar, taparlo
y tomar lecturas de la temperatura del agua cada minuto, durante 5 minutos, hasta
que permanezca constante ,registrar como T
0
Despus de transcurrido este tiempo , agregar los 100mL de agua que estn a 80C,
tapar inmediatamente el vaso Dewar, agitar y leer la temperatura de la mezcla cada
minuto durante 5min ,verificando que la temperatura de equilibrio ,permanece
constante ; registrar este ltimo valor como : T
eq
TABLA DE DATOS
Sustancia
TEMPERATURA (C)
T T
1
T
0
T
eq
Muestra de Agua
___ ___
Agua caliente
____ ____ ___
Mezcla
____ ____ ____
Calormetro
m
c
=
CLCULOS
A partir de las temperaturas T y T
1
y utilizando la siguiente ecuacin:
d=
encontrar la densidad de las masas de agua utilizadas en la mezcla
9
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Teniendo en cuenta el volumen de agua, adicionado al calormetro y la densidad,
hallar la masa en gramos de cada muestra, registrar as: m
1
para la muestra de
agua, a temperatura ambiente ( T ) y m
2
para el agua caliente( T
1
)
Con base en la ecuacin de balance de calor:
Q
ganado
=-Q
cedido
Se tiene que:
m
c
C
e
(T
eq
- T
0
) + m
1
C
m
(T
eq
- T
0
)=-m
2
C
H2O
(T
eq
- T
1
)
Donde: C
m
es la capacidad calorfica de la muestra de agua analizada.
De esta expresin se debe despejar C
m
y luego reemplazar los datos obtenidos.
3. Entalpa molar de disolucin del hidrxido de sodio en agua.
Alistar el calormetro, lavar y secar
Pesar exactamente en un vidrio de reloj 2 g de NaOH (anotar como m
NaOH
),
medir su temperatura :T
1
Adicionar 100mL de agua destilada al calormetro, taparlo e inmediatamente
registrar la temperatura del sistema cada minuto durante 5 min, hasta que
permanezca constante (T
0
), anotarla en su tabla de datos
Despus de transcurrido este tiempo , agregar el NaOH rpidamente al calormetro
utilizando una varilla de vidrio, tapar inmediatamente el vaso Dewar, agitar
vigorosamente y leer la temperatura de la mezcla cada minuto durante 5 min,
verificando que el sistema alcance la temperatura de equilibrio permaneciendo
constante ; registrar este ltimo valor como : T
eq
, en su tabla de datos
Desocupar, lavar y escurrir el calormetro.
4. Capacidad calorfica de una muestra de suelo
Alistar el calormetro, lavar y secar
Pesar exactamente en un vidrio de reloj ms menos, 20 g de suelo (anotar como
m
suelo
), medir su temperatura :T
1
10
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Adicionar 100mL de agua destilada al calormetro, taparlo e inmediatamente
registrar la temperatura del sistema cada minuto durante 5 min, hasta que
permanezca constante (T
0
), anotarla en su tabla de datos
Despus de transcurrido este tiempo , agregar el suelo rpidamente al calormetro
utilizando una varilla de vidrio, tapar inmediatamente el vaso Dewar, agitar
vigorosamente y leer la temperatura de la mezcla cada minuto durante 5 min,
verificando que el sistema alcance la temperatura de equilibrio permaneciendo
constante ; registrar este ltimo valor como : T
eq
, en su tabla de datos
Desocupar, lavar y escurrir el calormetro
TABLA DE DATOS
Sustancia
TEMPERATURA (C)
T T
1
T
0
Teq
Agua(ambiente)
____ ___ ___
NaOH
____ ____ ___
Disolucin
____ ____ ____
Calormetro
m
c
=
Suelo
CLCULOS
A partir de la temperatura T
0
y utilizando la siguiente ecuacin:
11
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
d=
encontrar la densidad de la masa de agua adicionada al calormetro
Con base en la ecuacin de balance de calor:
Q
ganado
=-Q
cedido
= Q
sn
donde:
Q
ganado
=es el calor ganado por el calormetro y la masa de agua a temp
ambiente (T
0
)
Q
cedido
= es el calor desprendido por efecto de la disolucin del NaOH
Se tiene que:
Q
sn
=-( C (T
eq
- T
0
) + m
NaOH
C
H2O
(T
eq
- T
1
))
El calor cedido en el proceso har que aumentar la temperatura del agua, del
calormetro y del propio NaOH. La aproximacin que se hace es considerar el calor
especfico del hidrxido similar al del agua (C
H2O
=1cal /g.C= 4,18 J/g.C).
Teniendo en cuenta el valor hallado de Q
sn
y el nmero de moles de Hidrxido de
sodio adicionado al calormetro , calcular la entalpa molar de disolucin , as:
Hsn=
Calcular la molaridad (M) de la disolucin estudiada.
12
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Comparar el valor obtenido con lo reportado en literatura y calcular el porcentaje
de error. Analizar las posibles causas de error.
Con base en la informacin de los numerales anteriores, determinar la entropa de
la mezcla , segn la ecuacin:
S
m
=2,303.n
NaOH
C
sn
log
Realizar los mismos clculos para encontrar el calor cedido en la disolucin de la
muestra de suelo
TABLA DE RESULTADOS
Material
INDICADORES
C M Hsn S
m
Calormetro ______ _______
NaOH
aq
______
Suelo
GRFICAS
Elaborar un diagrama de barras que muestre los resultados obtenidos
DISCUSIN E INTERPRETACIN DE RESULTADOS
Analice, discuta y confronte los resultados obtenidos , con su revisin de literatura
CONCLUSIONES
Plantear por lo menos 4 conclusiones finales relacionadas con lo diScutido en los
resultados de la prctica.
13
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
CUESTIONARIO
1. Consultar los tipos de calormetro y sus caractersticas fisicoqumicas.
2. Qu significa calor diferencial de una solucin?
3. Cules son las aplicaciones industriales de la entalpa molar de disolucin?
4. Cul es el papel fisicoqumico que desempean los iones Na
+
aq
y Cl
-
aq
en el
proceso de disolucin?
5. Hallar el calor de disolucin del NaOH en agua, cuando al disolver 1,2g de NaOH
slido en 250 mL, la temperatura de la disolucin se incrementa en 1,24 C. As
mismo, calcular la entalpa molar de disolucin del NaOH.
BIBLIOGRAFA
Levine Ira N.(1996) Fisicoqumica , Ed McGraw-Hill, cuarta edicin. Madrid,
Espaa
Romero C y Blanco L (1996).Tpicos en qumica bsica, experimentos de laboratorio.
Academia Colombiana de Ciencias Exactas, Fsicas y Naturales. Bogot D.C
Castellan W., Fisicoqumica,(1987) , Pearson Educacin, Mxico D.F , Segunda
edicin
14
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
PRCTICA 2. DETERMINACIN DE LA CONSTANTE UNIVERSAL DE LOS GASES
OBJETIVOS
1. Recolectar gas carbnico a partir de la reaccin entre el cido clorhdrico y el carbonato
de calcio
2. Establecer la relacin entre el nmero de moles(n) y el volumen de CO
2
(V) producido
en condiciones de P y T constantes
3. Determinar por mtodo grfico y estadstico la constante R de los gases, a partir de la
pendiente de la recta de V contra n
4. Hallar el porcentaje de error del valor de la constante universal de los gases calculada
en esta experiencia.
FUNDAMENTO TERICO
Relacin del volumen con el Nmero de moles
Teniendo presente que 1mol de oxgeno pesa 32 g, contiene 6,02x10
23
molculas y ocupa
un volumen de 22,414L en condiciones normales, luego 2 moles de oxgeno pesarn 64g,
poseern 12,04x10
23
molculas y ocuparn un volumen de 44,828 L en condiciones
normales.
De lo anterior se puede deducir que el volumen de un gas vara directamente proporcional
al nmero de moles del mismo, es decir, V n tambin:
Por lo tanto, su relacin grfica ser una lnea recta, como lo muestra en la siguiente
figura:
Ecuacin de estado para un Gas Ideal
15
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
La ley combinada nos indica que: V T/P y adems, partiendo del principio de Avogadro
se obtiene : V n , Combinando estas proporcionalidades, se halla que:
tambin: , Despejando K, s e obtiene:
Ahora, si se analiza el valor de K en condiciones normales o estndar para n= 1 mol de gas
,se obtiene lo siguiente:
R se denomina la constante universal de los gases, esto significa que:
Grfica 1. Relacin entre V y n con P y T constantes
16
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Esta es la famosa ecuacin de estado de los gases ideales, una de las ms importantes en
fisicoqumica, ya que establece la relacin directa entre presin, volumen, nmero de
moles y temperatura de un gas , permitiendo el clculo de cualquiera de las 4 variables (
P, V n, T ),s se conoce el valor de tres de ellas.
De la ecuacin de estado, se puede demostrar que :
Por lo tanto, al obtener la grfica de V contra n y linealizarla por el mtodo estadstico de
los mnimos cuadrados, se hallar la pendiente (m) , la cual equivaldr a la expresin ;
de sta relacin se puede despejar el valor de la constante R, as:
Como: m= entonces R= , luego al reemplazar los valores de la pendiente de la
recta, lo mismo que presin y temperatura del gas y ajustando las respectivas unidades, se
hallar R
El error relativo porcentual, se calcula as:
%Error =
Valores de R
La constante universal de los gases puede expresarse en un conjunto de unidades,
dependiendo de las que se le asignen a la presin y el volumen. Adems, R puede
relacionarse con unidades de trabajo y energa. Estos valores se resumen en la siguiente
tabla:
Tabla 1. Valores de la constante universal de los gases expresada en diferentes unidades.
VALORES DE R UNIDADES
0,082 Litros-atm / mol x grado kelvin
8,31 Joules / grado Kelvin
1,98 Caloras / mol x grado Kelvin
17
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
8,31 x 10
7
Ergios / mol x grado Kelvin
10,73 psia= pie cbico / lb mol x grado Rankine
En esta experiencia, se estudiar la relacin entre volumen y nmero de moles de CO
2
,
generado a partir de la reaccin qumica entre el HCl y el CaCO
3
(tambin se puede utilizar
NaHCO
3
). La ecuacin es la siguiente:
2HCl
(aq)
+ CaCO
3(s)
CO
2(g)
+ H
2
O
(l)
+ CaCl
2(aq)
Para lograr el objetivo propuesto, se harn reaccionar cantidades diferentes de CaCO
3
en
un volumen fijo de HCl 2N, luego se recolectar el gas en una cuba hidroneumtica,
donde se medir el volumen de desplazamiento y la temperatura.
MATERIALES
Baln de fondo plano con desprendimiento lateral, Tapones de caucho horadados,
manguera con acople de vidrio, esptula metlica, probeta graduada de 500mL , beaker
grande de 1 L, termmetro, balanza analtica
REACTIVOS
Carbonato de calcio bicarbonato de sodio
cido clorhdrico 2N
Agua destilada
PROCEDIMIENTO
Alistar el montaje que se muestra a continuacin:
18
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Figura1. Montaje de cuba hidroneumtica para obtener gas carbnico
Llenar completamente la probeta con agua destilada e invertirla sobre el beaker
que tambin contiene agua hasta ms o menos partes de su volumen (se puede
utilizar tambin una cubeta de plstico). Es importante que no queden burbujas en
el agua de la probeta y que sta permanezca llena hasta el fondo de la misma.
Pesar cuidadosamente, s es posible en balanza analtica , ms menos : 0,1g ;
0,2g ; 0,4g ;0,8g y 1,2 g de CaCO
3
Adicionar 200mL de HCl 2N en el baln de fondo plano, luego agregar 0,1g de
CaCO
3
(w
1
), tapar, conectar inmediatamente la manguera y recolectar el CO
2
mediante el desplazamiento del agua en la probeta. Cuando la reaccin cese,
entonces medir el volumen (V
1
) de gas producido.
Tomar la probeta, tapar la boca con la mano, introducir cuidadosamente el
termmetro y medir la temperatura (T
1
) del gas, registrar en la tabla de datos.
Desocupar el baln , lavarlo ,secarlo y adicionarle otros 200mL de HCl 2N
Agregar al baln nuevamente 0,2 g de CaCO
3
(w
2
), realizar el mismo montaje que
se explic anteriormente y medir volumen (V
2
) de CO
2
y la temperatura (T
2
) de
ste en la probeta.
Repetir el procedimiento con las dems cantidades de CaCO
3
y medir laos
respectivos volmenes y temperaturas del CO
2
obtenido, registrar estos valores en
la tabla de datos.
TABLA DE DATOS
Tabla 2. Volmenes y temperaturas de CO
2
obtenidos en las 5 experiencias
Experimento W
CaCO3
(g) V
CO2
(mL) T (C)
1 0,1 V
1
T
1
2 0,2 V
2
T
2
3 0,4 V
3
T
3
4 0,8 V
4
T
4
5 1,2 V
5
T
5
19
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
CLCULOS
A partir de los gramos de CaCO
3
adicionados y teniendo en cuenta la
estequiometria de la reaccin, Calcular las moles de CO
2
producidas en cada
experiencia.
Consultar la presin atmosfrica de la regin , lo mismo que la presin de vapor del
agua a la temperatura trabajada y encontrar la presin del gas carbnico. Es decir:
P
CO2
=P
atmosfrica
P
Vapor de
H2O
Con base en las temperaturas medidas en cada experimento, sacar un promedio
(T
prom
)
Completar la siguiente tabla:
Experimento n
CO2
(moles) V
CO2
(mL) T
prom
(K) P
CO2
(atm)
1
2
3
4
5
Graficar Volumen contra nmero de moles de CO
2
,
Linealizarla por el mtodo estadstico de los mnimos cuadrados , encontrar la
pendiente(m) y el coeficiente de correlacin (r
2
)
Teniendo en cuenta la pendiente de la recta, lo mismo que temperatura promedio
y presin del gas carbnico , calcular la constante universal de los gases (R)
Hallar el porcentaje de error, del valor obtenido experimentalmente para R
GRFICAS
Mostrar las respectivas grficas de V contra n
20
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
DISCUSIN E INTERPRETACIN DE RESULTADOS
Analice, discuta y confronte los resultados obtenidos, con su revisin de literatura.
CONCLUSIONES
Plantear por lo menos 4 conclusiones finales relacionadas con lo discutido en los
resultados de la prctica.
CUESTIONARIO
1. Cules son los principales factores de error en este experimento?
2. Calcular el rendimiento eficiencia de la reaccin qumica en cada experimento
,promediar los valores y analizar el resultado
3. Cul ser la relacin entre volumen y nmero de moles para un gas real no
ideal?
4. Cules son las principales ecuaciones de estado de los gase reales no ideales?
BIBLIOGRAFA
Levine Ira N.(1996) Fisicoqumica , Ed McGraw-Hill, cuarta edicin. Madrid,
Espaa
Romero C y Blanco L (1996).Tpicos en qumica bsica, experimentos de laboratorio.
Academia Colombiana de Ciencias Exactas, Fsicas y Naturales. Bogot D.C
Castellan W., Fisicoqumica,(1987) , Pearson Educacin, Mxico D.F , Segunda
edicin
Granados J.,(1999),Fisicoqumica aplicada. Ed antropos, UNAD, facultad de ciencias
agrarias , segunda edicin. Bogot D C
21
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
PRCTICA 3. CINTICA DE LA DESCOMPOSICIN DEL TIOSULFATO DE SODIO, POR MEDIO
DEL HCl CONCENTRADO.
OBJETIVOS:
1. Estudiar la cintica de la reaccin entre el tiosulfato de sodio y el cido clorhdrico,
a partir de soluciones estndar de tiosulfato y manteniendo constante la
concentracin del HCl durante el proceso.
2. Encontrar el orden de reaccin (n), con respecto al tiosulfato, lo mismo que la
constante especfica de velocidad (K) por el mtodo diferencial de Jacobus Vant
Hoff.
3. Determinar el semiperiodo o perodo de vida media (t
1/2
) para esta reaccin.
4. Hallar la energa de activacin (Ea) y el factor de frecuencia (A) de esta reaccin,
aplicando la ley de Arrhenius
FUNDAMENTO TERICO
El tiosulfato de sodio reacciona con el HCl de acuerdo a la siguiente reaccin:
El cido clorhdrico reacciona con el tiosulfato poniendo en libertad al cido tiosulfrico
(H
2
S
2
O
3
), que se descompone instantneamente en dixido de azufre, agua y azufre, el
cual se precipita en la solucin produciendo u opacamiento de la misma. De esta forma, a
travs de la reduccin del azufre (2S
+2
+ 4e
-
--> 2S), se puede seguir la cintica de esta
reaccin.
La ley de velocidad es:
; donde
Aplicando el logaritmo decimal a ambos lados de la ecuacin de velocidad (mtodo
diferencial de Jacobus Vant Hoff), se obtiene:
22
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Estas ecuacin es una expresin lineal de la forma: Y = mX + b, donde, ;
m=n y . Por lo tanto, al graficar LogV contra , se debe obtener
una lnea de pendiente igual al orden de reaccin (n) e intercepto b=Log K[HCl]. Esto
significa:
A partir del intercepto, se calcula el valor de la constante especfica de velocidad (K):
, entonces
Conociendo este dato (K) y suponiendo que la reaccin es de primer orden, se determina
el semiperodo o perodo de vida media (t
1/2
) as:
Adems, si el proceso se desarrolla a dos temperaturas diferentes, puede encontrarse la
energa de activacin de la reaccin (Eac) y el factor de frecuencia de colisiones (A),
aplicando la ecuacin o el mtodo grfico de la ley de Arrhenius.
De la anterior ecuacin se puede despejar A, con el fin de sustitur los valores de:
energa de activacin , Temperatura y constante especfica de velocidad , para hallar el
factor de frecuencia de colisiones.
23
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
LISTA DE MATERIALES LISTA DE REACTIVOS
5 Beaker de 80 mL
Tiosulfato de sodio
(Na2S2O3) 0,1M
Pipetas graduadas de 5 y 10 mL HCl 1N
4 cronmetros Agua destilada
Termmetros
Bao termostatado o aparato de
calentamiento (mechero, trpode,
malla de asbesto)
Matraz de 1L
Balanza
PROCEDIMIENTO:
1. Alistar las soluciones de tiosulfato sdico (Na
2
S
2
O
3
)0,1 N y cido clorhdrico 1N.
2. Lavar 4 erlenmeyers pequeos (80 o 100 mL), rotularlos del 1 al 4 y colocarlos
luego en un recipiente que contenga agua a temperatura ambiente (T
1
). Registrar
este valor con el termmetro.
3. A partir de la solucin de tiosulfato sdico, preparar soluciones 0,05 M;0,025 M y
0,0125M de la siguiente forma:
Beaker [Na2S2O3] mL tiosulfato
mL agua
destilada
1 0,1 M 10 0
2 0,05 M 5 5
3 0,025 M 2,5 7,5
4 0,0125 M 1,25 8,75
4. Mezclar suavemente las soluciones anteriores.
5. Alistar el cronmetro en ceros y rpidamente agregar al beaker 1, 10 mililitros de
HCl 1N. Medir el tiempo (en minutos o segundos), que tarda la solucin en
opacarse totalmente.
24
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
6. Repetir el procedimiento anterior, pero colocando los beakers en un bao de hielo.
Registrar la temperatura (T
2
) y el tiempo en minutos que tardan las soluciones en
opacarse totalmente.
TABLA DE DATOS:
BEAKER [Na
2
S
2
O
3
] (M)
TIEMPO (min)
T
1
(C) T
2
(C)
1 0,1000
2 0,0500
3 0,0250
4 0,0125
CLCULOS Y GRFICAS
1. Para cada temperatura trabajada (T
1
y T
2
), completar la siguiente tabla:
T
1
(K ) [Na
2
S
2
O
3
] t(min)
Log [Na
2
S
2
O
3
] Log V
0,1000M
0,0500M
0,0250M
0,0125M
2. En una sola hoja milimetrada, y con diferentes colores, trazar las grficas de Log V
contra Log [Na
2
S
2
O
3
], para cada temperatura.
3. Linealizar las anteriores grficas por el mtodo de los mnimos cuadrados y a partir
de la pendiente (m) y el intercepto (b), calculados para cada una, encontrar el
orden de reaccin (n) y las constantes especficas de velocidad (K
1
y K
2
).
25
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
4. Trazar las grficas corregidas en una hoja milimetrada, indicando la ecuacin
respectiva de cada una.
5. A partir de K
1
y K
2
; T
1
y T
2
, determinar la ENERGA DE ACTIVACIN en cal/mol;
Kcal/mol y BTU/mol, lo mismo que el FACTOR DE FRECUENCIA (A) para esta
reaccin. (utilizar el mtodo algebraico o grfico de Arrhenius).
6. Trazar la grfica de Log K contra 1/T y a partir del intercepto (b), encontrar el factor
de frecuencia de Arrhenius (A=antilog (b)). Comparar este valor con el que obtuvo
en 5.
7. Graficar Log[Na
2
S
2
O
3
] contra tiempo, para la temperatura (T
1
); linearizar por
mnimos cuadrados y por medio de la pendiente, calcular la constante especfica
de velocidad (k
1
) de la siguiente forma:
8. Comparar los valores de k
1
, hallados en 3 y 7, analizar.
9. Con el valor de K1 encontrado en 7, hallar el perodo de vida media de la reaccin
(t
1/2
).
10. Trazar la grfica de [Na
2
S
2
O
3
] contra tiempo, analizar.
TABLA DE RESULTADOS
T (K) n k(min
-1
)
Eac
(cal/mol)
t1/2(min)
T1=
T2=
26
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
GRAFICAS
Recuerde que debe presentar las siguientes grficas:
1. Log V contra Log[Na
2
S
2
O
3
]
2. Log k contra 1/T (K)
3. Log [Na
2
S
2
O
3
] contra t (min)
4. [Na
2
S
2
O
3
] contra t (min)
CUESTIONARIO:
1. A qu temperatura ocurri ms rpida la reaccin? Qu tipo de parmetros
obtenidos por usted en esta prctica, justifican su respuesta?
2. Por qu se trabaja con cido clorhdrico de concentracin constante (1M)?
3. qu significados tienen los valores de la energa de activacin, el valor de
frecuencia de Arrhenius y el perodo de vida media, determinados por usted en
este experimento?
4. Cules son las principales aplicaciones de la cintica qumica a nivel Ambiental?
BIBLIOGRAFA
BRICEO, Carlos Omar. QUIMICA. BOGOT : EDUCATIVA, 1993, pg. 682.
BROWN, Theodore y LEMAY, Eugene H. Qumica. Mexico D.F : Prentice Hall, 1987. pg. 895.
CHANG, Raymond y COLLEGE, Williams. Qumica. 7 ed. Mexico, D. F : Mc Graw-Hill Interamericana,
S.A, 2002. pg. 732.
CURTIS, Helena. BIOLOGA. Buenos Aires : Panamericana, 2001. pg. 1500.
GRANADOS MORENO, Jairo. Fisicoqumica Aplicada. 1ed. Bogot : Arfo Editores Ltda, 1996. pg. 436.
RAMETTE, Richard W. Equilibrio y Anlisis qumico. Mexico : Fondo Educativo Interamericano, 1983.
LEVINE IRA N.(1996) Fisicoqumica , Ed McGraw-Hill, cuarta edicin. Madrid, Espaa
ROMERO C Y BLANCO L (1996).Tpicos en qumica bsica, experimentos de laboratorio. Academia
Colombiana de Ciencias Exactas, Fsicas y Naturales. Bogot D.C
CASTELLAN W., Fisicoqumica,(1987) , Pearson Educacin, Mxico D.F , Segunda edicin
27
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
PRCTICA 4: ADSORCIN DE SOLUCIONES ACUOSAS DE CIDO ACTICO EN SUELOS Y
CARBN ACTIVADO
OBJETIVOS
1. Determinar la adsorcin de 2 soluciones de cido actico, en muestras de suelo y
carbn activado, mediante titulacin cido-base.
2. Encontrar la constante de equilibrio de adsorcin del cido actico (K) y el nmero de
moles por gramo, que son necesarios para formar una monocapa (N
m
), lo mismo que la
fraccin de superficie slida cubierta por las molculas adsorbidas( ), en las dos muestras
analizadas.
3. Estudiar el proceso a dos temperaturas (T
1
y T
2
), con el fin de calcular el calor
diferencial variacin entlpica(H) de adsorcin en las muestras de suelo y carbn
activado.
FUNDAMENTO TERICO
La adsorcin, es la transferencia selectiva de uno o ms solutos (adsorbato) de una
solucin a una de partculas slidas (adsorbente). Con este trmino, se describe el hecho
de que hay una concentracin mayor de molculas absorbidas en la superficie del slido
que en el gas o en la solucin. En forma similar, la operacin inversa, denominada
desorcin, produce la separacin de las especies que se encontraban originalmente en el
slido. En general, la Adsorcin incluye la acumulacin de molculas de soluto en una
interfase; Tal acumulacin por unidad de rea es pequea, por consiguiente, se prefieren
slidos altamente porosos con reas internas muy grandes por unidad de volumen y con
superficies irregulares, donde las energas estn dadas principalmente por las fuerzas de
Van der Waals. Como ejemplos clsicos de estos adsorbentes comnmente usados en la
industria, se tiene: carbn activado, almina (Al
2
O
3
), gel de slice (SiO
2
), zeolitas y tamices
moleculares. Una particularidad de las interacciones de adsorcin es el hecho de que la
molcula que se adsorbe interacta, no solo en el centro en la superficie del absorbente
(in, tomo o molcula que forman su malla), sino con varios centros vecinos. El
28
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
fenmeno de adsorcin tiene mucho en comn con la asociacin molecular de los
lquidos, debido a la formacin de un enlace de hidrgeno entre la molcula del adsorbato
y los correspondientes grupos o iones en la superficie del adsorbente. As, cuando se
adsorben molculas de agua, alcoholes, teres, aminas, etc, en adsorbentes cuya
superficie est cubierta por grupos de hidroxilo, se produce una formacin de complejos
moleculares con puentes de hidrgeno (Guerasimov Y., et al. 1980)
Cuando las molculas adsorbidas reaccionen qumicamente con la superficie del solido el
fenmeno se denomina Quimiosorcin. Debido a que en este caso se rompen y forman
enlaces qumicos, la entalpa de adsorcin tiene intervalos anlogos al de una reaccin
qumica, con valores cercanos a 400 KJ (Castellan G., 1987).
Con relacin a los suelos y el carbn activado, su comportamiento qumico depende del
carcter cido o bsico de su superficie. Esto est asociado a diversos grupos funcionales
de tipo orgnico que contienen el oxigeno, tal es el caso de los grupos carbonilo o
carboxilo.
La adsorcin est influenciada por la naturaleza qumica de la superficie, dimensiones de
los poros del adsorbente y por las propiedades de las soluciones. En la superficie del suelo,
la slice o del carbn activado, se adsorben con especial fuerza, las molculas que puedan
formar, con los grupos oxhidrilos de la superficie, enlaces de hidrgeno (fenoles,
alcoholes, agua) y complejos de Quimiosorcin (aminas).
Adsorcin superficial de slidos
La ecuacin general (Guerasimov Y, et al. 1980) de la isoterma de adsorcin de las
soluciones binarias es:
= (1)
29
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
donde: = composicin de la solucin superficial; = constante de Equilibrio de
adsorcin; = Fraccin molar de la solucin volumtrica
Dicha ecuacin (1), es similar a la ecuacin de Lagmuir para la adsorcin de soluciones
(Shoemaker y Garland., 1968):
(2)
Donde:
= fraccin de superficie slida cubierta por las molculas adsorbidas.
= concentracin de la solucin en equilibrio
Adems,
(3)
Donde:
N: Representa el nmero de moles adsorbidos por gramo de slido para un soluto en
equilibrio de concentracin C
N
m
: Es el nmero de moles por gramo, que son necesarios para formar una monocapa
Sustituyendo (3) en (2) y reorganizando, se obtiene la ecuacin (4).
(4)
30
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Por lo tanto, al graficar C/N en funcin de C, se obtendr una lnea recta, de pendiente:
1 /N
m
e intercepto: 1/ K. N
m
.
De estos valores, se podr calcular N
m
y K , as:
(5)
(6)
Conociendo el rea ( ), en Angstron cuadrados (27A
2
), ocupada por una molcula
adsorbida sobre una superficie, entonces el rea especfica (A) en m
2
/g, estar dada por:
(7)
Na: Nmero de Avogadro (6,023 x 10
23
)
Otra forma de encontrar K y Nm, es plantear la ecuacin de la doble recproca de la
isoterma de Langmuir as:
(8)
De tal forma que al graficar: 1/N contra 1/ C, se obtiene una lnea recta cuya pendiente
resulta:
(9)
y el intercepto punto de corte sobre el eje Y es:
31
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
(10)
Por lo tanto, de la expresiones (9) y (10), se pueden calcular:
Influencia de la Temperatura en la adsorcin de las soluciones
La variacin de la temperatura, puede influr directamente en la adsorcin de las
soluciones, especialmente cuando stas son solubles entre s; As, la adsorcin de las
soluciones disminuye con el aumento de la temperatura. Este es un caso normal de la
influencia inversa en la concentracin de la sustancia adsorbida, del campo adsortivo de la
superficie y del aumento de la energa cintica de las molculas con la temperatura
(Guerasimov., et al .1980). Con base en la teora termodinmica de adsorcin de
soluciones, se puede plantear la relacin entre concentracin y temperatura mediante la
siguiente expresin (Shoemaker, 1968).
(11)
donde:
H, es el calor diferencial ( variacin entlpica) para el proceso de adsorcin a presin y
fraccin superficial constante.
T: Temperatura; C: Concentracin
Reordenando e integrando la ecuacin (11) se obtiene:
] (12)
en donde:
C
1
: es la concentracin inicial de la solucin a la temperatura ms baja: T
1
32
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
C
2
: Es la concentracin final de la solucin a la temperatura ms alta: T
2
R: 1,98 cal/mol.K 8,31J/ mol.K
De la ecuacin (12), el valor de H, se puede calcular mediante la expresin:
(13)
MATERIALES
Equipo de Titulacin: Soporte universal, bureta, Pinzas, erlenmeyer de 250mL , probeta de
100mL, embudo de filtracin, esptula metlica, pipeta de 10mL, papel filtro,
Termoagitadores magnticos varillas agitadores de vidrio, bao termostatado, beaker
de 250mL, balanza analtica.
Reactivos : cido actico glacial, Carbn activado, Hidrxido de sodio 0,1 N, cido actico:
0,150 M y 0,050M, Fenolftaleina, muestra de suelo seco.
PROCEDIMIENTO
1. Alistar 4 erlenmeyers Beakers de 250mL y rotularlos as: S1; S2; CA1; CA2.
2. Pesar en balanza analtica,4 muestras as: dos, de +/- 1 gramo de suelo y dos de +/-
1 gramo de carbn activado, registrar los valores como: Ws y Wca, en su tabla de
datos.
3. Colocar las muestras de suelo en S1 y S2 y las de carbn activado en los
erlenmeyer respectivos: S2 y CA2
4. Adicionar 100 mL de solucin de cido actico: 0,150M en los frascos rotulados: S1
y CA1. Tambin agregar 100mL de cido actico: 0,050M en los erlenmeyer: S2 y
CA2, respectivamente.
33
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
5. Tapar rpidamente los recipientes y agitar peridicamente durante 30 minutos en
agitadores magnticos con varilla de vidrio; despus, dejar reposar por 15
minutos a temperatura ambiente: T
1
, la cual se debe medir con el termmetro.
6. Posteriormente, cada muestra se filtra sobre papel filtro cuantitativo, desechando
los primeros 10 mL del filtrado, como medida de precaucin contra la adsorcin
del cido por el papel filtro.
7. Tomar con pipeta, exactamente 25 mL del filtrado de S1 y colocarlos en el
erlenmeyer del equipo de titulacin. Adicionar 3 gotas de fenolftalena y agitar
suavemente por 10 segundos.
8. Alistar la bureta, lavarla, purgarla, colocarla en el soporte universal y cargarla con
NaOH 0,1N; enrasarla, ajustando el nvel del lquido a cero.
9. Ubicar el erlenmeyer bajo la Bureta y titular, adicionando gota a gota el NaOH
sobre la solucin presente en el erlenmeyer (el cual se agita suavemente), hasta
que aparezca y permanezca un color rosado violeta plido. Registrar los mililitros
gastados de NaOH en su tabla de datos.
10. Repetir secuencialmente los pasos 7,8 y 9, con los tres filtrados restantes y
registrar los mL gastados de NaOH en la tabla de datos.
11. Repetir todo el experimento, etapas 1 a 10, a una temperatura ms alta: T
2
,cercana a 40C, colocando los frascos en un termostato bao de Mara.
TABLA DE DATOS
Tabla 1: Datos para la adsorcin de soluciones acuosas de cido actico sobre suelos y carbn
activado, a las dos temperaturas trabajadas.
Muestras Simbologa W
m
(g) [c.actico]
mL NaOH 0,1N
T
1
: ___C T
2
:___ C
Suelo
S1 Ws
1
: 0,150M
S2 Ws
2
: 0,050M
34
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Carbn
Activado
CA1 Wca
1
: 0,150M
CA2 Wca
2
: 0,050M
CLCULOS Y GFICAS
1. Milimoles iniciales de cido actico(H
+
), presentes en los 4 erlenmeyer, a la
temperatura T
1
2. Milimoles finales de cido actico(H
+
), neutrlizados por el NaOH, en cada
erlenmeyer, a la temperatura T
1
3. Nmero de moles de cido, adsorbidos por gramo de suelo (N),en cada
concentracin de cido actico(Frascos S1 y S2), a T
1
4. Nmero de moles de cido, adsorbidos por gramo de carbn activado (N), en cada
concentracin de cido actico(Frascos CA1 y CA2), a T
1
5. Concentracin Final del cido actico, posterior al proceso de adsorcin, en los
frascos S1, S2, CA1, y CA2, a T
1
35
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
6. Repetir este tipo de clculos para el experimento realizado a la temperatura: T
2
7. A partir de los valores de N y C
f
, calculados para cada temperatura, completar la
siguiente tabla:
Tabla 2: Resultados de la adsorcin de soluciones acuosas de cido actico sobre suelos y carbn
activado, a las dos temperaturas trabajadas.
Muestras Temp (C) N(mmol/g) C
f
(M)
Recprocos
1/ N 1/ C
f
S1
S2
T
1
T
1
:
S1
S2
T
2
T
2
CA1 T
1
CA2 T
1
CA1 T
2
CA2 T
2
8. Con base en los valores der la tabla 2, trazar las grficas de : 1/ N versus 1/ C
f,
para
cada muestra trabajada( suelo y carbn activado), a la respectiva temperatura: T
1
y
T
2
9. Encontrar la pendiente( m) de cada recta, lo mismo que su intercepto (b) sobre el
eje Y ( para cada pareja de datos, a la temperatura trabajada)
36
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
10. A partir de las pendientes e interceptos calculados, encontrar los valores de: Nm ,
K y A y teniendo en cuenta las ecuaciones 3, 7, 9 y 10 del fundamento terico.
11. Utilizando la ecuacin 13, determinar el calor diferencial de adsorcin ( ), en
cada una de las muestras estudiadas.
TABLA DE RESULTADOS
Tabla 3: Parmetros para la adsorcin del cido actico sobre suelo y carbn activado
Muestras Temp (C) N
m
(mmol/g) K
A(m
2
/g)
(cal/mol)
(J/ mol)
S1
S2
T
1
T
2
:
CA1 T
1
CA2 T
2
GRFICAS
Elaborar un diagrama de barras que muestre los resultados obtenidos
DISCUSIN E INTERPRETACIN DE RESULTADOS
Analizar, discutir y confrontar los resultados obtenidos, con su revisin de literatura
CONCLUSIONES
Plantear por lo menos 4 conclusiones finales relacionadas con lo discutido en los
resultados de la prctica.
CUESTIONARIO
1. Consultar: tipos de adsorcin, tipos de carbn activado y sus aplicaciones
ambientales
37
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
2. Qu significa calor diferencial de adsorcin y cules seran sus aplicaciones
ambientales?
3. Cul es la diferencia fisicoqumica, entre la adsorcin de soluciones sobre suelos y
carbn activado?
BIBLIOGRAFA
BRICEO, Carlos Omar. QUIMICA. BOGOT : EDUCATIVA, 1993, pg. 682.
BROWN, Theodore y LEMAY, Eugene H. Qumica. Mexico D.F : Prentice Hall, 1987. pg. 895.
CHANG, Raymond y COLLEGE, Williams. Qumica. 7 ed. Mexico, D. F : Mc Graw-Hill Interamericana, S.A,
2002. pg. 732.
CURTIS, Helena. BIOLOGA. Buenos Aires : Panamericana, 2001. pg. 1500.
GRANADOS MORENO, Jairo. Fisicoqumica Aplicada. 1ed. Bogot : Arfo Editores Ltda, 1996. pg. 436.
38
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
A. Elementos necesarios para la prctica
Protocolos gua de la actividad, Preinformes impresos, Bata blanca , cinta de
enmascarar, bayetilla roja, vidriolap, muestras recolectadas y empacadas segn la gua
didctica, libreta de anotaciones, lpiz, cmara fotogrfica.
B. PRODUCTOS A ENTREGAR
Al tutor de prctica:
1. Todos los Preinformes de las prcticas, acorde al formato presentado en el foro de
trabajo colaborativo y que se anexa a la presente.
2. Los grupos de trabajo debern entregar el informe de laboratorio, segn los
lineamientos establecidos en la gua de actividades del trabajo colaborativo y que
tambin se anexa a este documento
3. Respuestas a la preguntas planteadas al final de cada gua.
Al Director de Curso tutor Virtual
Todos los estudiantes (sin excepcin) que realizarn sus prcticas en laboratorios de otras
zonas, diferentes al de la sede nacional JCM, deben elaborar obligatoriamente los dos
productos especificados en la gua de actividades, colgada en el foro de trabajo
colaborativo y enviarlos al foro mencionado , teniendo en cuenta la fecha lmite all
sealada.
3.EVALUACIN
La evaluacin se discriminar as: 60 % valorado por el tutor de la prctica y un 40 %
calificado por el Director de curso tutor virtual . En general, La calificacin Final
(sobre 150 puntos) del trabajo colaborativo se realizar de acuerdo con la siguiente
rbrica.
39
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
RBRICA DE TRABAJO COLABORATIVO (Evaluacin Final)
TUTOR DE PRCTICA
tem
evaluado
Valoracin
baja
Valoracin
Media
Valoracin
Alta
Mximo
Puntaje
Participacin en el
desarrollo de la
prctica
El estudiante no
particip en el
desarrollo de la
prctica
(Puntos=0)
El estudiante
tuvo una baja
participacin en
la prctica
(Puntos=8)
El estudiante
particip
activamente en la
prctica
(Puntos=15)
15
Entrega de
datos
El estudiante no
entreg tablas de
datos
(Puntos=0)
Las tablas de
datos estn
incompletas
(Puntos=5)
Las tablas de
datos, cumplen
con lo solicitado
(Puntos=10)
10
Preinformes
El estudiante
no entreg
preinformes
(Puntos=0)
Los preinformes
est
incompletos
(Puntos=5)
Los preinformes
cumplen con lo
solicitado
(Puntos=10)
10
Organizacin del
informe
El informe no tuvo
en cuenta las
normas bsicas,
indicadas en la
gua de actividades
(Puntos = 0)
Aunque el
documento
presenta una
estructura
base, la misma
carece de
algunos
elementos del
cuerpo
solicitado
(Puntos =10)
El documento
presenta una
excelente
estructura, acorde
a la gua de
actividades
(Puntos =20)
20
Estructura y
coherencia del
informe
El documento no
sigui los
lineamientos del
modelo artculo
cientfico
(Puntos = 0)
El documento
est
incompleto
(Puntos=10)
El informe
cumpli con
objetivos y
lineamientos del
modelo artculo,
cientfico de
manera
25
40
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
satisfactoria
(Puntos = 25)
Desarrollo de
competencias
El estudiante no
logr desarrollar
las competencias
planteadas para la
actividad
(Puntos = 0)
El estudiante
logr
desarrollar
parcialmente
las
competencias
planteadas
para la
actividad
(Puntos = 6)
El estudiante
logr desarrollar
satisfactoriamente
las competencias
planteadas para la
actividad
(Puntos = 10)
10
Total de puntos posibles 90
DIRECTOR DE CURSO TUTOR VIRTUAL
tem
evaluado
Valoracin
baja
Valoracin
Media
Valoracin
Alta
Mximo
Puntaje
Participacin en el
Foro de trabajo
colaborativo
El estudiante no
particip en el Foro
(Puntos=0)
El estudiante
tuvo una baja
participacin en
el foro
(Puntos=2)
El estudiante
particip
activamente en el
foro
(Puntos=5)
5
Estructura y
coherencia del
informe
ILAC
El documento PDF,
no
sigui los
lineamientos del
modelo artculo
cientfico
(Puntos = 0)
El documento
est incompleto
(Puntos=10)
El informe PDF,
cumpli
con objetivos y
lineamientos del
modelo artculo,
cientfico de
manera
satisfactoria
(Puntos = 25)
25
Organizacin
del informe
UVE con
hipervnculos
El documento no
tuvo
en cuenta las
normas
bsicas, indicadas
en la gua de
Aunque el
documento
presenta una
estructura base,
la misma carece
de algunos
El documento
presenta una
excelente
estructura y
navegavilidad,
acorde
15
41
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
actividades
(Puntos = 0)
elementos del
cuerpo solicitado
(Puntos =10)
a la gua de
actividades
(Puntos =15)
Ejercicios Aplicados
El grupo no desarroll
los ejercicios
aplicados
(Puntos=0)
El grupo
desarroll los
ejercicios de
forma incorrecta
e incompleta
(Puntos=5)
El grupo desarroll
correctamente los
ejercicios y en forma
completa
(Puntos=10)
10
Autoevaluacin
El grupo no desarroll
la autoevaluacin de
los laboratorios
(Puntos=0)
El grupo
desarroll la
autoevaluacin
en forma parcial
(Puntos=2)
El grupo desarroll
completa y
correctamente la
autoevaluacin
(Puntos=)
5
Total de puntos posibles 60
II ACTIVIDADES PARA EL TUTOR
El tutor de prctica, debe entrar en contacto desde el inicio del perodo acadmico
con el director de curso, con el objetivo de conformar la red de tutores, la cual se
trabajar desde los correos institucionales
Logstica y desarrollo de la prctica
Seleccin del sitio donde se desarrollar la prctica
Aseguramiento logstico para desarrollo de la prctica
Entrega de la gua a los estudiantes y seguimiento de la prctica: Su rol debe
ser de orientador y facilitador en el desarrollo de las actividades.
Conclusiones de la prctica. Establecer un mecanismo que permita el
intercambio de ideas, aclaracin de dudas y planteamiento de conclusiones de
manera conjunta.
Evaluacin. El tutor realizar la evaluacin de la prctica de acuerdo con la
rbrica.
1. Informe de Actividades
42
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
El tutor de prcticas deber elaborar un informe sobre el desarrollo de las actividades
del componente prctico el cual debe ser entregado al director de curso. Dicho
informe estar compuesto por los siguientes formatos diligenciados
Formato 1: Datos generales de la prctica
CONTROL Y SEGUIMIENTO AL DESARROLLO
DEL COMPONENTE PRCTICO
Nombre del tutor
CEAD donde se
encuentra el tutor
Curso
Ttulo de la prctica
Fecha de realizacin
Dia:______________ Mes_______________ Ao:_________
Lugar donde se
desarroll la prctica
Lugar: ____________________________________________
Municipio:_______________ Departamento:______________
Temas abordados en la
prctica
Materiales y equipos
empleados en la prctica
Observaciones
43
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Costo aproximado
Transporte:________________________________________
Materiales y equipos:________________________________
Formato 2: Registro de asistencia de los estudiantes a las actividades prcticas
REGISTRO DE ASISTENCIA DE ESTUDIANTES
A LAS ACTIVIDADES PRCTICAS
No NOMBRES APELLIDOS CODIGO FIRMA
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Datos del tutor
Nombre: _________________________________________
Cdula: ____________ Firma: ________________________
Correo___________________________________________
Telfonos _______________ Celular __________________
Anexos
Evidencias del desarrollo de la prctica (Fotografas, videos, etc).
44
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Formato 3: Reporte de calificaciones obtenidas por los estudiantes
REPORTE DE CALIFICACIONES
Curso: __________________________
Cdigo:__________________________
Ttulo de la prctica: _______________
________________________________
CEAD:_______________________________
Fecha:_______________________________
Tutor: _______________________________
Firma:_______________ Cdula:_________
No Apellidos y Nombres Cdigo
Participacin
en el
desarrollo de
la prctica
Informe
Redaccin y
ortografa
Total
en
puntos
Justificacin
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
45
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
ANEXOS
PRESENTACIN DE INFORMES Y PREINFORMES
La elaboracin de pre informes tiene como objetivo permitir que el estudiante se prepare
con las bases tericas sobre la prctica que va a realizar. Dado que las actividades dentro
de un laboratorio de qumica pueden llevar a riesgos personales, es imperativo que tanto
estudiantes como tutor sepan exactamente qu es lo que van a hacer y cmo lo van a
hacer. Seguidamente se muestran los parmetros para la presentacin de pre informes
de prctica de qumica inorgnica.
El pre informe debe contener los siguientes elementos:
- Identificacin de la prctica (nombre)
- Identificacin del estudiante
- Objetivos
- Marco terico: descripcin breve sobre los fundamentos dericos que van a
comprobarse, esta informacin debe ser adicional a la mostrada en el protocolo de
prcticas
- Diagrama de flujo del proceso a seguir en el laboratorio
- Respuesta a las preguntas tericas, el estudiante deber consultar la informacin que
pueda responder las preguntas planteadas al final de cada protocolo de prctica
- Tabla de datos que el estudiante completar durante el desarrollo de la prctica
Este pre-informe deber entregarse al inicio de cada sesin de prcticas, para su revisin
por parte del tutor de la actividad prctica, dependiendo de esto, el tutor decidir si el
estudiante se encuentra preparado o no para realizar la actividad. Queda a discrecin del
tutor de la actividad prctica la realizacin de quices cortos sobre el fundamento terico o
el proceso que debe seguirse en cada actividad.
Al final de cada actividad el grupo colaborativo de estudiantes deber completar el pre
informe con las tablas de datos recogidas durante la experiencia y entregar un preinforme
completo al tutor de la actividad identificando claramente los integrantes del gupo
colaborativo y el nmero de grupo de laboratorio; los datos debern estar escritos tal y
46
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
como se registraron, sin ningn tipo de tratamiento matemtico y con el nmero de cifras
significativas correcto.
INFORME FINAL
Trabajo intelectual del equipo: En esta etapa, los estudiantes harn la discusin y
aportes individuales para la construccin del informe modelo artculo cientfico
(ILAC) y la presentacin en power-point de un Diagrama UVE con hipervnculos,
segn la distribucin de prcticas indicadas por el docente director de curso, como
productos final del proceso.
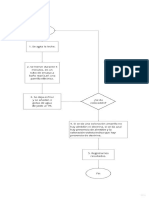
La figura 1, resume las etapas requeridas en todo el proceso:
47
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Figura 1: Diagrama de flujo de las actividades a desarrollar en las prcticas de laboratorio
PRODUCTOS FINALES:
I. Informe en Modelo Artculo Cientfico (ILAC)
Cuando se solicite este tipo de producto: cada grupo colaborativo, debe construir un
documento con las siguientes caractersticas:
48
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
Mrgenes de 2 cm, letra arial 12 (para ttulos y subttulos); 11(texto y contenidos)
y 10, para: Resumen, subndices y superndice
Interlineado 1cm, para el resumen y 1,5 cm para el texto.
Portada, donde se indique: Integrantes del grupo, cdigo, correo electrnico,
CEAD, Tutor virtual, fecha de entrega.
El contenido deber inclur:
Resumen (mximo 8 lneas); palabras claves (6).
Introduccin (Mximo 16 lneas).
1. Fundamentacin Terica (Revisin de literatura)
1.1Mapa conceptual, utilizando los conceptos propuestos
1.2Mentefacto conceptual, utilizando los conceptos propuestos
2. Materiales y Mtodos.
2.1 Cuadro 1: Lista de equipos utilizados
2.2 Cuadro 2 : Lista de reactivos utilizados
2.3 Procedimientos: Cuadro 3: Tcnicas Analticas utilizadas
2.3.1 Protocolos de muestras biolgicas estudiadas (Elaborar una ficha formato
que muestre la informacin fundamental sobre el origen de cada una. Por ej:
especie, nombre cientfico, lugar de muestreo, datos ambientales)
2.3.2 Flujograma general de los procedimientos desarrollados que incluye: Video
fotografas que sustentan los procesos desarrollados (en Word : hacer click en insertar
,formas y diagrama de flujo)
3. Resultados y discusin.
3.1 Tabla de datos
3.2 Ecuaciones de clculo
3.3 Tablas de resultados
3.4 Grficas estadsticas (diagramas de barras)
3.5 Discusin e interpretacin de los resultados
4. Conclusiones (cinco)
5. Bibliografa consultada (mnimo 6 referencias) Normas APA.
49
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
6. Diagrama UVE heurstico del experimento
7. Pruebas de Autoevaluacin de la prctica
II. Diagrama UVE Heurstico con hipervnculos (Power-Point)
Cuando se solicite este tipo de producto, entonces, cada grupo colaborativo, construye un
documento en Power-point, con las siguientes caractersticas:
1. Portada
2. Introduccin (esquematizada)
3. Revisin de Literatura (Mentefacto mapa conceptual)
4. Metodologa (Diagrama de flujo del experimento, utilizando fotos video)
5. Diagrama UVE heurstico completo, con hipervnculos
6. Ecuaciones de clculo, Tablas y grficas que no se incluyan en el diagrama UVE
heurstico
7. Conclusiones (esquematizadas)
8. Bibliografa consultada: textos, artculos cientficos y pginas web (Mnimo 6)
9. Pruebas Autoevaluativas de la prctica
Para el buen desarrollo del trabajo, se debe tener en cuenta la siguiente
informacin :
Prctica Descripcin Producto final
1
Determinacin de la entalpa molar
de disolucin y entropa de una
mezcla binaria
Informe en Modelo Artculo
Cientfico (ILAC)|
2
Determinacin de la constante
universal de los gases
Informe en Modelo Artculo
Cientfico (ILAC)
50
Elabor: Prof: Jairo Granados., MSc. Docente ECAPMA.
3
Cintica de la descomposicin del
Tiosulfato de sodio, por medio del
HCl concentrado.
Informe en Modelo Artculo
Cientfico (ILAC)|
4
Adsorcin de soluciones acuosas de
cido actico en suelos y carbn
activado
Diagrama UVE Heurstico con
hipervnculos (Presentacin Power-
Point)
También podría gustarte
- Ecofisiología de La Palma de Aceite.Documento11 páginasEcofisiología de La Palma de Aceite.darwin ortegaAún no hay calificaciones
- Guia Diseño de Plantas y Equipos de Ing AmbientalDocumento12 páginasGuia Diseño de Plantas y Equipos de Ing AmbientalGARKAún no hay calificaciones
- Consolidado Trab Final Cup Cakes Carinitos 2Documento12 páginasConsolidado Trab Final Cup Cakes Carinitos 2GARKAún no hay calificaciones
- Fase 1 Ecuaciones DiferencialesDocumento7 páginasFase 1 Ecuaciones DiferencialesGARKAún no hay calificaciones
- 119 Trabajo Fase 2Documento17 páginas119 Trabajo Fase 2GARKAún no hay calificaciones
- ACT 14. Laboratorio Quimica InorganicaDocumento46 páginasACT 14. Laboratorio Quimica InorganicaGARKAún no hay calificaciones
- Borrador Informe Final Quimica Inorganica LaboratoriosDocumento50 páginasBorrador Informe Final Quimica Inorganica LaboratoriosGARKAún no hay calificaciones
- Informe Practica Microbiología Ambiental BucaramangaDocumento21 páginasInforme Practica Microbiología Ambiental BucaramangaGARKAún no hay calificaciones
- Metabolismo Central y Fermentación 2015Documento26 páginasMetabolismo Central y Fermentación 2015Ángel AnayaAún no hay calificaciones
- Aplicaciones FlamaDocumento2 páginasAplicaciones FlamaKrloz TerrerosAún no hay calificaciones
- Funciones de Los Elementos en La PlantaDocumento2 páginasFunciones de Los Elementos en La PlantaVigilancia StarseedsAún no hay calificaciones
- Practica No 1Documento2 páginasPractica No 1Alexander RodriguezAún no hay calificaciones
- Biodiesel CaseroDocumento35 páginasBiodiesel CaseroKelly RodriguezAún no hay calificaciones
- LAURA - LLANO GIL - Agenda Ciencias Naturales Semana 13.1Documento3 páginasLAURA - LLANO GIL - Agenda Ciencias Naturales Semana 13.1LAURA LLANO GILAún no hay calificaciones
- T-2 Diagramas de Flujo de Pruebas de Plataforma en LecheDocumento6 páginasT-2 Diagramas de Flujo de Pruebas de Plataforma en LecheOLAN BARBOSA JESUS ARTUROAún no hay calificaciones
- Programa Areas de Grado Crudos PesadosDocumento12 páginasPrograma Areas de Grado Crudos PesadosLuider RodriguezAún no hay calificaciones
- Teorías Ácido BaseDocumento18 páginasTeorías Ácido BaseJesus AragonAún no hay calificaciones
- TEMA 4 Elementos y Compuestos1Documento2 páginasTEMA 4 Elementos y Compuestos1Alfonso LopezAún no hay calificaciones
- Cuestionarios - Grupo 4-U2Documento12 páginasCuestionarios - Grupo 4-U2ERIKA MARICRUZ CELI SANTOSAún no hay calificaciones
- Listado de Medicamentos Afectados Por Las Deducciones Del Real Decreto-Ley 8/2010 - Septiembre 2022Documento136 páginasListado de Medicamentos Afectados Por Las Deducciones Del Real Decreto-Ley 8/2010 - Septiembre 2022irinaAún no hay calificaciones
- Guia Examen QuintoDocumento4 páginasGuia Examen QuintoLuis Enrique Briones ZeledónAún no hay calificaciones
- 29 PDFDocumento89 páginas29 PDFMarcos Moisés Arce ColqueAún no hay calificaciones
- CATALOGO X MAYOR BIOAQUA - COLOMBIA Oct 3Documento196 páginasCATALOGO X MAYOR BIOAQUA - COLOMBIA Oct 3AdalinaVidalTovarAún no hay calificaciones
- Las Ciencias Fisico-Qui Micas, La Cirugia y La Microscopia en La Edad ModernaDocumento9 páginasLas Ciencias Fisico-Qui Micas, La Cirugia y La Microscopia en La Edad Modernaalexis almarasAún no hay calificaciones
- Oxidacion ReduccionDocumento6 páginasOxidacion Reduccioning_laps0% (1)
- Apunte Tema 3-3 - Teorías de RoturaDocumento15 páginasApunte Tema 3-3 - Teorías de RoturaMateo Ortiz MengualAún no hay calificaciones
- QUÍMICA ORGÁNICA - SEM-11 - SESIÓN-11 - 2021-2 v1 - 211107 - 020222Documento41 páginasQUÍMICA ORGÁNICA - SEM-11 - SESIÓN-11 - 2021-2 v1 - 211107 - 020222Francesca VelardeAún no hay calificaciones
- Bioelementos o Elementos BiogenesicosDocumento5 páginasBioelementos o Elementos BiogenesicosJonathan Arauco VillanuevaAún no hay calificaciones
- Investigación de Las Teorías Del HombreDocumento2 páginasInvestigación de Las Teorías Del HombreandreaAún no hay calificaciones
- Actividad 1 - AguaDocumento37 páginasActividad 1 - Aguammi izquierdoAún no hay calificaciones
- Organización de Los Elementos Químicos y Sus Enlaces Guía II QuímicaDocumento7 páginasOrganización de Los Elementos Químicos y Sus Enlaces Guía II QuímicaDiokerly MéndezAún no hay calificaciones
- Manual Practica Laboratorio IDocumento4 páginasManual Practica Laboratorio IManuel CortesAún no hay calificaciones
- La Gelatina. Propiedades y Usos.Documento3 páginasLa Gelatina. Propiedades y Usos.AgroindustriahumanaAún no hay calificaciones
- Quesos AnálogosDocumento4 páginasQuesos AnálogosRivera_villarrealAún no hay calificaciones
- Reformulacion de Detergentes Liquidos Que Sean BiodegradablesDocumento70 páginasReformulacion de Detergentes Liquidos Que Sean BiodegradablesRoy WernstermeinAún no hay calificaciones
- Bradford Vs LowryDocumento4 páginasBradford Vs LowryMinerva Resendiz Ballado100% (1)
- EXAMEN No. 3 Primer Parcial Procesos Industriales I 2020-2Documento3 páginasEXAMEN No. 3 Primer Parcial Procesos Industriales I 2020-2juan david polanco urbinaAún no hay calificaciones