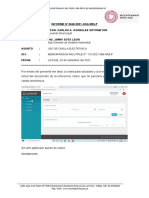
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
CLORO
Cargado por
rikardoo_diegoooTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
CLORO
Cargado por
rikardoo_diegoooCopyright:
Formatos disponibles
CLORO
El cloro es un elemento qumico de nmero atmico 17 situado en el grupo de
los halgenos (grupo VII A) de la tabla peridica de los elementos. Su smbolo es Cl. En
condiciones normales y en estado puro forma dicloro: un gas txico amarillo-verdoso
formado por molculas diatmicas (Cl
2
) unas 2,5 veces ms pesado que el aire, de olor
desagradable y txico. Es un elemento abundante en la naturaleza y se trata de
un elemento qumico esencial para muchas formas de vida.
ndice
ocultar
1 Caractersticas principales
2 Historia
3 Abundancia
4 Obtencin
5 Compuestos
6 Istopos
7 Aplicaciones y usos
o 7.1 Produccin de insumos industriales y para consumo
o 7.2 Purificacin y desinfeccin
o 7.3 Qumica
o 7.4 Uso como un arma
7.4.1 I Guerra Mundial
7.4.2 Guerra de Irak
o 7.5 Otros usos
8 Referencias
9 Enlaces externos
Caractersticas principales[editar]
Cloro
En la naturaleza no se encuentra en estado puro ya que reacciona con rapidez con
muchos elementos y compuestos qumicos, por esta razn se encuentra formando parte
de cloruros(especialmente en forma de cloruro de sodio), cloritos y cloratos , en las minas
de sal y disuelto en el agua de mar.
Historia
El cloro (del griego , que significa "verde plido") fue descubierto en su forma
diatmica en 1774 por el sueco Carl Wilhelm Scheele, aunque crea que se trataba de un
compuesto que contena oxgeno. Lo obtuvo a partir de la siguiente reaccin:
2 NaCl + 2H
2
SO
4
+ MnO
2
Na
2
SO
4
+ MnSO
4
+ 2 H
2
O + Cl
2
En 1810 el qumico ingls Humphry Davy demuestra que se trata de un elemento
fsico y le da el nombre de cloro debido a su color. El gas cloro se emple en la
Primera Guerra Mundial, siendo el primer caso de uso de armas qumicas como
el fosgeno y el gas mostaza.
Abundancia
El cloro se encuentra en la naturaleza combinado con otros elementos formando
principalmente sales inicas; como es el caso del cloruro sdico y clcico; tambin con
la mayora de metales; desde el cloruro de hafnio hasta el cloruro de plata. Podra
decirse que el cloro combina de forma natural bastante bien con la mayora de
elementos, excepto con los de su grupo, halgenos y gases nobles, aunque en las
ltimas dcadas de manera sinttica forma parte de los mismos en compuestos
conocidos como son los fluorocloruros y cloruros de xenn. Finalmente cabe destacar
que la gran mayora de estos compuestos suelen encontrarse con impurezas
formando parte de minerales como la carnalita, KMgCl
3
6H
2
O.
Obtencin
El cloro comercial se obtiene por electrlisis en el proceso de preparacin de los
lcalis y se expende en forma lquida, no es puro; y por lo tanto, ha de purificarse. Si
se trata el dixido de manganeso hidratado con cido clorhdrico concentrado se
produce un gas exento en gran parte de impurezas tales como el oxgeno gas (O
2
(g))
y xidos de cloro.
4HCl + MnO
2
xH
2
O = MnCl
2
+ (x+2)H
2
O + Cl
2
Compuestos
Algunos cloruros metlicos se emplean como catalizadores. Por ejemplo, FeCl
2
,
FeCl
3
, AlCl
3
.
cido clorhdrico, HCl. Se emplea en la industria alimentaria, metalrgia,
desincrustante, productos de limpieza, abrillantador de pisos, destapador de caos
y tuberas.
cido hipocloroso, HClO. Se emplea en la depuracin de aguas y alguna de sus
sales como agente blanqueante.
cido cloroso, HClO
2
. La sal de sodio correspondiente, NaClO
2
, se emplea para
producir dixido de cloro, ClO
2
, el cual se usa como desinfectante.
cido clrico (HClO
3
). El clorato de sodio, NaClO
3
, tambin se puede emplear para
producir dixido de cloro, empleado en el blanqueo de papel, as como para
obtener clorato.
cido perclrico (HClO
4
). Es un cido oxidante y se emplea en la industria de
explosivos. El perclorato de sodio, NaClO
4
, se emplea como oxidante y en la
industria textil y papelera.
Compuestos de cloro como los clorofluorocarburos (CFC) contribuyen a la
destruccin de la capa de ozono.
Algunos compuestos orgnicos de cloro se emplean como pesticidas. Por ejemplo,
el hexaclorobenceno (HCB), el para-diclorodifeniltricloroetano (DDT), el toxafeno,
etctera.
Muchos compuestos organoclorados presentan problemas ambientales debido a
su toxicidad, por ejemplo el pentacloroetano, los pesticidas anteriores, los bifenilos
policlorados (PCB), o las dioxinas.
Istopos
En la naturaleza se encuentran dos istopos estables de cloro. Uno de masa 35 uma,
y el otro de 37 uma, con unas proporciones relativas de 3:1 respectivamente, lo que da
un peso atmico para el cloro de 35,5 uma.
El cloro tiene 9 istopos con masas desde 32 uma hasta 40 uma. Slo tres de stos se
encuentran en la naturaleza: el
35
Cl, estable y con una abundancia del 75,77%, el
37
Cl,
tambin estable y con una abundancia del 24,23%, y el istopo radiactivo
36
Cl. La
relacin de
36
Cl con el Cl estable en el ambiente es de aproximadamente 700 10
15
:1.
El
36
Cl se produce en la atmsfera a partir del
36
Ar por interacciones con protones de
rayos csmicos. En el subsuelo se genera
36
Cl principalmente mediante procesos de
captura de neutrones del
35
Cl, o por captura de muones del
40
Ca. El
36
Cl decae a
36
S y
a
36
Ar, con un periodo de semidesintegracin combinado de 308000 aos.
El perodo de semidesintegracin de este istopo hidroflico y no reactivo lo hace til
para la datacin geolgica en el rango de 60000 a 1 milln de aos. Adems, se
produjeron grandes cantidades de
36
Cl por la irradiacin de agua de mar durante las
detonaciones atmosfricas de armas nucleares entre 1952 y 1958. El tiempo de
residencia del
36
Cl en la atmsfera es de aproximadamente 1 semana. As pues, es un
marcador para las aguas superficiales y subterrneas de los aos 1950, y tambin es
til para la datacin de aguas que tengan menos de 50 aos. El
36
Cl se ha empleado
en otras reas de las ciencias geolgicas, incluyendo la datacin de hielo y
sedimentos.ya que es una sustancia venenosa
Nclido Abundancia Masa Espn
Periodo de
semidesintegracin
Producto de
desintegracin
32
Cl - 31,9857 1 298 ms
33
Cl - 32,9775 3/2 2,51 s
34
Cl - 33,9738 0 1,53 s
35
Cl 75,77 34,9689 3/2 - -
36
Cl - 35,9683 2 301000 a
-
37
Cl 24,23 36,9659 3/2 - -
38
Cl - 37,9680 2 37,2 m
-
39
Cl - 38,9680 3/2 55,6 m
-
40
Cl - 39,9704 2 1,38 m
-
41
Cl - 40,9707 n.m. 34 s
-
42
Cl - 41,9732 n.m. 6,8 s
-
43
Cl - 42,9742 n.m. 3,3 s
-
Aplicaciones y usos
Produccin de insumos industriales y para consumo
Las principales aplicaciones de cloro son en la produccin de un amplio rango de
productos industriales y para consumo.
1
2
Por ejemplo, es utilizado en la elaboracin
de plsticos, solventes para lavado en seco y desgrasado de metales, produccin de
agroqumicos y frmacos, insecticidas, colorantes y tintes, etc.
Purificacin y desinfeccin
El cloro es un qumico importante para la purificacin del agua (como en plantas de
tratamiento de agua), en desinfectantes, y en la leja. El cloro en agua es ms de tres
veces ms efectivo como agente desinfectante contra Escherichia coli que una
concentracin equivalente de bromo, y ms de seis veces ms efectiva que una
concentracin equivalente de yodo.
3
El cloro como antisptico fue introducido en 1835 por Holmes (en Boston)
y 1847 Semmelweis (en Viena).
4
El cloro se emplea como desinfectante en
mobiliarios, equipos, instrumental y reas hospitalarias.
4
El cloro suele ser usado en la
forma de cido hipocloroso para eliminar bacterias, hongos, parsitos y virus en los
suministros de agua potable y piscinas pblicas. En la mayora de piscinas privadas, el
cloro en s no se usa, sino hipoclorito de sodio, formado a partir de cloro e hidrxido de
sodio, o tabletas slidas de isocianuratos clorados. Incluso los pequeos suministros
de agua son clorados rutinariamente ahora.
5
(Ver tambin cloracin)
Suele ser imprctico almacenar y usar el venenoso gas cloro para el tratamiento de
agua, as que se usan mtodos alternativos para agregar cloro. Estos incluyen
soluciones dehipoclorito, que liberan gradualmente cloro al agua, y compuestos como
la dicloro-S-triazinatriona de sodio (dihidrato o anhidro), algunas veces referido como
"diclor", y latricloro-S-triazinatriona, algunas veces referida como "triclor". Estos
compuestos son estables en estado slido, y pueden ser usados en forma de polvo,
granular, o tableta. Cuando se agrega en pequeas cantidades a agua de piscina o
sistemas de agua industrial, los tomos de cloro son hidrolizados del resto de la
molcula, formando cido hipocloroso (HClO), que acta como un biocida general,
matando grmenes, microorganismos, algas, entre otros de ah su importancia en el
empleo en Endodoncia como agente irrigante de los conductos radiculares
abordandose como solucin en forma de hipoclorito de sodio en distintas
concentraciones sea 0.5% 0.2% las ms frecuentes empleadas. El cloro tambin es
usado como detergente para bacterias como el bacillus reprindentius o como el
martelianus marticus.
Qumica
El cloro elemental es un oxidante. Interviene en reacciones de sustitucin, donde
desplaza a los halgenos menores de sus sales. Por ejemplo, el gas de cloro
burbujeado a travs de una solucin de aniones bromuro o yoduro los oxida a bromo y
yodo, respectivamente.
Como los otros halgenos, el cloro participa en la reaccin de sustitucin
radicalaria con compuestos orgnicos que contienen hidrgeno. Esta reaccin es
frecuentemente -pero no invariablemente- no regioselectiva, y puede resultar en una
mezcla de productos isomricos. Frecuentemente, tambin es difcil el control del
grado de sustitucin, as que las sustituciones mltiples son comunes. Si los diferentes
productos de la reaccin se pueden separar fcilmente, por ejemplo, por destilacin, la
cloracin radicalaria sustitutiva (en algunos casos acompaada de una declorinacin
trmica concurrente) puede ser una ruta sinttica til. Algunos ejemplos industriales de
esto son la produccin de cloruro de metilo, cloruro de
metileno, cloroformo y tetracloruro de carbono a partir de metano, cloruro de alilo a
partir de propileno, y tricloroetileno y tetracloroetileno a partir de 1,2-dicloroetano.
Como con los otros haluros, el cloro participa de reacciones de adicin electroflicas,
ms notablemente, la cloracin de alquenos y compuestos aromticos, con un
catalizador cido de Lewis. Los compuestos orgnicos de cloro tienden a ser menos
reactivos en la reaccin de sustitucin nucleoflica que los correspondientes derivados
de bromo o yodo, pero tienden a ser ms baratos. Pueden ser activados por
sustitucin con un grupo tosilato, o por el uso de una cantidad cataltica de yoduro de
sodio.
El cloro es usado extensivamente en qumica orgnica y qumica inorgnica como un
agente oxidante, y en reacciones de sustitucin, porque frecuentemente el cloro
imparte propiedades deseadas a un compuesto orgnico, debido a su
electronegatividad.
Los compuestos de cloro son usados como intermediarios en la produccin de un gran
nmero de productos industriales importantes que no contienen cloro. Algunos
ejemplos
son: policarbonatos, poliuretanos, siliconas, politetrafluoroetileno, carboximetilcelulosa
y xido de propileno.
Uso como un arma
I Guerra Mundial
El gas cloro, tambin conocido como Bertholita, fue usado como un arma en la I
Guerra Mundial por Alemania el 22 de abril de 1915, en la Segunda Batalla de Ypres.
Como lo describieron los soldados, tena un olor distintivo de una mezcla entre
pimienta y pia. Tambin tena gusto metlico y punga el fondo de la garganta y el
pecho. El cloro puede reaccionar con el agua en la mucosa de los pulmones para
formar cido clorhdrico, un irritante que puede ser letal. El dao hecho por el gas de
cloro puede ser evitado por una mscara de gas, u otros mtodos de filtracin, que
hacen que la posibilidad total de morir por gas cloro sea mucho menor que por otras
armas qumicas. Fue diseado por un cientfico alemn posteriormente laureado con
un Premio Nobel, Fritz Haber del Kaiser-Wilhelm-Institute en Berln, en colaboracin
con el conglomerado qumico alemn IG Farben, quienes desarrollaron mtodos para
descargar el gas cloro contra una trinchera enemiga. Se alega que el rol de Haber en
el uso del cloro como un arma mortal condujo a su esposa, Clara Immerwahr, al
suicidio. Despus de su primer uso, el cloro fue utilizado por ambos lados como un
arma qumica, pero pronto fue reemplazado por los gases ms mortales fosgeno y gas
mostaza.
6
Guerra de Irak
El gas de cloro tambin ha sido usado por insurgentes contra la poblacin local y las
fuerzas de coalicin en la Guerra de Irak, en la forma de bombas de cloro. El 17 de
marzo del 2007, por ejemplo, tres tanques cargados con cloro fueron detonados en la
provincia de mbar, matando a dos personas, y enfermando a ms de 350.
7
Otros
ataques con bombas de cloro resultaron en mayores recuentos de muertos, con ms
de 30 muertes en dos ocasiones separadas.
8
La mayora de las muertes fueron
causadas por la fuerza de las explosiones, en vez de por los efectos del cloro, dado
que el gas txico es dispersado rpidamente en la atmsfera por la explosin. Las
autoridades iraques han incrementado la seguridad para el manejo del cloro, que es
esencial para proveer agua potable segura para la poblacin.
Otros usos
El cloro es usado en la manufactura de numerosos compuestos orgnicos clorados,
siendo los ms significativos en trminos de volumen de produccin el 1,2-
dicloroetano y elcloruro de vinilo, intermediarios en la produccin del PVC. Otros
organoclorados particularmente importantes son el cloruro de metilo, cloruro de
metileno, cloroformo, cloruro de vinilideno, tricloroetileno, percloroetileno, cloruro de
alilo, epiclorhidrina, clorobenceno, diclorobencenos y triclorobencenos.
El cloro tambin es usado en la produccin de cloratos y en la extraccin de bromo.
También podría gustarte
- Informe #048 - Casilla ElectronicaDocumento1 páginaInforme #048 - Casilla Electronicarikardoo_diegoooAún no hay calificaciones
- Bases Int Los OlivosDocumento72 páginasBases Int Los Olivosrikardoo_diegoooAún no hay calificaciones
- Asistencia Técnica XIX REUNIÓN ANUALDocumento10 páginasAsistencia Técnica XIX REUNIÓN ANUALrikardoo_diegoooAún no hay calificaciones
- Ordenanza Que Promueve La Reduccion Del Plastico y Tecnopor Ordenanza No 511mm 1755835 1Documento3 páginasOrdenanza Que Promueve La Reduccion Del Plastico y Tecnopor Ordenanza No 511mm 1755835 1rikardoo_diegoooAún no hay calificaciones
- Informe de Gestion Cien Dias Sopt PDFDocumento17 páginasInforme de Gestion Cien Dias Sopt PDFrikardoo_diegoooAún no hay calificaciones
- Oficio #274-2018 - Repersa PENDocumento1 páginaOficio #274-2018 - Repersa PENrikardoo_diegoooAún no hay calificaciones
- Modulo-01 Conflictos OndsDocumento72 páginasModulo-01 Conflictos Ondsrikardoo_diegoooAún no hay calificaciones
- Decreto Supremo 028-2009mtcDocumento2 páginasDecreto Supremo 028-2009mtcrikardoo_diegooo100% (1)