Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Ejercicios Gases Solucion
Cargado por
Joseph Moore50%(4)50% encontró este documento útil (4 votos)
6K vistas6 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
50%(4)50% encontró este documento útil (4 votos)
6K vistas6 páginasEjercicios Gases Solucion
Cargado por
Joseph MooreCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 6
CORPORACION UNIVERSITARIA REPUBLICANA
GUIA DE APRENDIZAJE No. 5
GASES
1. Generalidades de Gases
1.1 Cmo se explica que los gases ejerzan presin sobre las paredes
del recipiente que los contiene?
Los gases son partculas muy pequeas y cuando se encuentra mucha
cantidad de ese gas(mucha cantidad de esas partculas) empiezan a
empujarse unas con otras generando lo que se llama presin. Lo que trata el
gas es de expandirse SIEMPRE y si uno los pone en un recipiente quiere de
alguna manera escaparse ejerciendo mas presion. Por lo tanto, por un lado el
gas tiende a expandirse y por eso ejerce presion sobre las paredes del
recipiente y por otro lado... si se pone mucha cantidad de particulas intenta
expandirse con mas fuerza y escapar
1.2 Qu factores determinan la mayor o menor presin de un gas?
El volumen y la temperatura. Cuando el volumen de un gas contenido en un
recipiente (a temperatura constante) se reduce, la presin aumenta, si por el
contrario el volumen aumenta, la presin de ste disminuye, siendo as,
inversamente proporcionales (Ley de Boyle).
Por otro lado, si a un gas (de volumen inalterable) se le aplica calor,
aumentando as su temperatura, ste aumenta tambin su presin debido al
efecto que el calor ejerce en las molculas del gas, haciendo que stas
colisionen ms frecuentemente entre s, ocasionando un aumento en la
presin. Si la temperatura disminuye, tambin la presin lo hace, siendo estas
directamente proporcionales (Ley de Gay-Lussac).
1.3 Cierta cantidad de gas, por ejemplo oxigeno, puede ocupar
diferentes volmenes dentro de un recipiente. de qu factores depende
que esto suceda?
Cierto. Esto es posible y ello depende de :
1- De la presin del sistema
2- De la temperatura del sistema
1.4 Exprese los siguientes valores de presin de presin en
atmosferas
A. 400 mm Hg
= 400 mm Hg / ( 760 mm Hg/1atm)=0,526 atm
B. 380 torr
=380 torr / (760 torr/1atm) =0,5 atm
C. 1.3 pascales
= 1,3 pascales /(1,013 10^5 pascales/ 1atm)=1,28 10^-5 atm
1.5 Halle la densidad de un gas, si 6.8 gramos ocupan 5.6 litros.
Se debe usar la frmula de densidad porque ya tienes la masa y el volumen.
puedes pasar los litros a ml.
1L------1000ml
5,6L------X=5600ml
D=m/V
D=6,8g/5600ml
D=0,0012g/ml
Si lo quieres dejar en L:
D=m/V
D=6,8g/5,6L
D= 1,21g/L
1.6 La presin de un neumtico es de 1.6 Atmosferas, Expresar la
presin en pascales y en mm de Hg.
1.7 Determine el nmero de moles que corresponda a 45 gramos de cada
una de las siguientes sustancias: CO
2
, N
2
, CO, H
2
, C
3
H
8.
Se calcula los pesos moleculares:
CO2=(12PAx1)+(16PAx2)=12+32=44g/mol
44gCO2-------1molCO2
45gCO2------X=1,02moldeCO2
N2=(14x2)=28g/mol
28gN2------1molN2
45gN2------X=1,61molN2
CO=(12x1)+(16x1)=12+16=28g
28gCO------1molCO
45gCO------X=1,61molCO
H2=(1x2)=2g/mol
2gH2-----1molH2
45gH2----X=22,5molesdeH2
C3H8=(12x3)+(1x8)=36+8=44g/mol
44gC3H8------1molC3H8
45g C3H8 ------ X= 1,02mol C3H8
2. Ley de Boyle: relacin presin volumen
2.1 Cierta cantidad de C
2
H
2
ocupa 4.8 litros a una presin de 85 torr,
determine el volumen de dicho gas a la presin de 1 atm.
P1V1=P2V2
(85Torr)(4.8L)=(1atm)(x)
Convertimos los torr a atm..... As.
1atm---------------------------760torr
x-----------------------------------85torr
x=0.111atm
ahora pasamos a la ecuacin y despejamos a V2 as:
V2=P1V1/P2.......sus...(0.111atm)(4.8L)/(1atm)=0.532L
2.2 Cinco litros de Fren CCl
2
F
2
, un gas utilizado en refrigeracin, ejerce
una presin de 190 mm Hg en un recipiente dado. Si la presin aumenta
hasta 230 mm Hg, diga:
a. El volumen del gas aumentara o disminuir?
b. Cul es el nuevo volumen del gas?
2.2 Calcule la cantidad que falta en cada uno de los siguientes conjuntos
de datos de presin y volumen. Considrese que la temperatura y la
cantidad de gas se mantienen contantes.
V
1
P
1
V
2
P
2
25.0 L 800 mm Hg 22.8 L
1.8 atm. 12.3 L 0.9 atm.
780 mL 1.1 Pa 1.6 Pa
25.3 L 21.7 L 112.5 Torr
125 L 3.8 atm. 2.9 atm
3. Ley de Charles: relacin volumen temperatura
3.1 Si cierta cantidad de dixido de azufre a 25C ocupa un volumen de
18.5 litros, Cual es el volumen a 30C?
3.2 Si 31.8 L de amoniaco se mantienen a 20C y una presin de 1 Atm,
Cul ser el nuevo volumen si la temperatura aumenta a 40C y la
presin se mantiene en una atmosfera?
3.3 A continuacin, se dan cinco situaciones para la aplicacin de la Ley
de Boyle, con la temperatura y la cantidad de gas constantes.
Establezca para cada uno de los casos el valor de la variable faltante.
V
1
T
1
V
2
T
2
39.5 L 24C 45.6 L 27.7 C
500 mL 40.5 C 0.12L 10 C
24.7L -10 C 75.4 L 30.5 C
22.4 L 0.0 C 2.84L 400 K
44.8 L 60C 22.4 L 30 C
4. Leyes de Boyle y de Charles combinadas
4.1 Calcule los valores de cada uno de los siguientes conjunto de datos
CONDICIONES INICIALES CONDICIONES FINALES
Presin Temperatura Volume
n
Presin Temperat
ura
Volumen
580 torr 25 C 45.6 L 0.42atm 15 C 49.2 L
2.5 Pa 250 K 125 mL 3.4 Pa. 62.100C 225L
2.6 atm. 20 C 854 mL 1,800
torr
0C 0.04L
760
mmHg
28 C 33.6L 0.4 atm. 5 C 15.0 L
4.5 atm 28.4C 1,245 mL 1,500
torr
30 C 3.0 L
4.2 Una muestra de gas a 25C y 800 torr ocupa un volumen de 3,450 mL.
Cul es la temperatura para que la presin cambie a 1.5 atmosferas y
el volumen a 4 litros?
Rta: 25C= 298K ; 3450ml= 3,45L y 800mmHg= 800 / 760= 1,053 atm.
298K(1,5 / 1,053)(4 / 3,45)= 492,17K. Rpta, es decir:492,17 - 275= 219,17C Rpta
4.3 Cual es la presin final de 5 L de O
2
a 560 mm hg y 25 C si su
volumen se expande a 7.5 L y la temperatura se eleva hasta 40 C?
4.4 El volumen de cierta cantidad de O
2
a 15 C y 560 torr es de 5.6 L.
Cul es su volumen en CN?
4.5 A cuntas atmosferas deben someterse 10 L de H
2
que estn a
15C y 0.5 at. Para que el volumen disminuya a la mitad, si la
temperatura es ahora de 30 C?
5. Ley de Gay Lussac. Relacin presin temperatura
5.1 Una muestra de gas Nen se encuentra a 800 torr y 25 C. Cul es la
nueva presin si la temperatura aumento hasta 45C? Considere el
volumen constante.
5.2 Cierta cantidad de O
2
se encuentra confinada en un recipiente
hermticamente cerrado a una presin de 1.5 at. Y 25 C Cul es la nueva
presin de dicho gas cuando el termmetro marca 0C?
5.3 Cual es la presin final de un determinado gas, si se enfran
1,500 mL desde 25 C hasta -50C y si la presin inicial era de
1.5 at.?
6. Principio de Avogadro y volumen molar
6.1 Determine el volumen que ocupan 25 gramos de cada uno de los
siguientes gases en CN: O
2
, H
2
, N
2
, CH
4
6.2 A cuntos gramos en CN equivalen 28.6 litros de cada uno de los
siguientes gases: CH
4
, CO
2
, SO
3
, H
2
S ?
6.3 Cierta cantidad de CO ocupa 25 litros a 20C y 560 torr . Determine:
a. Su volumen en condiciones normales
b. La cantidad en gramos de CO
c. El numero de moles del gas
d. El numero de molculas del compuesto
6.4 Si 62 gramos de un gas ocupan un volumen de 90 L a 15 C y 700 torr,
a. Qu volumen ocupara dicho gas en CN?
b. A cuntas moles equivale dicho volumen?
c. Cul es el peso molecular del gas?
7. Ecuacin de Estado. Ley de los Gases ideales
7.1 Se van a llenar tres cilindros de 50 litros con hidrogeno, H
2
, acetileno
C
2
H
2
y Helio, respectivamente. Calcule cuantos gramos de cada gas se
requieren para llenar dichos cilindros, si la presin ha de ser 10 atm. Y
la temperatura de 23C.
7.2 Determine, por separado, la presin que ejercen 50 gramos de cada
una de las siguientes sustancias gaseosas a 20C en cilindros de
acero de 50 litros: C
2
H
2
Acetileno, bixido de carbono CO
2
, Acido
Sulfhdrico H
2
S.
7.3 Que volumen a 25C y 600 mm Hg ocupan 45 gramos de monxido de
carbono, CO?
También podría gustarte
- Ejercicios de Leyes y Gases Unidad 5Documento27 páginasEjercicios de Leyes y Gases Unidad 5Ricardo Mojica Colmenares50% (2)
- 1P Guía 1 - Química 11.1, 11.2, 11.3Documento32 páginas1P Guía 1 - Química 11.1, 11.2, 11.3Helen Guzman100% (1)
- Actividad 1Documento10 páginasActividad 1juan sebastian joya espitiaAún no hay calificaciones
- 5A Nomenclatura e Isomeria EstreucturalDocumento14 páginas5A Nomenclatura e Isomeria EstreucturallujulAún no hay calificaciones
- Quimica 165Documento5 páginasQuimica 165Mariana Ortegon100% (1)
- Actividad 4 TPDocumento2 páginasActividad 4 TPjuliAún no hay calificaciones
- Problemas de estequiometría: Ejercicios para desarrollarDocumento4 páginasProblemas de estequiometría: Ejercicios para desarrollarLUIS ALEJANDRO DIAZ VILLAMIZAR0% (1)
- Gases Mapa ConceptualDocumento1 páginaGases Mapa ConceptualEdwin José De La Rosa LozanoAún no hay calificaciones
- Reporte de Lab - Práctica 5 - Brig 2 - Equipo 7 - IamDocumento21 páginasReporte de Lab - Práctica 5 - Brig 2 - Equipo 7 - IamXimena RubioAún no hay calificaciones
- Taller Gases IdealesDocumento3 páginasTaller Gases IdealesBRIYID JEHOVANNA TAMI SOLERAún no hay calificaciones
- Equilibrio Químico 13-14 PDFDocumento4 páginasEquilibrio Químico 13-14 PDFAngelaAún no hay calificaciones
- 1.4. Números de Oxidación - PDFDocumento4 páginas1.4. Números de Oxidación - PDFFreddy AbarulloAún no hay calificaciones
- Capacidad Calorífica y Entalpía de Fusión PracticaDocumento15 páginasCapacidad Calorífica y Entalpía de Fusión PracticaIvan Guerrero0% (1)
- TALLER 29 1 Condicion de EquilibrioDocumento11 páginasTALLER 29 1 Condicion de EquilibrioEdwar Andrey Arquez MontañoAún no hay calificaciones
- Constante Universal de Los Gases IdealesDocumento3 páginasConstante Universal de Los Gases IdealesWorldHoldOn0% (1)
- 12 Julio Tema Reconocimiento Del RomanticismoDocumento5 páginas12 Julio Tema Reconocimiento Del Romanticismocris2727100% (1)
- Trabajo de QuimicaDocumento7 páginasTrabajo de QuimicaLuz BedoyaAún no hay calificaciones
- PREPARACIÓN DE SOLUCIONES AMORTIGUADORASDocumento5 páginasPREPARACIÓN DE SOLUCIONES AMORTIGUADORASAngel OliveraAún no hay calificaciones
- Expansión Térmica: Dilatación de Sólidos, Líquidos y GasesDocumento12 páginasExpansión Térmica: Dilatación de Sólidos, Líquidos y GasesRosmery RodriguezAún no hay calificaciones
- Problemas de Química 2Documento7 páginasProblemas de Química 2Kevin GarciaAún no hay calificaciones
- Taller de Gases IdealesDocumento10 páginasTaller de Gases IdealesMARIA JOSE QUIROGAS CUELLOAún no hay calificaciones
- Propiedades de HidrocarburosDocumento9 páginasPropiedades de Hidrocarburoscarlos encisoAún no hay calificaciones
- Actividad 3 Luis Sierra 11-2Documento10 páginasActividad 3 Luis Sierra 11-2Luis Fernando100% (3)
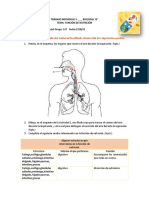
- Función de NutriciónDocumento4 páginasFunción de NutriciónJUAN CARLOS CHARRASQUIEL LEONAún no hay calificaciones
- Actividad de Gases 888 AgostoDocumento4 páginasActividad de Gases 888 AgostoJhonnie GaonaAún no hay calificaciones
- 11D Jhina Vanesa Torres Torres Guia 1 Español Segundo PeriodoDocumento5 páginas11D Jhina Vanesa Torres Torres Guia 1 Español Segundo Periodojhina vanesa torres torresAún no hay calificaciones
- Cap-6. GasesDocumento39 páginasCap-6. GasesLina María Pineda Muñoz100% (1)
- Ecuaciones Cúbicas de EstadoDocumento5 páginasEcuaciones Cúbicas de EstadoCATHERINE ALEJANDRA GALICIA RODRIGUEZAún no hay calificaciones
- Informe de Laboratorio #2 Masa Molecular de Una Sustancia Volátil Grupo#5Documento16 páginasInforme de Laboratorio #2 Masa Molecular de Una Sustancia Volátil Grupo#5Valentina Fuentes urangoAún no hay calificaciones
- Los GasesDocumento4 páginasLos Gaseslucas david ospino ibarraAún no hay calificaciones
- Historia Acidos y BasesDocumento30 páginasHistoria Acidos y BasesOv Verónica100% (1)
- Guía de Ejercicios Dilución y Mezcla de SolucionesDocumento4 páginasGuía de Ejercicios Dilución y Mezcla de SolucionesMaria Paola Rodríguez100% (1)
- Informe Practica 3Documento7 páginasInforme Practica 3Juan Turmero AgapitoAún no hay calificaciones
- QuimicaDocumento8 páginasQuimicaJeyson Karoll100% (2)
- Taller de Quimica Formula Empirica y Formula MolecularDocumento1 páginaTaller de Quimica Formula Empirica y Formula MolecularFabricio RodriguezAún no hay calificaciones
- Taller 2Documento6 páginasTaller 2ClassVir [Class Virtual]Aún no hay calificaciones
- LENGUAJE DE LA QUÍMICA - Actividad #4Documento7 páginasLENGUAJE DE LA QUÍMICA - Actividad #4David JimenezAún no hay calificaciones
- 3-Gases Con EjerciciosDocumento28 páginas3-Gases Con EjerciciosNicolas EH0% (1)
- Trabajo en Equipo 11 economia-SOLUCIONDocumento3 páginasTrabajo en Equipo 11 economia-SOLUCIONMariana Paniza0% (1)
- Quimica Organica MDocumento6 páginasQuimica Organica MCamilo AndresAún no hay calificaciones
- Propiedades ColigativasDocumento7 páginasPropiedades ColigativasEliecer GonzalezAún no hay calificaciones
- Análisis y reflexión sobre aforismosDocumento2 páginasAnálisis y reflexión sobre aforismosGhysell AndradeAún no hay calificaciones
- Ejercicio - GrupalDocumento2 páginasEjercicio - GrupalCRISTIAN CEDEÑO VELASCOAún no hay calificaciones
- Informe No. 2 Tipos de ReaccionesDocumento22 páginasInforme No. 2 Tipos de ReaccionesAngely AguilarAún no hay calificaciones
- 03 Gráfico de Dispersión en Excel T Vs PDocumento7 páginas03 Gráfico de Dispersión en Excel T Vs PJessenia CarmonaAún no hay calificaciones
- 198Documento5 páginas1981lvaro1javier1mej1a1100% (1)
- Taller de QuimicaDocumento3 páginasTaller de Quimicalizney gutierrez100% (1)
- Ejercicios - Libro ChangDocumento4 páginasEjercicios - Libro ChangJhon Jairo Ospina LealAún no hay calificaciones
- Compuestos de CoordinacionDocumento8 páginasCompuestos de CoordinacionAgustin Mamani UscamaytaAún no hay calificaciones
- Ejercicios HidrostaticaDocumento9 páginasEjercicios HidrostaticaMelissara Galeano ValenciaAún no hay calificaciones
- Taller Unidad 2. Estructura Del AtomoDocumento4 páginasTaller Unidad 2. Estructura Del AtomoJuan IbarraAún no hay calificaciones
- Grupos Funcionales: Éteres y AlcoholesDocumento20 páginasGrupos Funcionales: Éteres y Alcoholesdiego sierra florezAún no hay calificaciones
- Practica FinalDocumento7 páginasPractica FinalVictor Hugo GordonAún no hay calificaciones
- Derivados halogenados de hidrocarburosDocumento26 páginasDerivados halogenados de hidrocarburosKaritoo BrelisAún no hay calificaciones
- S06.s1 - Material - TermoquímicaDocumento38 páginasS06.s1 - Material - TermoquímicaWalter Roque PiscoyaAún no hay calificaciones
- Concentraciones y cálculos de soluciones químicasDocumento9 páginasConcentraciones y cálculos de soluciones químicasalina tatiana checa andradeAún no hay calificaciones
- Practica # 3. Determinación Del Calor de ReacciónDocumento7 páginasPractica # 3. Determinación Del Calor de ReacciónSantiago CazorlaAún no hay calificaciones
- Quimica Industrialproblemas ResueltosDocumento9 páginasQuimica Industrialproblemas ResueltosAntonella Gonzalez BriceñoAún no hay calificaciones
- Taller ResueltoDocumento12 páginasTaller ResueltoDany Céspedes39% (18)
- Estado GaseosoDocumento40 páginasEstado GaseosoJerson Michael Montecino GalazAún no hay calificaciones
- Paradoja de Los Gemelos PDFDocumento6 páginasParadoja de Los Gemelos PDFRolan CabreraAún no hay calificaciones
- FRICCIONDocumento8 páginasFRICCIONSergio Escobedo Medina67% (3)
- Informe Generador Del Corriente AlternaDocumento4 páginasInforme Generador Del Corriente AlternaJesus Corvacho100% (1)
- Taller Ep Dinamica Mayo 2019Documento28 páginasTaller Ep Dinamica Mayo 2019Miguel Angel Aguirre PozoAún no hay calificaciones
- Transformador: Cálculos de corriente, potencia y rendimientoDocumento5 páginasTransformador: Cálculos de corriente, potencia y rendimientoIgnacio NobiliAún no hay calificaciones
- Hoja de Trabajo 2, Física IV JCDocumento4 páginasHoja de Trabajo 2, Física IV JCJuan CarlosAún no hay calificaciones
- FisicaDocumento5 páginasFisicaErika ValladaresAún no hay calificaciones
- 1252307571.estatica-Baricentro y M. InerciaDocumento33 páginas1252307571.estatica-Baricentro y M. InerciaRaul Madrigal BravoAún no hay calificaciones
- Ondas Electromagneticas en Un Medio ConductorDocumento9 páginasOndas Electromagneticas en Un Medio ConductorzuleAún no hay calificaciones
- Diapositiva N°3 MMI-2020Documento53 páginasDiapositiva N°3 MMI-2020Jaime ChipanaAún no hay calificaciones
- CinemáticaDocumento9 páginasCinemáticaWendy Riveros OchoaAún no hay calificaciones
- Pre-Informe Equilibrio en Tres DimensionesDocumento2 páginasPre-Informe Equilibrio en Tres DimensionesLetras Canciones en 30 segundosAún no hay calificaciones
- 3 Practica Dirigida Fis 2 Unac v1Documento2 páginas3 Practica Dirigida Fis 2 Unac v1KANELLAún no hay calificaciones
- Laboratorio 1 - Fisica 3 - Virtual Ley de CoulombDocumento4 páginasLaboratorio 1 - Fisica 3 - Virtual Ley de CoulombOscar Infantes suarezAún no hay calificaciones
- TorcaDocumento3 páginasTorcaMARCELO ESPINOZA S├üNCHEZAún no hay calificaciones
- Tercera Ley de NewtonDocumento13 páginasTercera Ley de NewtonRoberto GonzalezAún no hay calificaciones
- Tésis de Voladura - Vibraciones Inducidas PDFDocumento211 páginasTésis de Voladura - Vibraciones Inducidas PDFHanry Abraham Guillen VilcaAún no hay calificaciones
- Taller II - FODocumento12 páginasTaller II - FOJohn EdwardAún no hay calificaciones
- Protones, Neutrones y ElectronesDocumento6 páginasProtones, Neutrones y Electronesvalery hernández100% (1)
- Articulo ScaraDocumento4 páginasArticulo ScaraShiryu DE AriesAún no hay calificaciones
- Examen Cuanti 4aDocumento3 páginasExamen Cuanti 4aQuimica GonzalezAún no hay calificaciones
- Campos Variantes Con El Tiempo y Ecuaciones de Maxwell - Resumen Del HaytDocumento5 páginasCampos Variantes Con El Tiempo y Ecuaciones de Maxwell - Resumen Del HaytEd DeldelAún no hay calificaciones
- Balance de Tacho N°7Documento5 páginasBalance de Tacho N°7Juan Carlos Rojas RuizAún no hay calificaciones
- RESUMEN HEISENBERG La Verdad Habita en Las ProfundidadesDocumento4 páginasRESUMEN HEISENBERG La Verdad Habita en Las ProfundidadesFilosofía Antigua Gnoseología UnsAún no hay calificaciones
- Laboratorio 4Documento4 páginasLaboratorio 4Katheryn Lázaro100% (3)
- Fuerzas Electromagnéticas Fuerza Transmitida Por Los TornillosDocumento7 páginasFuerzas Electromagnéticas Fuerza Transmitida Por Los TornillosMELIDY EIDED HINOSTROZA MITACCAún no hay calificaciones
- Tarea MS 1Documento10 páginasTarea MS 1Jose AlfaroAún no hay calificaciones
- 4 Grado de Hiperasticidad en Vigas y MarcosDocumento12 páginas4 Grado de Hiperasticidad en Vigas y MarcosAndrés Christian Cervantes PaucarAún no hay calificaciones
- Actividad 4Documento5 páginasActividad 4Javier a la TorresAún no hay calificaciones
- Seminario 1 Soluciones PDFDocumento9 páginasSeminario 1 Soluciones PDFdavid cadillo varillasAún no hay calificaciones