Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Seg Ley
Cargado por
hopliaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Seg Ley
Cargado por
hopliaCopyright:
Formatos disponibles
Para aprender Termodinmica resolviendo Problemas Entropa.
La entropa se define como
Silvia Prez Casas
dS =
qreversible
T
La entropa es una funcin de estado, es una propiedad extensiva. La entropa es el criterio de espontaneidad y equilibrio en sistemas aislados (volumen y energa interna constantes). Este criterio se aplica de la siguiente manera: a) si la entropa del universo aumenta, el proceso es espontneo; b) si la entropa del universo disminuye, el proceso no es espontneo; c) si la entropa del universo permanece constante, el sistema se encuentra en equilibrio. Segunda Ley . La entropa del universo aumenta. Tercera Ley. La entropa de un cristal puro y perfecto es cero en el cero absoluto de temperatura. La entropa puede expresarse en funcin de temperatura y volumen como:
dS = Cv 1 U dT + P + dV T T V T
Cv S donde = T V T
o tambin como dS =
1 S U = P + V T T V T
Cv dT + dV T
La entropa puede expresarse en funcin de temperatura y presin como:
dS = Cp 1 H dT + V dP T T P T
Cp S donde = T P T
o tambin como
1 H S = V P T T P T
dS =
Cp dT V dP T
Problemas resueltos.
Material didctico en revisin
71
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
1. Un mol de gas ideal realiza una expansin isotrmica de 20 MPa a 1 MPa . La temperatura es de 398.15 K. Calcular el cambio de entropa para el gas, los alrededores y el total, a) si el proceso es reversible; b) si el proceso es irreversible y la presin externa es igual a la presin final del gas. Solucin: a) Si el proceso es reversible. Calculamos primero el cambio de entropa para el sistema. Partimos de la definicin de entropa, e integramos la ecuacin considerando las condiciones del proceso:
dS sistema =
( qreversible ) sistema T
como la temperatura se mantiene constante,
S sistema =
( qreversible )sistema
T
Debido a que la energa interna de un gas ideal solamente depende de la temperatura, U = 0 y por lo tanto
( qreversible )sistema = ( wreversible )sistema = + nRT ln
nRT ln S sistema = T V2 V1 V2 P = nR ln 1 V1 P2
V2 P = + nRT ln 1 V1 P2
= nR ln
S sistema = +24.91JK 1
Observamos que la entropa del sistema aumenta al aumentar el volumen. Como se trata de un proceso reversible, debido a la Segunda Ley de la Termodinmica
Suniverso = 0 Suniverso = S sistema + Salrededores S sistema = Salrededores S alrededores = 24.91JK 1
b) Si el proceso es irreversible. Observemos que la entropa est definida en funcin del calor reversible Material didctico en revisin 72
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
dS sistema =
( qreversible ) sistema T
y por ello, al integrar obtenemos la misma ecuacin que utilizamos para calcular el cambio de entropa del sistema en el proceso isotrmico irreversible:
S sistema =
( qreversible )sistema
T
= nR ln
V2 P = nR ln 1 V1 P2
S sistema = +24.91JK 1
Como la entropa es funcin de estado, y tanto en el proceso reversible como en el irreversible el estado inicial y el estado final son iguales (como se muestra en la figura), el cambio de entropa del sistema es el mismo independientemente de la manera como se realiza el proceso. Estado inicial P=20 MPa T=398.15 K V=0.0165 L Presin externa = Presin del gas Proceso reversible Estado final P=1 MPa T=398.15 K V=3.31 L
Estado inicial P=20 MPa T=398.15 K V=1.655 x 10-4 m3
Proceso irreversible Presin externa constante
Estado final P=1 MPa T=398.15 K V=3.31 x 10-3 m3
Para calcular el cambio de entropa de los alrededores, partimos de la definicin de entropa y usamos el calor reversible que los alrededores dan al sistema para poder realizar la expansin. Este calor reversible de los alrededores es igual al calor que el sistema utiliza para hacer el proceso irreversiblemente.
dS alrededores =
( qreversible ) alrededores ( qirreversible ) sistema = T T
La energa interna de un gas ideal solamente depende de la temperatura, entonces Material didctico en revisin 73
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
( qreversible )alrededores = ( qirreversible )sistema = w =
S alrededores = Pext (V2 V1 ) T
V2
Pext dV = Pext (V2 V1 )
V1
Salrededores = 7.90 JK 1 Suniverso = S sistema + Salrededores = +17.01JK 1
Observamos que (de acuerdo con la Segunda Ley de la Termodinmica) en un proceso irreversible, la entropa del universo aumenta.
2. Un mol de gas de van der Waals realiza una expansin isotrmica de 0.0015m3 a 0.035m3. La temperatura es de 398.15 K. Calcular el cambio de entropa para el gas, los alrededores y el total, a) si el proceso es reversible; b) si el proceso es irreversible y la presin externa es 94.6 kPa. Para este gas a = 3.7 Pa m 6 mol 2 y b = 0.052 106 m3 mol 1 Solucin. a) Si el proceso es reversible Partimos de la definicin de entropa:
dS sistema =
( qreversible ) sistema T
y como la temperatura es constante, obtenemos que: S sistema =
( qreversible )sistema
T
A partir de la Primera Ley de la Termodinmica : q = U w y para el gas de van der Waals ya hemos demostrado que el trabajo isotrmico reversible se puede calcular como w = nRT ln
1 1 V2 nb an 2 . Tambin hemos visto que V1 nb V2 V1
an 2 dU = nCvdT + 2 dV V
y en este caso, como la temperatura permanece
1 1 an 2 constante, dU = 2 dV y por lo tanto: U = an 2 . Substituyendo V V2 V1
obtenemos: Material didctico en revisin 74
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
1 1 1 1 V nb q = U w = an 2 nRT ln 2 an 2 V1 nb V2 V1 V2 V1
( qreversible )sistema = nRT ln
nRT ln S sistema =
V2 nb V1 nb
V2 nb V nb V1 nb = nR ln 2 T V1 nb
S sistema = 7.04 J K 1
Como el proceso es reversible
Suniverso = 0 Suniverso = S sistema + Salrededores Suniverso = 7.04 J K 1
b) El proceso es irreversible Partimos de la definicin de entropa:
dS sistema =
( qreversible ) sistema T
Observamos que para calcular el cambio de entropa, siempre necesitamos el calor reversible, este calor reversible es el mismo que el que calculamos en el inciso a):
V2 nb V1 nb
( qreversible )sistema = nRT ln
nRT ln S sistema =
V2 nb V nb V1 nb = nR ln 2 T V1 nb
y por lo tanto
S sistema = 7.04 J K 1
y es lgico puesto que el cambio sufrido por el sistema es el mismo en ambos casos y la entropa es funcin de estado. Cuando calculamos el cambio de entropa de los alrededores, tenemos que observar que el cambio que sufren los alrededores es diferente en el caso irreversible comparado con el reversible, ya que los alrededores deben darle al
Material didctico en revisin
75
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
sistema el calor necesario para que realice un proceso reversible en el primer caso, y un proceso irreversible en el segundo caso. Para los alrededores
dS alrededores =
donde
( qreversible ) alrededores ( qirreversible ) sistema = T T
( qirreversible )sistema = U w
donde U se calcula igual que en el caso reversible porque la energa interna es funcin de estado
1 1 q = U w = an 2 w V2 V1
y el trabajo lo calculamos como
w=
V2
Pext dv = Pext (V2 V1 )
V1
1 1 q = an 2 Pext (V2 V1 ) = 808.15 J V2 V1
Salrededores = 2.03 J Suniverso = S sistema + Salrededores = +5.01J
La entropa del universo aumenta porque se trata de un proceso irreversible.
3. La capacidad calorfica del slice (SiO2) slido es:
Cp / ( J / Kmol ) = 46.94 + 34.31 103 T 11.30 105 T 2
su coeficiente de expansin trmica es 0.3530 x 10-4 K-1 y su volumen molar es de 22.6 cm3 mol-1 . Calcular el cambio de entropa para un mol de slice para el proceso en el cual el estado inicial es de 1 bar y 200 K y el estado final es de 1000 bar y 500 K. Solucin.
dS =
Cp dT V dT T
Material didctico en revisin
76
Para aprender Termodinmica resolviendo Problemas
T 2 46.94 P2 S = + 34.31 103 11.3 105 T 3 dT V dP T1 P1 T
Silvia Prez Casas
S = 46.94ln
1 T2 1 1 + 34.31 103 (T2 T1 ) + (11.3 105 ) 2 2 V ( P2 P1 ) 2 T1 T2 T1
S = 41.359 JK 1mol 1
Es interesante observar que el cambio de entropa debido al cambio de presin (V ( P2 P1 ) ) , es muy pequeo, -0.0796 JK-1mol-1, lo cual significa que al aumentar la presin desde 1 hasta 1000 bar, la entropa de un mol de SiO2(s) apenas disminuye en 0.0796 JK-1 4. Un mol de un gas ideal monoatmico se calienta reversiblemente de 298.15 K a 398.15 K. Calcular el cambio de entropa del sistema, de los alrededores y el total, a) Si el proceso se realiza a volumen constante b) Si el proceso se realiza a presin constante Solucin a) A partir de la definicin de la entropa
dS =
qrev
T
y considerando que el volumen es constante y que el gas se
comporta idealmente,
dS sistema = S sistema
dU nCvdT = T T T = nCv ln 2 T1
S sistema = 3.61 J K 1
la entropa del sistema aumenta debido a que la temperatura aumenta. Como se trata de un proceso reversible, de acuerdo a la segunda ley de la termodinmica, la entropa del universo se mantiene constante
Material didctico en revisin
77
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
Suniverso = S sistema + Salrededores = 0 S alrededores = S sistema S alrededores = 3.61 J K 1
b) Partimos de la misma ecuacin y ahora consideramos que la presin es constante
dS sistema = S sistema
dH nCpdT = T T T2 = nCp ln T1
S sistema = 6.01 J K 1
Observamos que el aumento de entropa del sistema es mayor
cuando se trata de un calentamiento a presin constante comparado con el aumento de entropa del sistema en un calentamiento a volumen constante. Como el proceso es reversible
Suniverso = S sistema + Salrededores = 0 S alrededores = S sistema S alrededores = 6.01 J K 1
5. Cinco moles de nitrgeno son enfriados reversiblemente desde 1000 hasta 300 K. Calcular el cambio de entropa para el sistema, para los alrededores y el total considerando que Cv depende de la temperatura, a) Si el proceso se realiza a volumen constante b) Si el proceso se realiza a presin constante Solucin En tablas encontramos el valor de Cp
Cp = 3.2454 + 0.7108 103 T 0.406 107 T 2 R
Como se trata de un gas ideal, Cp Cv = R , de donde obtenemos
Material didctico en revisin
78
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
Cv Cp = 1 R R Cv = 2.2454 + 0.7108 103 T 0.406 107 T 2 R
a) Partiendo de la definicin de entropa y considerando que el proceso se realiza a volumen constante y que el gas se comporta idealmente:
dS =
qrev
T
dU nCvdT = T T R ( 2.2454 + 0.7108 103 T 0.406 107 T 2 ) dT T
S2
dS = n
S1
T2
T1
T 0.406 107 2 T2 T12 ) S sistema = nR 2.2454 ln 2 + 0.7108 103 (T2 T2 ) ( 2 T1
S sistema = 132.3 J K 1
La entropa del sistema disminuye porque la temperatura baja. Como se trata de un proceso reversible,
Suniverso = S sistema + Salrededores = 0 S alrededores = S sistema S alrededores = +132.3 J K 1
b)Para el caso en que la presin es constante
dS sistema =
dH nCpdT = T T
S2
dS = n
S1
T2
T1
R ( 3.2454 + 0.7108 103 T 0.406 107 T 2 )
dT T
T 0.406 107 2 T2 T12 ) S sistema = nR 3.2454 ln 2 + 0.7108 103 (T2 T2 ) ( 2 T1
S sistema = 182.36 JK 1
Suniverso = S sistema + Salrededores = 0 S alrededores = S sistema S alrededores = +182.36 J K 1
Material didctico en revisin
79
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
6. Calcular el cambio de entropa para el proceso de mezclado de 125 g de hielo a 00C con 250 g de agua a 850C en un sistema aislado.
H fusion = 6.009 kJmol 1 .
Solucin Dado que la entropa es una funcin de estado, podemos calcular el cambio total de entropa dividiendo el proceso en varias etapas: a) los 125 g de hielo, al entrar en contacto trmico con el agua caliente, se funden; b) posteriormente el agua lquida obtenida de la fusin, se calienta hasta Teq , y c) el agua caliente (250 g inicialmente a 850C) se enfra hasta Teq . De acuerdo a la primera ley de la termodinmica, y considerando que el proceso se realiza a presin constante,
H 0 fusion + H 0 calentamiento + H 0enfriamiento = 0
125 g 1 mol 1 mol J Teq Thielo 6009 Jmol 1 + 125 g 75.291 18.015 g 18.015 g K mol mol (Teq Tagua ) = 0 18.015 g
+250 g
De esta expresin obtenemos la temperatura de equilibrio.
Teq = 303.22 K y finalmente obtenemos el cambio de entropa total como la
suma de los cambios de entropa de cada una de las etapas en las que hemos subdividido el proceso:
Stotal = S fusion + Scalentamiento + Senfriamiento Stotal = H fusion T fusion + nCp ln Teq Thielo + nCp ln Teq Tagua caliente
Stotal = 152.67 JK 1 + 54.56 JK 1 48.64 JK 1 Stotal = 158.59 JK 1
Este es un proceso espontneo, dado que se realiz en un sistema aislado y la entropa aument. Obsrvese que la entropa del agua que inicialmente estaba
Material didctico en revisin
80
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
caliente, disminuy; sin embargo para saber si el proceso es espontneo o no, debemos calcular el cambio total de entropa.
7. Un mol de un gas monoatmico ideal se expande reversible y adiabticamente desde 5 hasta 10 dm3. La temperatura inicial es de 500K. Calcular la temperatura final, q, w, U, H, S del sistema, S de los alrededores y S total. Solucin:
1 1
T2 V1 = T1 V2
V T2 = T1 1 V2 U = w
T2 = 315.13K
Observamos que en una expansin adiabtica, la temperatura disminuye.
qreversible = 0
y como se trata de un gas ideal, la energa interna solamente depende de la temperatura
dU = nCvdT U = 2.306kJ
U = nCv (T2 T1 )
La energa interna disminuye porque el sistema tiene que gastar su propia energa para hacer trabajo dado que no recibe ninguna de los alrededores. Por ser un gas ideal, la entalpa solamente depende de la temperatura
dH = nCpdT H = 3.843kJ
H = nCp (T2 T1 )
La entalpa disminuye porque disminuy la temperatura. Para obtener el cambio de entropa del sistema, partimos de la definicin, y dado que este es un proceso reversible obtenemos:
dS sistema =
qrev
T
=0
S sistema = 0
la entropa del sistema no cambia puesto que el calor reversible es cero, por esta razn se dice que este proceso es isoentrpico. Como los alrededores no ceden ni absorben calor del sistema,
Material didctico en revisin
81
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
dS alrededores =
( qrev )alrededores
T
=0
Salrededores = 0 Stotal = S sistema + Salrededores = 0
8. Un mol de un gas monoatmico ideal se expande irreversible y adiabticamente desde 5 hasta 10 dm3 contra una presin externa de 1.64 atm. La temperatura inicial es de 500K. Calcular la temperatura final, q, w,
U, H, S del sistema, S de los alrededores y S total.
Solucin: Como el calor vale cero,
dU = Pext dV
como el gas es ideal, la energa interna solamente depende de la temperatura
dU = nCvdT = Pext dV
considerando que Cv es constante y que la presin externa es constante,
nCv (T2 T1 ) = Pext (V2 V1 ) T2 = Pext (V2 V1 ) nCv + T1
T2 = 433.33K
El decremento de temperatura en el proceso adiabtico irreversible (66.66K) es menor que en el proceso adiabtico reversible (184.78K). Como ya habamos visto, partiendo del mismo estado (500K, 10 dm3) al realizar un proceso adiabtico, el estado final ser diferente para el proceso reversible (315.22 K y 5 dm3) comparado con el estado final alcanzado cuando el proceso se realiza irreversiblemente (433.33 K y 5 dm3). Esto tiene como consecuencia que el cambio de energa interna (y por consiguiente el trabajo) ser diferente en cada caso Expansin adiabtica reversible Estado inicial T1=500 K V1=5 dm3 Expansin adiabtica irreversible Estado final T2=315.22 K V2=10 dm3 Estado final T2=433.33 K Material didctico en revisin V2=10 dm3 82
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
dU = nCvdT U = nCv (T2 T1 ) = w = 832 J dH = nCpdT H = nCp (T2 T1 ) = 1.386kJ
Para calcular el cambio de entropa del sistema, hay que recordar que la entropa se define en funcin del calor reversible
dS sistema =
( qreversible )sistema
T
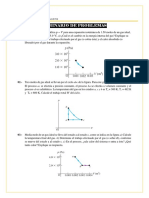
proponemos un camino formado por dos ms etapas reversibles para ir del estado inicial (5 dm3 y 500K) al estado final (10 dm3 y 433.3K). Este camino puede ser por un proceso isotrmico (de 5 dm3 y 500 K a 10 dm3 y 500 K) y un proceso isocrico de (10 dm3 y 500K a 10 dm3 y 433.3 K) como se muestra en la figura siguiente. Observamos que si escogiramos, por ejemplo, un proceso isobrico y uno isocrico (mostrados en la figura con lneas punteadas), nos faltaran datos, pues tendramos que calcular la temperatura alcanzada en la expansin isobrica
Material didctico en revisin
83
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
estado inicial
8
isobrico
isotrmico, T=500 K P / atm
6 isocrico
isocrico, V = 10 L estado final
5 6 7 8 9 10
V/L
S sistema = Sisotermico + Sisocorico S sistema = nR ln V2 T + nCv ln 2 V1 T1
S sistema = 3.98 JK 1
Para los alrededores el cambio de entropa sigue siendo igual a cero debido a que stos no interactan con el sistema
Salrededores = 0 Suniverso = S sistema + S alrededores = 3.98 JK 1
De acuerdo con la segunda ley de la termodinmica, en un proceso irreversible, la entropa del universo aumenta.
9. Un mol de un gas ideal monoatmico se comprime reversible y adiabticamente desde 40 hasta 15 L. La temperatura inicial es de 300 K. Calcular la temperatura final, q, w, U, H, S del sistema, S de los alrededores y S total. Solucin.
q = 0 por ser adiabtico
Material didctico en revisin
84
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
Como es un proceso adiabtico reversible, podemos obtener la temperatura final utilizando la frmula:
1 1
T2 V1 = T1 V2
V T2 = T1 1 V2
T2 = 576.52 K
En la compresin adiabtica la temperatura aumenta porque, como el sistema no intercambia calor con los alrededores, todo el trabajo se convierte en energa interna. Como se trata de un gas ideal, la energa interna y la entalpa solamente dependen de la temperatura:
dU = nCvdT U = nCv (T2 T1 ) = w U = 3.449 kJ = w dH = nCpdT H = nCp (T2 T1 ) = 5.748 kJ
En la compresin adiabtica reversible tambin tenemos que el proceso es isoentrpico porque la energa del sistema permanece constante.
dS alrededores =
( qrev )alrededores
T
=0
Salrededores = 0 Stotal = S sistema + Salrededores = 0
10. Un mol de un gas ideal monoatmico se comprime adiabticamente aplicando una presin constante de 2 atm desde 40 hasta 15 L. La temperatura inicial es de 300 K y la presin externa es de 4 atm. Calcular la temperatura final, q, w, U, H, S del sistema, S de los alrededores y S total. Solucin. Para obtener la temperatura final, nuevamente utilizamos la ecuacin que obtuvimos para el caso de la expansin adiabtica irreversible
Material didctico en revisin
85
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
q=0 U = w nCv (T2 T1 ) = Pext (V2 V1 ) T2 = Pext (V2 V1 ) nCv T2 = 706.5 K + T1
y nuevamente, como es un gas ideal,
U = nCv (T2 T1 ) = w U = w = 5.070kJ H = nCp (T2 T1 ) = 8.450 kJ
S sistema = Sisotermico + Sisocorico S sistema = nR ln V2 T + nCv ln 2 V1 T1
S sistema = 2.53 J K 1 dS alrededores =
( qrev )alrededores
T
=0
S alrededores = 0 Stotal = S sistema + S alrededores = 2.53 J K 1
11. Calcular el cambio de entropa de la reaccin siguiente a) a 298.15K; b) a 350 K
C2 H 2 ( g ) + 2 H 2 ( g ) C2 H 6 ( g )
Solucin. a) A partir de datos de tablas calculamos el cambio de entropa para la reaccin a 298.15 K
0 0 0 S298.15 K = S298.15 K C2 H 6 ( g ) S298.15 K C2 H 2 ( g ) + 2S 298.15 K H 2 ( g ) 0 1 1 1 1 S 298.15 = 1mol 229.6 J K 1mol 1 1mol 200.94 J K mol + 2mol 130.684 J K mol
0 1 S298.15 K = 232.708 J K
Material didctico en revisin
86
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
Observamos que la entropa absoluta de un elemento en su estado estndar
( H 2 ( g ) ) es diferente de cero debido a la tercera ley de la Termodinmica.
En
esta reaccin la entropa disminuye, por lo cual podemos afirmar que si esta reaccin se realizara en un sistema aislado (volumen y energa interna constantes), no sera espontnea. b) Para calcular el cambio de entropa a 350 K, podemos considerar que Cp es independiente de la temperatura por tratarse de un intervalo pequeo en esta propiedad y utilizamos la ecuacin
S20 = S10 +
Cp productos
350 K
dT Cpreactivos T
0 0 S350 K = S 298.15 K + 0 S350 K 0 S350 K 0 S350 K
Cp (C2 H 6 ( g )) Cp ( C2 H 2 ( g ) ) + 2Cp ( H 2 ( g ) ) dT T 298.15 K 350 dT J K 1 = 232.708 J K 1 + 52.63 ( 43.93 + 2 28.824 ) T 298.15 350 K = 232.708 J K 1 48.948 J K 1 ln 298.15K 1 = 240.56 J K
c) Para hacer el clculo a 1000K debemos tomar en cuenta la dependencia del
Cp con la temperatura. En tablas encontramos:
Compuesto C2H2 H2 C2H6
Cp / R
3.689 + 6.352 103 T 19.57 107 T 2 3.4958 0.1006 103 T + 2.419 107 T 2
1.131 + 19.224 103 T 55.60 107 T 2
Utilizamos la misma ecuacin:
0 S2 = S10 +
Cp
productos
Cp
reactivos
dT T
y ahora utilizamos los Cp en funcin de la temperatura
Material didctico en revisin
87
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
0 0 S1000 K = S 298.15 K +
Cp (C2 H 6 ( g )) Cp ( C2 H 2 ( g ) ) + 2Cp ( H 2 ( g ) ) dT T 298.15 K
350 K
1 0 S1000 + K = 232.708 J K
0 S1000 K
0 S1000 K
dT 9.5496 + 13.0732 103 T 40.868 107 T 2 8.31451J K 1 T 298.15 1000 9.5496 ln + 13.0732 103 (1000 298.15 ) 298.15 = 232.708 J K 1 + R 7 40.868 10 10002 298.152 ( ) 2 1 = 267.99 J K
350
12. Para el zinc se tienen los siguientes datos
y adems se conoce que a 6 K , S 6 K = 0.0194 JK 1mol 1 Obtener S a 100 K. Solucin. De la ecuacin
0
dS =
Cp dT V dP T
a presin constante,
S 100 K =
100 0
dS = dS +
0
100
d S = S 6K + S
Para obtener S debido al cambio de temperatura desde 6K hasta 100K, graficamos Cp vs T y ajustamos un polinomio para obtener la expresin que nos da Cp en funcin de la temperatura como se muestra en la figura. En este caso obtenemos:
Cp = (0.56031 0.18927T + 0.01685T 2 2.22508 104 T 3 + 9.15749 107 T 4 ) JK 1mol 1
Material didctico en revisin
88
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
20
15
Cp /J K-1 mol-1
10
Polynomial Regression for Data1_B: Y = A + B1*X + B2*X^2 + B3*X^3 + B4*X^4 Parameter Value Error -----------------------------------------------------------A 0.56031 0.22057 B1 -0.18927 0.02988 B2 0.01685 0.00116 B3 -2.22508E-4 1.6783E-5 B4 9.15749E-7 8.00078E-8 -----------------------------------------------------------R-Square(COD) SD N P -----------------------------------------------------------0.99977 0.13485 14 <0.0001 ------------------------------------------------------------
20
40
60
80
100
T/K
tenemos que a presin constante el cambio de entropa debido al aumento de temperatura de 6 a 100K se obtiene haciendo la integral
S2
S1
dS =
100
100
Cp dT T dT T
S =
(0.56031 0.18927T + 0.01685T 2 2.22508 104 T 3 + 9.15749 107 T 4 )
Material didctico en revisin
89
Para aprender Termodinmica resolviendo Problemas
Silvia Prez Casas
S = 0.56031ln
100 0.01685 0.18927 (100 6 ) + (1002 62 ) 6 2 2.22508 104 9.15749 107 3 3 100 6 1004 64 ) + ( ) ( 3 4
S = 100.419 J K -1mol 1
por lo tanto tenemos que
S 100 K = S 6 K + S = 0.194 + 100.419 S 100 K = 100.613 J K 1mol 1
13. Obtener el cambio de entropa para la combustin del propeno (C3H6) a partir de los siguientes datos a 298.15K. a) C3 H 8 ( g ) C3 H 6 ( g ) + H 2 ( g )
S 0 = 127.824 J K 1
b) C3H 8 ( g ) + 5O2 ( g ) 3CO2 ( g ) + 4 H 2O(l ) S 0 = 374.74 J K 1
1 c) H 2 ( g ) + O2 ( g ) H 2O (l ) 2
Solucin.
S 0 = 163.343 J K 1
Como la entropa es funcin de estado, no depende del nmero de etapas en que se realice la reaccin, por lo tanto podemos combinar las reacciones para obtener la reaccin deseada: Invertimos a) y cambiamos el signo del cambio de entropa
C3 H 6 ( g ) + H 2 ( g ) C3 H 8 ( g ) S 0 = 127.824 JK 1
sumamos b)
C3H 8 ( g ) + 5O2 ( g ) 3CO2 ( g ) + 4H 2O(l ) S 0 = 374.74 J K 1
invertimos c) y la sumamos
H 2O(l ) H 2 ( g ) +
1 O2 ( g ) S 0 = 163.343 JK 1 2
9 C3H 6 ( g ) + O2 ( g ) 3CO2 ( g ) + 3H 2O(l ) S 0 = 339.221 J mol 1 K 1 2
Material didctico en revisin
90
También podría gustarte
- s16 s2 Material AlternativoDocumento23 páginass16 s2 Material AlternativoLeonardo MedranoAún no hay calificaciones
- Entropia y 2da LeyDocumento74 páginasEntropia y 2da LeyJorge Luis ChuraAún no hay calificaciones
- Termodinamica CondensadoDocumento25 páginasTermodinamica CondensadoJoha Castillo JaramilloAún no hay calificaciones
- Entropía - FisicaDocumento18 páginasEntropía - Fisicajohan dionicio mgallanesAún no hay calificaciones
- Capitulo 3 Ley Cero y La Primera Ley de La TermodinamicaDocumento50 páginasCapitulo 3 Ley Cero y La Primera Ley de La TermodinamicaCinthia OrtizAún no hay calificaciones
- ENTROPIA (Usod Integral Ciclica)Documento18 páginasENTROPIA (Usod Integral Ciclica)Ned_creedAún no hay calificaciones
- Entropía en gases ideales y cambios de estadoDocumento14 páginasEntropía en gases ideales y cambios de estadoAngel Ulises Reyes NAún no hay calificaciones
- Tercer principio de la termodinámica y entropía nula a cero KelvinDocumento17 páginasTercer principio de la termodinámica y entropía nula a cero KelvinErik Ariel LauraAún no hay calificaciones
- ENTROPIADocumento12 páginasENTROPIACarlos CastroAún no hay calificaciones
- S09.s1 - Introducción A La TermodinámicaDocumento29 páginasS09.s1 - Introducción A La TermodinámicaMilagros Obregon VilcaAún no hay calificaciones
- Entropia y DesordenDocumento10 páginasEntropia y DesordenDaniel Ordosgoitia NovoaAún no hay calificaciones
- ppt.S09 - VFDocumento29 páginasppt.S09 - VFKokaAún no hay calificaciones
- SESION 9-Termoquìmica.Documento29 páginasSESION 9-Termoquìmica.Gabriel Armando Orellana NolascoAún no hay calificaciones
- 6 Entropia y DesordenDocumento12 páginas6 Entropia y DesordenALEJANDRO FERRAU PATIÑOAún no hay calificaciones
- TEMA 2-Gulag-FreeDocumento5 páginasTEMA 2-Gulag-Freeestudiosuja74Aún no hay calificaciones
- EntropiaDocumento5 páginasEntropiaKarla GuerreroAún no hay calificaciones
- Temodinámica QuímicaDocumento13 páginasTemodinámica QuímicaOSCAR PINTOS0% (1)
- S09.s1 - Introducción A La TermodinámicaDocumento30 páginasS09.s1 - Introducción A La TermodinámicajuancitoAún no hay calificaciones
- 8 EntropiaDocumento27 páginas8 Entropiamilyquin07Aún no hay calificaciones
- Entropía y la Segunda Ley de la TermodinámicaDocumento19 páginasEntropía y la Segunda Ley de la TermodinámicaNicole OssaAún no hay calificaciones
- Tema 2-Segundo y Tercer Principio-Clase 8Documento32 páginasTema 2-Segundo y Tercer Principio-Clase 8reynaldo acostaAún no hay calificaciones
- Semana 11 - Termodinamica - Transfrencia de Energía - PDFDocumento24 páginasSemana 11 - Termodinamica - Transfrencia de Energía - PDFmiloxe7428Aún no hay calificaciones
- Termodinamica UdeMM - 6Documento35 páginasTermodinamica UdeMM - 6Martin Javier RadogowskiAún no hay calificaciones
- Fórmulas TermodinámicaDocumento3 páginasFórmulas TermodinámicaThiago OsorioAún no hay calificaciones
- Captura de Pantalla 2022-08-18 A La(s) 13.35.21Documento10 páginasCaptura de Pantalla 2022-08-18 A La(s) 13.35.21Ivan DieguezAún no hay calificaciones
- Laboratorio 5 Sistemas TransitoriosDocumento8 páginasLaboratorio 5 Sistemas TransitoriosLeonardo TonazzolliAún no hay calificaciones
- Ejercicios Física AplicadaDocumento6 páginasEjercicios Física AplicadaNATALIA ORTEGA GOMEZAún no hay calificaciones
- UNIDAD 5 Entropia PDFDocumento37 páginasUNIDAD 5 Entropia PDFJose Antonio Aguilar IbarraAún no hay calificaciones
- Conceptos de EntropiaDocumento50 páginasConceptos de Entropiajandresb230% (1)
- La EntropíaDocumento12 páginasLa EntropíaJuan IdrovoAún no hay calificaciones
- Chuletario de Termodinámica.Documento3 páginasChuletario de Termodinámica.ap0cal1pse100% (1)
- Examen de Termodinamica ETSII UPV ValenciaDocumento7 páginasExamen de Termodinamica ETSII UPV ValenciaAaron Molina GalanAún no hay calificaciones
- CICLO DE CARNOT Diagramas y EficienciaDocumento7 páginasCICLO DE CARNOT Diagramas y EficienciaAldo Alvarez SalvadorAún no hay calificaciones
- Soluciones Examenes2223Documento38 páginasSoluciones Examenes2223Luis SuarezAún no hay calificaciones
- Clase 2 - Espontaneidad y EquilibrioDocumento60 páginasClase 2 - Espontaneidad y EquilibrioAlen NievesAún no hay calificaciones
- 2a y 3a Leyes de La TermodinámicaDocumento48 páginas2a y 3a Leyes de La TermodinámicaWendyAvelarAún no hay calificaciones
- Apuntes Teóricos TermoquímicaDocumento23 páginasApuntes Teóricos TermoquímicaNahualaAún no hay calificaciones
- 2da. Ley - EntropíaagericoDocumento19 páginas2da. Ley - EntropíaagericoAngelaAún no hay calificaciones
- Gases Ideales Primera LeyDocumento37 páginasGases Ideales Primera LeyJean Carlo GonzalesAún no hay calificaciones
- Informe 4 - TermodinamicaDocumento10 páginasInforme 4 - TermodinamicaALVARO FABIAN JO GUIVARAún no hay calificaciones
- Termodinámica de Los Procesos IrreversiblesDocumento98 páginasTermodinámica de Los Procesos IrreversiblesBruce ClozzaAún no hay calificaciones
- Tansferencia de CalorDocumento4 páginasTansferencia de Calorrichard jhayroAún no hay calificaciones
- Resumen EntropiaDocumento3 páginasResumen EntropiaJiménez Míreles MoisesAún no hay calificaciones
- Serie 2 - Resolución. Parte IDocumento22 páginasSerie 2 - Resolución. Parte Ieliana vegaAún no hay calificaciones
- Determinación de entropías absolutas a partir de la tercera ley de la termodinámicaDocumento4 páginasDeterminación de entropías absolutas a partir de la tercera ley de la termodinámicaDiego HernandezAún no hay calificaciones
- Practica 2Documento5 páginasPractica 2Mauricio SaMoAún no hay calificaciones
- Termodinámica y calor de reaccionesDocumento8 páginasTermodinámica y calor de reaccionesRocio BedogniAún no hay calificaciones
- Entropía y sus aplicaciones en termodinámicaDocumento14 páginasEntropía y sus aplicaciones en termodinámicajromoAún no hay calificaciones
- La Segunda Ley de La TermodinamicaDocumento19 páginasLa Segunda Ley de La TermodinamicajosueAún no hay calificaciones
- Primera Ley de La TermodinamicaDocumento44 páginasPrimera Ley de La TermodinamicaJuan Pablo DaurosAún no hay calificaciones
- 3a Ciclo Termodinámico Del TurborreactorDocumento12 páginas3a Ciclo Termodinámico Del TurborreactorAdalberto G. LagunaAún no hay calificaciones
- Ayudantía 10 (Con Solucionario)Documento6 páginasAyudantía 10 (Con Solucionario)Salomon SotoAún no hay calificaciones
- Maquina de CarnotDocumento5 páginasMaquina de Carnotroshmel asenciosAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaDe EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaAún no hay calificaciones
- Marco Lógico Ing. AgroinDocumento35 páginasMarco Lógico Ing. Agroinalejandra navarroAún no hay calificaciones
- AA1 Complementario Estructura Curricular Herramientas TICDocumento5 páginasAA1 Complementario Estructura Curricular Herramientas TICDANIEL ALBERTO FRANCO PINEDAAún no hay calificaciones
- Tabla PeriodicaDocumento37 páginasTabla Periodicaramirez_0992Aún no hay calificaciones
- Enfermedades Transmitidas Por AlimentosDocumento25 páginasEnfermedades Transmitidas Por AlimentosRoss AngelesAún no hay calificaciones
- El portero emprendedorDocumento2 páginasEl portero emprendedorleoAún no hay calificaciones
- 1 Mentalidad EmprendedoraDocumento23 páginas1 Mentalidad EmprendedoraRodriMoonAún no hay calificaciones
- Ciencias 6°: Célula y reproducciónDocumento65 páginasCiencias 6°: Célula y reproducciónAnonymous jST8CZP100% (1)
- Ciencias 6°: Célula y reproducciónDocumento65 páginasCiencias 6°: Célula y reproducciónAnonymous jST8CZP100% (1)
- Guia Quim G10Documento5 páginasGuia Quim G10alejandra navarroAún no hay calificaciones
- Protocolos de Derivados LacteosDocumento40 páginasProtocolos de Derivados LacteosMarioAvellaAún no hay calificaciones
- ISO 22000 Sistema de Gestión de Seguridad AlimentariaDocumento52 páginasISO 22000 Sistema de Gestión de Seguridad AlimentariaMarlenys HerediaAún no hay calificaciones
- La Celula PDFDocumento61 páginasLa Celula PDFBrayan Martinez RodriguezAún no hay calificaciones
- El Experimento de Van HelmontDocumento1 páginaEl Experimento de Van Helmontalejandra navarroAún no hay calificaciones
- 1 Parte Derivados Lacteos 1 1 PDFDocumento8 páginas1 Parte Derivados Lacteos 1 1 PDFalejandra navarroAún no hay calificaciones
- Report 24 2020-07-30Documento14 páginasReport 24 2020-07-30alejandra navarroAún no hay calificaciones
- La Celula PDFDocumento61 páginasLa Celula PDFBrayan Martinez RodriguezAún no hay calificaciones
- Fascículo 2. Metabolismo Del IndividuoDocumento66 páginasFascículo 2. Metabolismo Del IndividuoCristian BarrosAún no hay calificaciones
- 1 Parte Derivados Lacteos 1 1 PDFDocumento8 páginas1 Parte Derivados Lacteos 1 1 PDFalejandra navarroAún no hay calificaciones
- Material de Estudio 1Documento3 páginasMaterial de Estudio 1alejandra navarroAún no hay calificaciones
- Analisis de Varianza 2012 PDFDocumento54 páginasAnalisis de Varianza 2012 PDFalex_msx13Aún no hay calificaciones
- Biología Grado Octavo EL CICLO MENSTRUALDocumento1 páginaBiología Grado Octavo EL CICLO MENSTRUALalejandra navarroAún no hay calificaciones
- Materias PrimasDocumento25 páginasMaterias PrimasClaudia Faria0% (1)
- Teorias Evolutivas Actividades PDFDocumento7 páginasTeorias Evolutivas Actividades PDFBenito Gomez100% (1)
- Enfermedades Transmitidas Por AlimentosDocumento25 páginasEnfermedades Transmitidas Por AlimentosRoss AngelesAún no hay calificaciones
- Osmorregulacic 3 B 3 NDocumento7 páginasOsmorregulacic 3 B 3 Nalejandra navarroAún no hay calificaciones
- Enfermedades Transmitidas Por AlimentosDocumento25 páginasEnfermedades Transmitidas Por AlimentosRoss AngelesAún no hay calificaciones
- Osmorregulacic3b3n PDFDocumento5 páginasOsmorregulacic3b3n PDFHeidita SanchezAún no hay calificaciones
- 7 Guia 4 PrimerperiodobiologasptimoDocumento6 páginas7 Guia 4 Primerperiodobiologasptimomaria silviaAún no hay calificaciones
- ISO 22000 Sistema de Gestión de Seguridad AlimentariaDocumento52 páginasISO 22000 Sistema de Gestión de Seguridad AlimentariaMarlenys HerediaAún no hay calificaciones
- 7 Guia 4 PrimerperiodobiologasptimoDocumento6 páginas7 Guia 4 Primerperiodobiologasptimomaria silviaAún no hay calificaciones
- Tabla No 4 - Refrigerante R12 2Documento3 páginasTabla No 4 - Refrigerante R12 2Jeam Jonathan Cabanillas CordovaAún no hay calificaciones
- 2 Ejercicios de EnergiaDocumento2 páginas2 Ejercicios de EnergiaYeisson R. Lopez Ruiz100% (1)
- Compresión múltiple indirecta: análisis teórico de etapas y potenciasDocumento8 páginasCompresión múltiple indirecta: análisis teórico de etapas y potenciasOsvaldo BorichAún no hay calificaciones
- KelvinDocumento4 páginasKelvinBRIAN JULIO SOLANOAún no hay calificaciones
- Termodinámica proceso agua cilindro-pistónDocumento3 páginasTermodinámica proceso agua cilindro-pistónJesus DavalosAún no hay calificaciones
- Ejercicios en Clase Funciones - Lukas - LoteroDocumento10 páginasEjercicios en Clase Funciones - Lukas - LoteroLukas L. AlvarezAún no hay calificaciones
- Guía Resumen Calor y TemperaturaDocumento18 páginasGuía Resumen Calor y TemperaturaCristian Andres Godoy ValdiviaAún no hay calificaciones
- Tabela Termopar Tipo JDocumento3 páginasTabela Termopar Tipo JGabriel SolinoAún no hay calificaciones
- Ejercicio 1Documento5 páginasEjercicio 1Harold Rodríguez MazaAún no hay calificaciones
- Equivalente Eléctrico Del CalorDocumento5 páginasEquivalente Eléctrico Del CalorCamila VelandiaAún no hay calificaciones
- Medición de la temperatura con termómetrosDocumento11 páginasMedición de la temperatura con termómetrosDaniel David Mantilla QuinteroAún no hay calificaciones
- Florentin ArguelloDocumento11 páginasFlorentin ArguellodelvisAún no hay calificaciones
- Temperatura Transferencia Del CalorDocumento6 páginasTemperatura Transferencia Del CalorPìpe ViillarrealAún no hay calificaciones
- Primera Ley de La TermodinámicaDocumento53 páginasPrimera Ley de La TermodinámicaJavier MejiaAún no hay calificaciones
- Iberica Del Calor CalefaccionDocumento84 páginasIberica Del Calor CalefaccionibericadelcalorAún no hay calificaciones
- Introducción a la Termodinámica: Temperatura, Calor y LeyesDocumento8 páginasIntroducción a la Termodinámica: Temperatura, Calor y LeyesAngel HTAún no hay calificaciones
- Thermodynamics (Unicor)Documento6 páginasThermodynamics (Unicor)Luis david Suarez UbarnesAún no hay calificaciones
- Solucion Examen Feb 13Documento7 páginasSolucion Examen Feb 13jose80% (5)
- Calor y TemperaturaDocumento5 páginasCalor y TemperaturaNoa NatividadAún no hay calificaciones
- Motor térmico: simulación de ciclo de Carnot con materiales caserosDocumento22 páginasMotor térmico: simulación de ciclo de Carnot con materiales caserosleonela espinoza quintoAún no hay calificaciones
- Tc900evo 2HPDocumento5 páginasTc900evo 2HPDaniel SamAún no hay calificaciones
- 1.SERVICIOS AUXILIARES Clase Ejercicio1.Documento5 páginas1.SERVICIOS AUXILIARES Clase Ejercicio1.Edal CenAún no hay calificaciones
- TemperaturaDocumento7 páginasTemperaturaPaola AvilaAún no hay calificaciones
- Una Planta Requiere Que 15 KGDocumento13 páginasUna Planta Requiere Que 15 KGlola50% (2)
- 10 Ejercicios de Conversion de Escala y Temperatura Xfavor Ayudemen - Brainly - LatDocumento7 páginas10 Ejercicios de Conversion de Escala y Temperatura Xfavor Ayudemen - Brainly - LatVidal Eduardo Gonzalez Vargas100% (1)
- Hoja de Problemas #04Documento4 páginasHoja de Problemas #04Paul Quiroz AliagaAún no hay calificaciones
- 28 Ejercicios Resueltos de Energhia Calo PDFDocumento27 páginas28 Ejercicios Resueltos de Energhia Calo PDFjuanchiAún no hay calificaciones
- PRACTICA 09 FisicoquímicaDocumento11 páginasPRACTICA 09 FisicoquímicaYanided ValladolisAún no hay calificaciones
- LAE Manual Spanish PDFDocumento12 páginasLAE Manual Spanish PDFEdwar ZamoraAún no hay calificaciones