Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Curva de Calibracion y Determ. de Grados Brix.
Cargado por
Jose CarbajalTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Curva de Calibracion y Determ. de Grados Brix.
Cargado por
Jose CarbajalCopyright:
Formatos disponibles
Instituto Tecnológico Superior De Venustiano Carranza
Ingeniería en industrias alimentarias
“Curva de calibración y determinación de grados brix”
Equipo:
González Tejada Alma Cinthya
Ramírez Martínez Eldai
Carbajal Rodríguez José Refugio
Aguirre Pelcastre Irving
Catedrática:
M. C. Marisol Valdez Márquez
Laboratorio de Química Analítica
Viernes 22 de febrero 2011; Venustiano Carranza, puebla
Ingeniería En Industrias Alimentarias Laboratorio De Química Analítica
Instituto Tecnológico Superior De Venustiano Carranza
OBJETIVO:
Saber que es una curva de calibración.
Realizar cálculos y obtener la cantidad de la sustancia que se utilizara para
trabajar en esta práctica.
Identificar los porcentajes de las soluciones, los cálculos de la cantidad de
los gramos que se utilizaran para la disolución.
Saber utilizar el refractómetro para determinar los grados brix.
Llevar a cabo la medición de los grados brix.
Observar la variación de los grados brix.
INTRODUCCIÓN:
La curva de calibración es un método que nos permite determinar la concentración
de una sustancia en una muestra desconocida mediante la comparación de la
muestra desconocida a una muestra de concentración conocida o sabida. (1)
Una curva de calibración es un método de química analítica que se usa para
determinar la concentración de una determinada sustancia.
Para hacer una curva de calibración se mide una propiedad, como por ejemplo la
absorbancia ( , es la cantidad de intensidad de luz que absorbe una muestra),
que es lo más común para curvas de calibrado, en función de la concentración,
para muestras de concentración conocida de la sustancia que se quiere
determinar en la muestra desconocida.
Esta propiedad varia linealmente con la concentración, por lo tanto midiendo
varias muestras de concentración conocida, se puede calcular una función
matemática de la recta y luego usarla para calcular la concentración de la muestra
desconocida midiendo la misma propiedad. (2)
La curva de calibración provee de una relación empírica, en comparación con
teórica.
La respuesta instrumental es generalmente altamente dependiente en la condición
del solvente utilizado y las impurezas puede contener; este podría ser afectado por
diferentes factores externos como, presión y temperatura.
Uno de los usos de la curva de calibración es el análisis de las concentraciones,
verificación del funcionamiento apropiado de un instrumento o de un dispositivo
así como la determinación de los efectos de un tratamiento del control. (3)
Ingeniería En Industrias Alimentarias Laboratorio De Química Analítica
Instituto Tecnológico Superior De Venustiano Carranza
Se necesita hacer un cálculo aproximado de la composición de su muestra
desconocida, para permitir la interpolación que las concentraciones de los
estándares deben bajar sobre y debajo de la concentración desconocida prevista.
En fin, hay muchos de información sobre el análisis en una curva de calibración y
es una manera simple explicar todos los factores que influencian que podrían
cambiar la señal analítica. (4)
MATERIAL Y EQUIPO:
MATERIALES SUSTANCIAS
Abate lengua (3 piezas) Glucosa (C6H12O6)
Balanza analítica (1) Agua (H2O)
Balanza digital (1)
Pipeta (1)
Probeta graduada (1)
Refractómetro (1)
Vasos de precipitado (3 piezas).
METODOLOGIA:
Ingeniería En Industrias Alimentarias Laboratorio De Química Analítica
Instituto Tecnológico Superior De Venustiano Carranza
1) Resolver los cálculos para conocer los gramos a disolver en 80 ml de agua
(H2O).
2) Pesar la glucosa (C6H12O6) en la balanza analítica.
3) Se tara primero el vaso de precipitado y posteriormente se introduce la
glucosa (C6H12O6) para poder pesarla.
4) Anotar el resultado
5) Pesar el agua para la solución.
6) Se coloco una parte del agua (H 2O) en un vaso de precipitado, se diluyeron
los 4g, 8g y12g de glucosa (C6H12O6). (Cada uno por separado).
7) Se virtieron en diferentes probetas y todas se aforaron a 80 ml.
8) Con ayuda del refractómetro se fue determinando la cantidad de los grados
brix.
9) El grado brix se determina colocando una gota de cada una de las
soluciones en el refractómetro.
10) Primero se tomo una pequeña muestra de la primera solución de 5%. de
glucosa (C6H12O6) y se deposita en la lente del refractómetro.
11) Después se siguió con la segunda solución de 10g% de glucosa (C 6H12O6 )
y se deposita en la lente del refractómetro.
12) Posteriormente seguimos con la tercera solución de 15% de glucosa
(C6H12O6) e igualmente se deposito en la lente del refractómetro.
13) Finalmente obtuvimos los resultados de los cálculos tanto de los grados de
la solución como de los grados brix.
OBSERVACIONES:
Ingeniería En Industrias Alimentarias Laboratorio De Química Analítica
Instituto Tecnológico Superior De Venustiano Carranza
Mediante la practica realizada se percató la variación de colores del agua (claro,
medio claro y café en fin se veían turbias) de acuerdo a la cantidad de glucosa
C6H12O6) y depositada en el agua (H2O).
Los grados brix se acercaban al porcentaje de las soluciones.
Ingeniería En Industrias Alimentarias Laboratorio De Química Analítica
Instituto Tecnológico Superior De Venustiano Carranza
RESULTADOS:
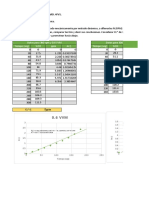
ML SOLUCIONES CALCULOS GRADOS BRIX
80 ml 5 4 4.8
80 ml 10 8 9.6
80 ml 15 12 14.7
Haciendo los cálculos:
5g-----------100% 10g-----------100% 5g-----------100%
? ----------- 80% ? ----------- 80% ? ----------- 80%
Los cálculos resueltos:
5g-----------100% 10g-----------100% 5g-----------100%
4g ----------- 80% 8g ----------- 80% 12g ----------- 80%
Se determinaron los resultados para la glucosa que se ocuparon para la disolución
obteniendo 4g, 8g y 12g.
Después de hacer los cálculos de los gramos de las soluciones se llevo a cabo la
medición de los grados brix de cada muestra.
1) 4.8
2) 9.6
3) 14.7
Ingeniería En Industrias Alimentarias Laboratorio De Química Analítica
Instituto Tecnológico Superior De Venustiano Carranza
CONCLUSIÓN:
La curva de calibración nos permite determinar la concentración de una sustancia
“x” mediante una comparación de una muestra que se conoce y una muestra de
concentración desconocida.
Al llevar a cabo los cálculos obtuvimos la cantidad de la sustancia para hacer la
concentración.
Al realizar las disoluciones se analizo la cantidad de los grados brix con la ayuda
del refractómetro obteniendo resultados acercados al porcentaje de las soluciones.
BIBLIOGRAFÍA:
(1) http://es.answers.yahoo.com/question/index?qid=20090308144422AAupDi9
(2) Skoog, Douglas A. Principios del análisis instrumental.
(3) Harris, Daniel Charles (2003) Análisis químico
(4) Lavagnini I, Magno F (2007). “Una descripción estadística en la calibración”
Ingeniería En Industrias Alimentarias Laboratorio De Química Analítica
También podría gustarte
- Determinación espectrofotométrica de cromo (VI) en muestra P-01Documento3 páginasDeterminación espectrofotométrica de cromo (VI) en muestra P-01Gerry ACAún no hay calificaciones
- Practica 5 Azucares ReductoresDocumento7 páginasPractica 5 Azucares ReductoresJV JhonnyAún no hay calificaciones
- Informe de RefractometriaDocumento14 páginasInforme de RefractometriaCieza Sanchez KarinaAún no hay calificaciones
- Curva crecimiento levadurasDocumento5 páginasCurva crecimiento levadurasluz lopezAún no hay calificaciones
- Informe RefractometriaDocumento13 páginasInforme RefractometriaBeatriz ReinosaAún no hay calificaciones
- Guía de Ejercicios #1 Balances de Masa en BioprocesosDocumento7 páginasGuía de Ejercicios #1 Balances de Masa en BioprocesosCatalina Zamora AstudilloAún no hay calificaciones
- RefractometriaDocumento13 páginasRefractometriaLorena BCAún no hay calificaciones
- Cultivo por lote y remoción de fenol con Pseudomonas y CandidaDocumento4 páginasCultivo por lote y remoción de fenol con Pseudomonas y CandidaMarco Ruíz Alonso100% (1)
- Destilación 5 - BMEDocumento2 páginasDestilación 5 - BMELilith D'moonAún no hay calificaciones
- Lab 8Documento11 páginasLab 8Santiago Bonilla VelasquezAún no hay calificaciones
- Dispersion de LiquidosDocumento15 páginasDispersion de Liquidosdxnny1234Aún no hay calificaciones
- Reporte 1Documento20 páginasReporte 1Samir OlveraAún no hay calificaciones
- Cálculo de KLA Por Método DinámicoDocumento7 páginasCálculo de KLA Por Método DinámicoGirard GarciaAún no hay calificaciones
- Gravimetría de PrecipitaciónDocumento6 páginasGravimetría de Precipitaciónadriana vertelAún no hay calificaciones
- Tarea de BiotecnologiaDocumento4 páginasTarea de BiotecnologiaMatt Huber Huanca SancaAún no hay calificaciones
- Arreglada 1GUIA DE PROCESOS DE ESTOCASTICOS Mejoradaaaa-1 PDFDocumento38 páginasArreglada 1GUIA DE PROCESOS DE ESTOCASTICOS Mejoradaaaa-1 PDFAnnabeth C. ChaseAún no hay calificaciones
- Seminario Iv-V BiotecnologiaDocumento2 páginasSeminario Iv-V Biotecnologialuis fernando muro cordovaAún no hay calificaciones
- Ejemplo 5 y 6Documento1 páginaEjemplo 5 y 6ArellyAún no hay calificaciones
- Cromatografia para Purificación de ProteínasDocumento55 páginasCromatografia para Purificación de ProteínasAlejandro VieyraAún no hay calificaciones
- Resultados p4Documento6 páginasResultados p4Juan Emanuel VGAún no hay calificaciones
- Maria Moreira (Taller 1)Documento11 páginasMaria Moreira (Taller 1)Maria Jose MoreiraAún no hay calificaciones
- LEY DE RAOULT Y SUS APLICACIONES EN SOLUCIONES IDEALESDocumento2 páginasLEY DE RAOULT Y SUS APLICACIONES EN SOLUCIONES IDEALESLuxecitaVicenteAún no hay calificaciones
- Informe EntalpiaDocumento16 páginasInforme EntalpiaMary_Coll03Aún no hay calificaciones
- ProblemarioDocumento10 páginasProblemariomagAún no hay calificaciones
- Prac 6Documento7 páginasPrac 6Lina KimAún no hay calificaciones
- Química II Clase 9 FinalDocumento24 páginasQuímica II Clase 9 FinalEsteban GonzalezAún no hay calificaciones
- Práctica 7Documento8 páginasPráctica 7Jose Luis Garcia MariscalAún no hay calificaciones
- CONDUCTANCIA ELECTROLÍTICA Y TITULACIÓN CONDUCTIMÉTRICA ListoDocumento17 páginasCONDUCTANCIA ELECTROLÍTICA Y TITULACIÓN CONDUCTIMÉTRICA ListofraviezAún no hay calificaciones
- Práctica 5. Determinacion Del Pka Del Ácido AcetilsalicílicoDocumento5 páginasPráctica 5. Determinacion Del Pka Del Ácido AcetilsalicílicoKevin Alexis Madrigal HernandezAún no hay calificaciones
- Taller 5Documento6 páginasTaller 5MarthaLuceroPerez0% (1)
- Reacciones MultisustratoDocumento12 páginasReacciones MultisustratoKarla Alejo GonzalezAún no hay calificaciones
- Problemas Cap - 10 Destilacion PDFDocumento4 páginasProblemas Cap - 10 Destilacion PDFCristian GomezAún no hay calificaciones
- Ejercicios BioreactoresDocumento7 páginasEjercicios BioreactoresAndres David MontenegroAún no hay calificaciones
- P4 AspirinaDocumento20 páginasP4 AspirinaAndrea LemusAún no hay calificaciones
- Informe 1 - Analisis InstrumentalDocumento6 páginasInforme 1 - Analisis InstrumentalVicky SalazarAún no hay calificaciones
- Métodos Cromatográficos ITSCDocumento7 páginasMétodos Cromatográficos ITSCjulio pineda urbinaAún no hay calificaciones
- Reactor PFRDocumento9 páginasReactor PFRJeisonAún no hay calificaciones
- Isoterma de KhanDocumento4 páginasIsoterma de KhanMoyses Alphonsus Altum Mare LiconensisAún no hay calificaciones
- Taller - Prop. - Coligativas - y - PH SoluDocumento3 páginasTaller - Prop. - Coligativas - y - PH Soluaber0523Aún no hay calificaciones
- Práctica 6Documento5 páginasPráctica 6Rodrigo Manuel Bravo PachecoAún no hay calificaciones
- Sexta SemanaDocumento95 páginasSexta SemanaRenatoBriggesLoayzaAún no hay calificaciones
- Análisis Cromatográfico de Pesticidas en Muestras de AguaDocumento5 páginasAnálisis Cromatográfico de Pesticidas en Muestras de AguaEstefano BlasAún no hay calificaciones
- Problemario 2 Capítulo 7 y 12Documento3 páginasProblemario 2 Capítulo 7 y 12Karim 'SolizAún no hay calificaciones
- Tercer Parcial, Gráficas de Excel - Laura Alejandra GutiérrezDocumento10 páginasTercer Parcial, Gráficas de Excel - Laura Alejandra GutiérrezLaura Alejandra GutierrezAún no hay calificaciones
- Pectinasas para ClarificaciónDocumento5 páginasPectinasas para ClarificaciónElizabeth L H LopezAún no hay calificaciones
- Wankat 4D33Documento15 páginasWankat 4D33MaruriAún no hay calificaciones
- Prod de B Carotenos y Callo SemiDocumento29 páginasProd de B Carotenos y Callo SemiDiego OcampoAún no hay calificaciones
- Determinacion de Cafeina en Pepsi y CocaDocumento8 páginasDeterminacion de Cafeina en Pepsi y CocaPaola Andrea Zuñiga CortesAún no hay calificaciones
- Reacciones químicas y balances de masaDocumento7 páginasReacciones químicas y balances de masaBreynerChunquiSuarezAún no hay calificaciones
- Ejercicio de Platos Teoricos de Torre de DestilacionDocumento5 páginasEjercicio de Platos Teoricos de Torre de DestilacionDilan Michel Rojas BautistaAún no hay calificaciones
- Resolución de ejercicios de transferencia de masaDocumento25 páginasResolución de ejercicios de transferencia de masaKevin Joshue Zambrano DelgadoAún no hay calificaciones
- Bioprocesos CuestionarioDocumento7 páginasBioprocesos CuestionarioDaniel LoorAún no hay calificaciones
- Conservación de E. coli y Streptomyces sp mediante criopreservaciónDocumento2 páginasConservación de E. coli y Streptomyces sp mediante criopreservaciónJavier ClarosAún no hay calificaciones
- Métodos de estructura electrónica y química computacionalDocumento11 páginasMétodos de estructura electrónica y química computacionalSandra SalazarAún no hay calificaciones
- El Punto IsoeléctricoDocumento9 páginasEl Punto IsoeléctricoDainer SalgadoAún no hay calificaciones
- Rigidez de Nodos Metabólicos en La Producción de Lisina y PHB Desarrollado Por Los AlumnosDocumento8 páginasRigidez de Nodos Metabólicos en La Producción de Lisina y PHB Desarrollado Por Los AlumnosKeysi MoralesAún no hay calificaciones
- Innmovilizacion Celulas de Levadura G3 TraducidoDocumento12 páginasInnmovilizacion Celulas de Levadura G3 TraducidoAlisonAún no hay calificaciones
- Metodo BradfordDocumento8 páginasMetodo BradfordGoOfysS FLGAún no hay calificaciones
- CurvaCalibraciónSacarosaDocumento8 páginasCurvaCalibraciónSacarosaRey AgamaAún no hay calificaciones
- Tecnicas MicrobiologicasDocumento4 páginasTecnicas MicrobiologicasJose CarbajalAún no hay calificaciones
- CETONASDocumento1 páginaCETONASJose CarbajalAún no hay calificaciones
- Reporte 1Documento5 páginasReporte 1Jose CarbajalAún no hay calificaciones
- FrutasdealmibarDocumento30 páginasFrutasdealmibarmikisimeAún no hay calificaciones
- Química Inorgánica Taller Semanal N°7 Unidad 03: Cálculos Químicos Y Calidad Del Agua Integrantes NotaDocumento3 páginasQuímica Inorgánica Taller Semanal N°7 Unidad 03: Cálculos Químicos Y Calidad Del Agua Integrantes NotacristhianAún no hay calificaciones
- La Química Es La Ciencia Que Estudia Tanto La ComposiciónDocumento44 páginasLa Química Es La Ciencia Que Estudia Tanto La ComposiciónNicole ChicaizaAún no hay calificaciones
- NORMA D 512 - 89 R99 Métodos de Prueba Estándar para Ion Cloruro de AguaDocumento8 páginasNORMA D 512 - 89 R99 Métodos de Prueba Estándar para Ion Cloruro de Aguavictor hugoAún no hay calificaciones
- Informe Nº2-Química General A2Documento17 páginasInforme Nº2-Química General A2Jose Carlos Salgado Arimana100% (3)
- Análisis de Compuestos Orgánicos Volátiles en El Aire de Los Lugares de TrabajoDocumento6 páginasAnálisis de Compuestos Orgánicos Volátiles en El Aire de Los Lugares de TrabajoFelipe LabiosAún no hay calificaciones
- Reporte Practica 2Documento5 páginasReporte Practica 2ANDREA MARTINEZ BECERRILAún no hay calificaciones
- Capítulo I Introducción Al Análisis InstrumentalDocumento18 páginasCapítulo I Introducción Al Análisis InstrumentalSaul PjAún no hay calificaciones
- Titulaciones Volumetricas PDFDocumento38 páginasTitulaciones Volumetricas PDFdiegoAún no hay calificaciones
- Como Calcular Dosis PediátricasDocumento7 páginasComo Calcular Dosis PediátricasDaniel100% (1)
- 139scfi2012mod VainillaDocumento6 páginas139scfi2012mod VainillaRoselenitaAún no hay calificaciones
- Cuantificación de Azúcares ReductoresDocumento3 páginasCuantificación de Azúcares ReductoresFreddie Roland PinchiAún no hay calificaciones
- Validacion metodos-METODO HORWICH PDFDocumento41 páginasValidacion metodos-METODO HORWICH PDFlesliAún no hay calificaciones
- Estados de Agregación y Disoluciones: Anexo - Tarea 3 Tablas para El Desarrollo de Los EjerciciosDocumento10 páginasEstados de Agregación y Disoluciones: Anexo - Tarea 3 Tablas para El Desarrollo de Los EjerciciosnanaAún no hay calificaciones
- 02 Sol - Ideal 1 PDFDocumento8 páginas02 Sol - Ideal 1 PDFIrma TaipeAún no hay calificaciones
- TALLER Disoluciones y Diluciones IntesemestralDocumento3 páginasTALLER Disoluciones y Diluciones IntesemestralDIEGO CAMILO ORTEGA VELASQUEZAún no hay calificaciones
- Examen Teorico FinalDocumento4 páginasExamen Teorico FinalWendoly Gil PattonAún no hay calificaciones
- CajetaDocumento6 páginasCajetavera_torres_3Aún no hay calificaciones
- Limite de Detección Cu+2Documento13 páginasLimite de Detección Cu+2Lolo WestAún no hay calificaciones
- Taller 4 - Transf Masa IntDocumento3 páginasTaller 4 - Transf Masa IntEyvind Andres Rondon RinconAún no hay calificaciones
- Dinamicas de Membrana Celular 1Documento5 páginasDinamicas de Membrana Celular 1Gilda Quispe ColomaAún no hay calificaciones
- Practica 3 PrincipiosDocumento4 páginasPractica 3 PrincipiosNadia Montero GonzálezAún no hay calificaciones
- FisicoquimicaDocumento21 páginasFisicoquimicasacuna4111Aún no hay calificaciones
- PD FQ 3 Eso 1011Documento30 páginasPD FQ 3 Eso 1011cienciasmcrespo2010Aún no hay calificaciones
- PDF Bebidas Final DLDocumento15 páginasPDF Bebidas Final DLjunior jarata rodriguezAún no hay calificaciones
- Analisis de AguaDocumento18 páginasAnalisis de AguaJuliana Guerrero PacherresAún no hay calificaciones
- Informe de SolucionesDocumento7 páginasInforme de SolucionesH Ronny C ValarezoAún no hay calificaciones
- Las Espumas en La Extincion de IncendiosDocumento24 páginasLas Espumas en La Extincion de IncendiosAngelo Martel VillavicencioAún no hay calificaciones
- Sesión 7 - Estudio de Límites Inferiores - Guía CLSI EP 17-A2Documento14 páginasSesión 7 - Estudio de Límites Inferiores - Guía CLSI EP 17-A2oswaldo sanabriaAún no hay calificaciones
- Examen Bryan Angulo Calidad Del Aire.c10Documento6 páginasExamen Bryan Angulo Calidad Del Aire.c10Bryan CafuAún no hay calificaciones
- Taller 3 FisicoquimicaDocumento3 páginasTaller 3 FisicoquimicaMiguel Angel Rozo ArangoAún no hay calificaciones